【高效备课】华师大版科学九上同步课件--24.专题:混合物的除杂(课件 17张PPT)
文档属性
| 名称 | 【高效备课】华师大版科学九上同步课件--24.专题:混合物的除杂(课件 17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 483.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-08-20 19:41:48 | ||
图片预览






文档简介
(共17张PPT)
混合物的除杂
——余老师
00
物质的分离和除杂有什么区别?
物质分离:要求物质分开且恢复原状。
物质除杂:只要求将杂质除去,不要求恢复原状。
解题原则:
1.不引入新杂质
2.不减少被提纯物质的质量
要求更高
3.杂质便于分离
解题思路:
分析性质差异
物理性质化学性质
确定除杂质方法
物理方法化学方法
选择适宜试剂
除杂方法
01
STEP
01
除杂方法
1.物理方法
1.过滤:
分离或除去不溶性或可溶性物质
如:粗盐提纯
分离溶液和沉淀
制取氧气后,分离二氧化锰和氯化钾
01
除杂方法
1.物理方法
2.降温结晶:
溶解度受温度影响大的物质中含有溶解度受温度影响较小的物质。
如:硝酸钾(氯化钠)
硝酸钠(氯化钾)
01
除杂方法
1.物理方法
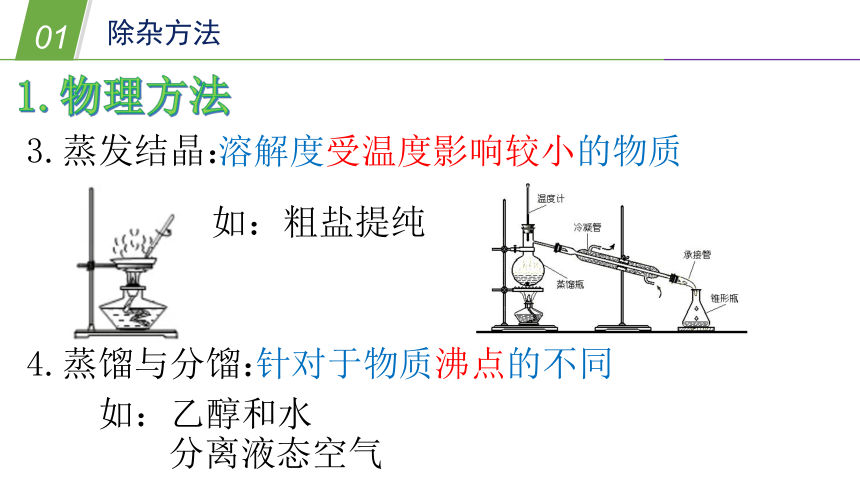
3.蒸发结晶:
溶解度受温度影响较小的物质
如:粗盐提纯
4.蒸馏与分馏:
针对于物质沸点的不同
如:乙醇和水
分离液态空气
01
除杂方法
2.化学方法
1.沉淀法:
把杂质转化为沉淀
如:氯化钠(氯化钙)
适量Na2CO3
稀盐酸(稀硫酸)
适量BaCl2
2.气化法:
把杂质转化为气体
如:氯化钾(碳酸钾)
硫酸钠(碳酸钠)
适量稀HCl
适量稀H2SO4
杂质多为碳酸盐
过滤
过滤
01
除杂方法
2.化学方法
3.洗气吸收法:
将杂质气体吸收除去
如:一氧化碳(二氧化碳)
NaOH
二氧化碳(氯化氢)
饱和NaHCO3
4.酸碱反应法:
用酸或碱把固体物质中的杂质转化为液体而除去
如:铜(氧化铜)
稀H2SO4或稀HCl
过滤
01
除杂方法
2.化学方法
5.转化法:
将杂质用化学试剂转化为所需物质
①加热灼烧法
如:纯碱(小苏打)
2NaHCO3 Na2CO3+H2O+CO2↑
氧化铜(铜)
2Cu+O2 2CuO
②氧化还原法
如:二氧化碳(一氧化碳)
灼热的氧化铜
CuO+CO Cu +CO2
铜(氧化铜)
H2或CO
CuO+H2 Cu +H2O
01
除杂方法
2.化学方法
5.转化法:
将杂质用化学试剂转化为所需物质
③置换法
如:Zn(NO3)2中含AgNO3
用活泼金属置换盐中的不活泼金属元素,而达到除杂的目的。
过量Zn
2AgNO3+Zn= Zn(NO3)2 +2Ag
过滤
相关题型
02
STEP
02
相关题型
例1.除去下列各物质中的少量杂质,所选用的试剂及方法均正确的是( )
选项 物质 杂质 试剂 方法
A CO2 CO O2 点燃
B NaOH溶液 Na2CO3 过量盐酸 加热蒸发
C CaCO3 CaO - 高温
D Cu粉 Fe粉 足量稀硫酸 过滤、洗涤、干燥
D
会反应
点不着
分解为杂质
不反应
反应
02
相关题型
例2.除去下列物质中混有的少量杂质(括号中的物质为杂质)所设计的实验方案或操作中,合理的是( )
A.KNO3晶体(NaCl):将固体溶于水,配制成热的饱和溶液,采用降温结晶的方法
B.CO2气体(HCl):将气体通过装有NaOH溶液的洗气瓶
C.BaCl2溶液[Ba(OH)2]:加入适量的稀硫酸,过滤
D.O2(N2):将混合气体通过炽热的铜网
溶解度受温度影响大
溶解度受温度影响小、量少
析出
两种气体都能和NaOH反应
两种物质都能和稀硫酸反应
O2被消耗
A
02
相关题型
综合题
例3.实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,某校化学兴趣小组的同学,按下图所示进行实验:
(1)若A是相对分子质量最小的氧化物,
则A是 ;无色气体是 。
(2)该粉末中一定不含 ,操作1的名称是 。
(3)为了不干扰对第③步实验现象的判断,试剂B最好选择 ,请写出步骤③的化学方程式: 。
NaCl
Na2SO4
Na2CO3
FeCl3
H2O
02
相关题型
NaCl
Na2SO4
Na2CO3
FeCl3
H2O
可能存在
CO2
酸
过滤
无CO32-
有SO42-
02
相关题型
综合题
例3.实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,某校化学兴趣小组的同学,按下图所示进行实验:
(1)若A是相对分子质量最小的氧化物,
则A是 ;无色气体是 。
(2)该粉末中一定不含 ,操作1的名称是 。
(3)为了不干扰对第③步现象的判断,试剂B最好选择 ,请写出步骤③的化学方程式: 。
CO2
H2O
FeCl3
过滤
稀HCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
感谢聆听
加油
混合物的除杂
——余老师
00
物质的分离和除杂有什么区别?
物质分离:要求物质分开且恢复原状。
物质除杂:只要求将杂质除去,不要求恢复原状。
解题原则:
1.不引入新杂质
2.不减少被提纯物质的质量
要求更高
3.杂质便于分离
解题思路:
分析性质差异
物理性质化学性质
确定除杂质方法
物理方法化学方法
选择适宜试剂
除杂方法
01
STEP
01
除杂方法
1.物理方法
1.过滤:
分离或除去不溶性或可溶性物质
如:粗盐提纯
分离溶液和沉淀
制取氧气后,分离二氧化锰和氯化钾
01
除杂方法
1.物理方法
2.降温结晶:
溶解度受温度影响大的物质中含有溶解度受温度影响较小的物质。
如:硝酸钾(氯化钠)
硝酸钠(氯化钾)
01
除杂方法
1.物理方法
3.蒸发结晶:
溶解度受温度影响较小的物质
如:粗盐提纯
4.蒸馏与分馏:
针对于物质沸点的不同
如:乙醇和水
分离液态空气
01
除杂方法
2.化学方法
1.沉淀法:
把杂质转化为沉淀
如:氯化钠(氯化钙)
适量Na2CO3
稀盐酸(稀硫酸)
适量BaCl2
2.气化法:
把杂质转化为气体
如:氯化钾(碳酸钾)
硫酸钠(碳酸钠)
适量稀HCl
适量稀H2SO4
杂质多为碳酸盐
过滤
过滤
01
除杂方法
2.化学方法
3.洗气吸收法:
将杂质气体吸收除去
如:一氧化碳(二氧化碳)
NaOH
二氧化碳(氯化氢)
饱和NaHCO3
4.酸碱反应法:
用酸或碱把固体物质中的杂质转化为液体而除去
如:铜(氧化铜)
稀H2SO4或稀HCl
过滤
01
除杂方法
2.化学方法
5.转化法:
将杂质用化学试剂转化为所需物质
①加热灼烧法
如:纯碱(小苏打)
2NaHCO3 Na2CO3+H2O+CO2↑
氧化铜(铜)
2Cu+O2 2CuO
②氧化还原法
如:二氧化碳(一氧化碳)
灼热的氧化铜
CuO+CO Cu +CO2
铜(氧化铜)
H2或CO
CuO+H2 Cu +H2O
01
除杂方法
2.化学方法
5.转化法:
将杂质用化学试剂转化为所需物质
③置换法
如:Zn(NO3)2中含AgNO3
用活泼金属置换盐中的不活泼金属元素,而达到除杂的目的。
过量Zn
2AgNO3+Zn= Zn(NO3)2 +2Ag
过滤
相关题型
02
STEP
02
相关题型
例1.除去下列各物质中的少量杂质,所选用的试剂及方法均正确的是( )
选项 物质 杂质 试剂 方法
A CO2 CO O2 点燃
B NaOH溶液 Na2CO3 过量盐酸 加热蒸发
C CaCO3 CaO - 高温
D Cu粉 Fe粉 足量稀硫酸 过滤、洗涤、干燥
D
会反应
点不着
分解为杂质
不反应
反应
02
相关题型
例2.除去下列物质中混有的少量杂质(括号中的物质为杂质)所设计的实验方案或操作中,合理的是( )
A.KNO3晶体(NaCl):将固体溶于水,配制成热的饱和溶液,采用降温结晶的方法
B.CO2气体(HCl):将气体通过装有NaOH溶液的洗气瓶
C.BaCl2溶液[Ba(OH)2]:加入适量的稀硫酸,过滤
D.O2(N2):将混合气体通过炽热的铜网
溶解度受温度影响大
溶解度受温度影响小、量少
析出
两种气体都能和NaOH反应
两种物质都能和稀硫酸反应
O2被消耗
A
02
相关题型
综合题
例3.实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,某校化学兴趣小组的同学,按下图所示进行实验:
(1)若A是相对分子质量最小的氧化物,
则A是 ;无色气体是 。
(2)该粉末中一定不含 ,操作1的名称是 。
(3)为了不干扰对第③步实验现象的判断,试剂B最好选择 ,请写出步骤③的化学方程式: 。
NaCl
Na2SO4
Na2CO3
FeCl3
H2O
02
相关题型
NaCl
Na2SO4
Na2CO3
FeCl3
H2O
可能存在
CO2
酸
过滤
无CO32-
有SO42-
02
相关题型
综合题
例3.实验室有一包粉末状物质。可能是氯化钠、硫酸钠、碳酸钠、氯化铁中的一种或几种组成,为了确定原粉末的成分,某校化学兴趣小组的同学,按下图所示进行实验:
(1)若A是相对分子质量最小的氧化物,
则A是 ;无色气体是 。
(2)该粉末中一定不含 ,操作1的名称是 。
(3)为了不干扰对第③步现象的判断,试剂B最好选择 ,请写出步骤③的化学方程式: 。
CO2
H2O
FeCl3
过滤
稀HCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
感谢聆听
加油
