1.3.2氧化剂还原剂 课件(共38张PPT) 高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 1.3.2氧化剂还原剂 课件(共38张PPT) 高中化学 人教版(2019) 必修 第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 184.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-20 19:39:16 | ||
图片预览









文档简介
(共38张PPT)
氧化剂和还原剂
1、氧化还原反应的特征和本质是什么?
特征:元素化合价的变化
本质:电子的转移(得失或偏移)
2、在氧化还原反应中什么物质发生了氧化反应?什么物质发生了还原反应呢?这些物质有什么特征?具有什么性质?反应后得到什么物质?
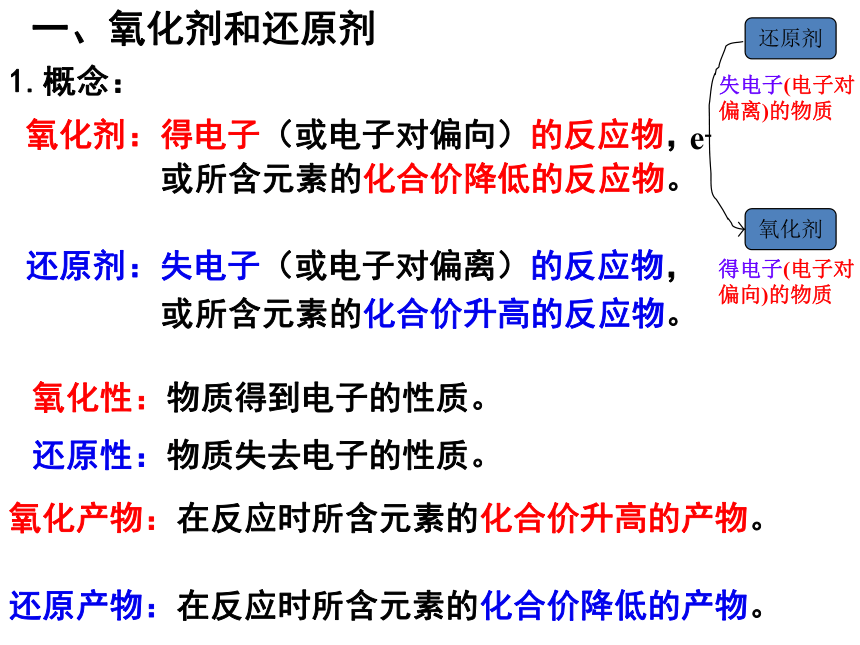
氧化剂:得电子(或电子对偏向)的反应物,
或所含元素的化合价降低的反应物。
还原剂:失电子(或电子对偏离)的反应物,
或所含元素的化合价升高的反应物。
一、氧化剂和还原剂
1.概念:
氧化性:物质得到电子的性质。
还原性:物质失去电子的性质。
还原产物:在反应时所含元素的化合价降低的产物。
氧化产物:在反应时所含元素的化合价升高的产物。
e-
得电子(电子对偏向)的物质
失电子(电子对偏离)的物质
还原剂
氧化剂
有还原性,失电子,化合价升高,被氧化,发生氧化反应
有氧化性,得电子,化合价降低,被还原,发生还原反应
氧化剂
+ 还原剂
还原产物
+ 氧化产物
2.氧化还原反应基本概念之间的关系
口诀:失—升—氧化—还原剂,
得—降—还原—氧化剂
例:用双线桥标出下列反应电子转移的方向和数目,并指明氧化剂和还原剂、氧化产物和还原产物。
(2)Cl2 + 2NaOH NaCl + NaClO + H2O
(1) 2Al + Fe2O3 2Fe + Al2O3
高温
(3) MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑
Δ
失2×3e-,化合价升高,被氧化
得2×3e-,化合价降低,被还原
(1) 2Al + Fe2O3 2Fe + Al2O3
高温
0 +3 0 +3
氧化剂: Fe2O3
还原剂:Al
氧化产物: Al2O3
还原产物: Fe
(2)Cl2 + 2NaOH NaCl + NaClO + H2O
失1×e-,化合价升高,被氧化
得1×e-,化合价降低,被还原
0 -1 +1
氧化剂、还原剂:Cl2
氧化产物:NaClO
还原产物:NaCl
得1×2e-,化合价降低,被还原
失2×e-,化合价升高,被还原
Δ
(3) MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑
+4 -1 +2 0
氧化剂:MnO2
还原剂:HCl
氧化产物:Cl2
还原产物:MnCl2
-2 -1 0 +4 +6
只能作还原剂
只能作氧化剂
既能作还原剂,
又能作氧化剂
⑴氧化(还原)剂的条件(以S为例)
3.常见的氧化剂、还原剂
高价氧化低价还,中间价态两边转
⑵常见的氧化剂:能得电子,具有氧化性(含较高价态元素的物质)。
①活泼非金属单质:O2 、 O3 、Cl2等
②高价氧化物:MnO2、CuO、Fe2O3等
③高价含氧酸、盐:浓H2SO4、HNO3、 MnO4-、Fe3+ 等
④不活泼金属的阳离子及酸:Ag+、Cu2+等
⑤过氧化物,如Na2O2、H2O2等。
⑶常见的还原剂:能失电子,具有还原性(含较低价态元素)的物质。
①活泼的金属单质。
②部分非金属单质,如H2、C、S、Si等。
③低价的氧化物,如CO、SO2等。
④低价酸、盐,如H2SO3 、HI、H2S、SO32-、I- 、S2- 、Fe2+等。
1.判断下列说法正确的是 。
A.金属在化学反应中只做还原剂
B.非金属在化学反应中只做氧化剂
C.被氧化的是氧化剂,被还原的是还原剂
D. 氧化剂失去电子的数目一定等于还原剂得到电子的数目
E.失电子的反应是氧化反应,失电子的物质是还原剂
AE
课堂练习
2.苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
B
3. 反应:NaH+H2O = NaOH+H2↑ 对这一反应的描述正确的是( )
A.NaH是氧化剂 B.NaH被还原
C.NaOH是还原产物
D.氧化产物与还原产物的质量比是1:1
D
4.已知反应①SO3 + H2O = H2SO4
②Cl2 + H2O = HCl + HClO
③2F2 + 2H2O = 4HF + O2
④2Na + 2H2O = 2NaOH + H2 ↑
⑤ SiO2 + 2NaOH = Na2SiO3 + H2O
其中不属于氧化还原反应的有 ,H2O做还原剂的是______,H2O做氧化剂的是______,属于氧化还原反应,但水既不做氧化剂又不做还原剂的是______ 。
① ⑤
③
④
②
作业本:课本27、28页课后习题。
氧化性还原性强弱比较
氧化性强弱:物质得电子越容易,其氧化性就越强。
还原性强弱:物质失电子越容易,其还原性就越强。
氧化性、还原性的强弱取决于物质得失电子的难易程度,与得失电子数目的多少无关。
二、氧化性还原性强弱比较
1.根据反应方程式来比较
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
“强” 制“弱”
例1:根据下列三个氧化还原反应:
(1)2 Fe3+ + 2 I- = 2Fe2+ + I2
(2)2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
试比较:
① Cl2 、Fe3+ 、I2三四种微粒的氧化性强弱
② Cl- 、Fe2+、I-三四种微粒的还原性强弱
Cl2 > Fe3+ > I2
I- > Fe2+ > Cl-
例2:已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,还原性的强弱顺序:Cl-< Fe2+ < H2O2 < I- < SO2。则下列反应不能发生的是( )
①2Fe3++ SO2 + 2H2O = 2Fe2++ SO42- + 4H+
②Cl2 + SO2+ 2H2O = H2SO4 + 2HCl
③H2O2+ 2H++ SO42- = SO2↑ + O2↑ + 2H2O
A.① B.② C.③ D.① ②
C
2 .根据金属活动性顺序进行判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Fe3+Hg2+ Ag+
得电子能力逐渐增强,氧化性逐渐增强
如:还原性:Mg>Zn>Cu
氧化性:Cu2+>Zn2+>Mg2+
越易失e-的物质,失去后就越难得e-;
越易得e-的物质,得到后就越难失e-。
3.根据与同种物质反应生成不同价态产物的情况判断。
氧化性:Cl2>S
4.根据反应条件判断
与同物质反应,产物相同时,条件越简单,氧化性或还原性越强。
从是否加热、温度高低、有无催化剂等方面判断。如:
氧化性:KMnO4>KClO3>MnO2
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
KClO3 + 6HCl (浓) KCl + 3Cl2↑ + 3H2O
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
△
5.某些物质的氧化性或还原性还与“三度”有关:
温度:温度升高,某些物质的氧化性或还原性增强。
浓度:同物质,一般浓度越大,其氧化性或还原性越强。
如氧化性:浓硫酸>稀硫酸,浓硝酸>稀硝酸
还原性:浓盐酸>稀盐酸
酸碱度:
如,碱性和中性环境中NO3-不显氧化性;
酸性环境中NO3-显强氧化性;
MnO4-的氧化性随溶液酸性的增强而增强。
练习:1、请用双线桥法表示出下列反应中电子转移情况并指出各反应的氧化剂、还原剂、氧化产物、还原产物。
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
2、用双(单)线桥表示下列氧化还原反应的电子转移,并指出氧化剂、还原剂、氧化产物和还原产物。
4P +3KOH+3H2O = 3KH2PO2+PH3
4P + 3KOH + 3H2O = 3KH2PO2 + PH3
得1×3e- ,化合价降低,被还原
0
-3
+1
失3×e- ,化合价升高,被氧化
3e-
氧化剂: P
还原剂:P
氧化产物: KH2PO2
还原产物: PH3
氧化还原反应的基本规律
例:下列粒子既有氧化性又有还原性的是( )
A.Cu2+ B.Cl- C.Al D.Fe2+
三、氧化还原反应的规律
1.价态规律:
⑴元素处于最高价,只有氧化性
如Fe3+、MnO4- 、浓H2SO4等。
⑵元素处于最低价,只有还原性
如金属单质、Cl-、Br -、I -、S 2-等。
⑶元素处于中间价态,既有氧化性又有还原性
如Fe2+ 、Cl2、H2O2等。
应用:判断物质有无氧化性、还原性。
D
2.先后规律:某氧化剂(或还原剂)同时与几种还原剂(或氧化剂)相遇时,还原性(氧化性)最强的先反应。
强者先行
应用:判断反应的先后顺序或是否能够发生。
例:在含有Al2(NO3)3、 Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,最先置换出的是( )
A.Al B.Cu C.Ag D. Mg
C
3.守恒规律:电子得失总数相等或化合价升降数相等。
应用:有关氧化还原反应的计算及其方程式的配平。
例:一定条件下,PbO2与Cr3+反应,产物是Cr2O72 -和Pb2+,则与1个 Cr3+反应需要 个PbO2
1.5
3.守恒规律:电子得失总数相等或化合价升降数相等。
4.转化规律:
①同种元素不同价态之间邻价转化最容易。
②同种元素相邻价态之间不发生氧化还原反应。
如浓H2SO4与SO2不能反应。
结论:a.强氧化剂与强还原剂不一定能反应;
b.SO2气体可用浓H2SO4干燥。
H2SO4 (浓) + H2S = SO2 + S ↓ + 2H2O
失1×2e-,化合价升高,被氧化
得1×2e-,化合价降低,被还原
+6 -2 +4 0
应用:有关氧化还原反应的计算及反应能否进行。
例:2KClO3 + 4HCl = 2KCl + 2ClO2 ↑ + Cl2↑ + 2H2O
(1)请标出上述氧化还原反应的电子转移方向和总数。
(2)其氧化剂是 ,还原剂 ,氧化产物和还原产物的物质的量比为 。
(3)当生成1molCl2时,有 mol的HCl被氧化。
(4)当生成a个ClO2分子时,电子转移数为 个。
2e-
KClO3
HCl
2
1:2
a
注:在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。
四、离子共存问题
① Fe3+与S2-、I-等不能大量共存。
② NO3- + H+组合(强氧化性) 、MnO4-、ClO-均与Fe2+、SO32-、S2-、I-等不能大量共存。
例1:在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Fe2+、K+、Cl-、NO3-
B.Ag+、Na+、NO3-、MnO4-
C.Mg2+、Al3+、SO42-、Cl-
D.Ca2+、NH4+、Cl-、HCO3-
C
因发生氧化还原反应而不能大量共存的离子:
例2:下列离子在对应的溶液中能大量共存的是( )
A.pH=0的溶液中:Na+、CO32- 、ClO-、I-
B.在能使酚酞试液变红的溶液中:
Ca2+、Ba2+、NO3- 、HCO3-
C.在含有Cl-、Ba2+的溶液中:
Na+、K+、HCO3-、NO3-
D.在无色透明溶液中:
Ba2+、Cu2+、Mg2+、NO3-、SO32-
C
1.下列三个氧化还原反应:
(1)2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
(2)2FeCl2 + Cl2 = 2FeCl3
(3)2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
若某溶液中有Fe2+、I- 、 Cl-共存,要除去I-而不影响Fe2+和Cl-,则可加入的试剂是( )。
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
C
课堂练习
2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4FeI3
B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O
D.2Fe3+ + 2I- = 2Fe2+ + I2
A
3.有下列三个反应:
①Cl2 + FeI2= FeCl2 + I2
②2Fe2++ Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑ + 3H2O,
下列说法中正确的是( )
A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+
C.在反应③中生成1 个Cl2时,有2个 HCl被氧化
D.可以发生:Cl2 + FeBr2 = FeCl2+Br2
C
4.在6HCl + KClO3 = KCl + 3Cl2 + 3H2O的反应中,得到和失去电子的原子个数之比为 。
1:5
5.一定条件下硝酸铵受热分解的化学方程式(未配平):NH4NO3 → HNO3+ N2 + H2O的反应中,被氧化与被还原的原子个数之比为 。
5:3
6.R2O4x- 离子在酸性溶液中与MnO4-反应,产物为RO2 、Mn2+ 、H2O,已知反应中氧化剂与还原剂的物质的量之比为2︰5,则x 的值 。
2
7.在一定条件下,NO跟NH3可以发生反应:
6NO+4NH3 = 5N2 + 6H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
氧化剂和还原剂
1、氧化还原反应的特征和本质是什么?
特征:元素化合价的变化
本质:电子的转移(得失或偏移)
2、在氧化还原反应中什么物质发生了氧化反应?什么物质发生了还原反应呢?这些物质有什么特征?具有什么性质?反应后得到什么物质?
氧化剂:得电子(或电子对偏向)的反应物,
或所含元素的化合价降低的反应物。
还原剂:失电子(或电子对偏离)的反应物,
或所含元素的化合价升高的反应物。
一、氧化剂和还原剂
1.概念:
氧化性:物质得到电子的性质。
还原性:物质失去电子的性质。
还原产物:在反应时所含元素的化合价降低的产物。
氧化产物:在反应时所含元素的化合价升高的产物。
e-
得电子(电子对偏向)的物质
失电子(电子对偏离)的物质
还原剂
氧化剂
有还原性,失电子,化合价升高,被氧化,发生氧化反应
有氧化性,得电子,化合价降低,被还原,发生还原反应
氧化剂
+ 还原剂
还原产物
+ 氧化产物
2.氧化还原反应基本概念之间的关系
口诀:失—升—氧化—还原剂,
得—降—还原—氧化剂
例:用双线桥标出下列反应电子转移的方向和数目,并指明氧化剂和还原剂、氧化产物和还原产物。
(2)Cl2 + 2NaOH NaCl + NaClO + H2O
(1) 2Al + Fe2O3 2Fe + Al2O3
高温
(3) MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑
Δ
失2×3e-,化合价升高,被氧化
得2×3e-,化合价降低,被还原
(1) 2Al + Fe2O3 2Fe + Al2O3
高温
0 +3 0 +3
氧化剂: Fe2O3
还原剂:Al
氧化产物: Al2O3
还原产物: Fe
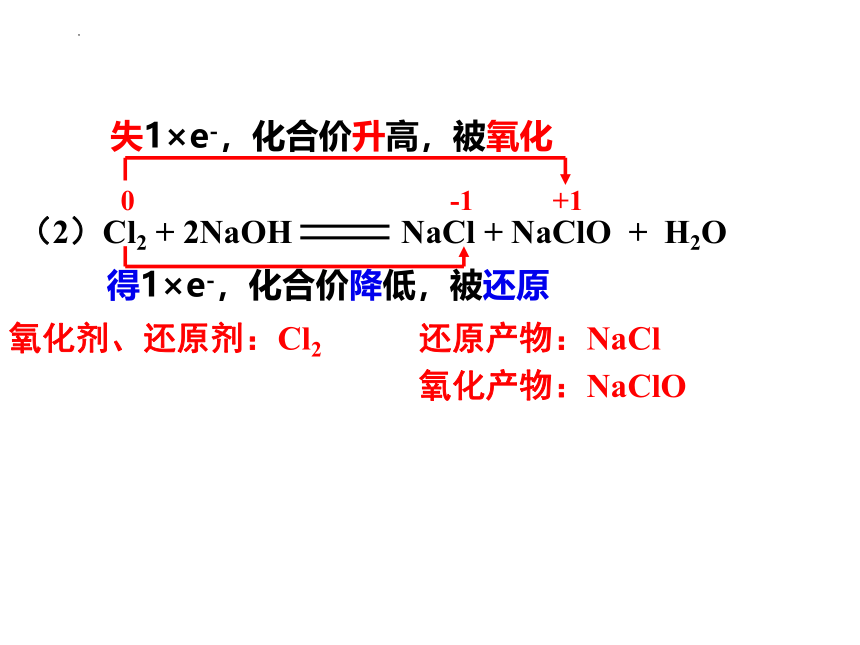
(2)Cl2 + 2NaOH NaCl + NaClO + H2O
失1×e-,化合价升高,被氧化
得1×e-,化合价降低,被还原
0 -1 +1
氧化剂、还原剂:Cl2
氧化产物:NaClO
还原产物:NaCl
得1×2e-,化合价降低,被还原
失2×e-,化合价升高,被还原
Δ
(3) MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑
+4 -1 +2 0
氧化剂:MnO2
还原剂:HCl
氧化产物:Cl2
还原产物:MnCl2
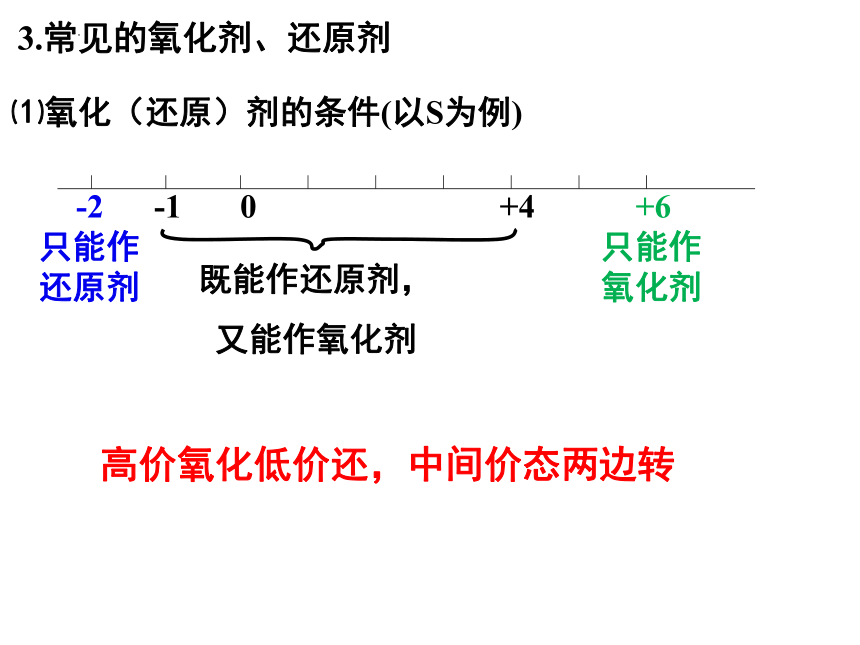
-2 -1 0 +4 +6
只能作还原剂
只能作氧化剂
既能作还原剂,
又能作氧化剂
⑴氧化(还原)剂的条件(以S为例)
3.常见的氧化剂、还原剂
高价氧化低价还,中间价态两边转
⑵常见的氧化剂:能得电子,具有氧化性(含较高价态元素的物质)。
①活泼非金属单质:O2 、 O3 、Cl2等
②高价氧化物:MnO2、CuO、Fe2O3等
③高价含氧酸、盐:浓H2SO4、HNO3、 MnO4-、Fe3+ 等
④不活泼金属的阳离子及酸:Ag+、Cu2+等
⑤过氧化物,如Na2O2、H2O2等。
⑶常见的还原剂:能失电子,具有还原性(含较低价态元素)的物质。
①活泼的金属单质。
②部分非金属单质,如H2、C、S、Si等。
③低价的氧化物,如CO、SO2等。
④低价酸、盐,如H2SO3 、HI、H2S、SO32-、I- 、S2- 、Fe2+等。
1.判断下列说法正确的是 。
A.金属在化学反应中只做还原剂
B.非金属在化学反应中只做氧化剂
C.被氧化的是氧化剂,被还原的是还原剂
D. 氧化剂失去电子的数目一定等于还原剂得到电子的数目
E.失电子的反应是氧化反应,失电子的物质是还原剂
AE
课堂练习
2.苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
B
3. 反应:NaH+H2O = NaOH+H2↑ 对这一反应的描述正确的是( )
A.NaH是氧化剂 B.NaH被还原
C.NaOH是还原产物
D.氧化产物与还原产物的质量比是1:1
D
4.已知反应①SO3 + H2O = H2SO4
②Cl2 + H2O = HCl + HClO
③2F2 + 2H2O = 4HF + O2
④2Na + 2H2O = 2NaOH + H2 ↑
⑤ SiO2 + 2NaOH = Na2SiO3 + H2O
其中不属于氧化还原反应的有 ,H2O做还原剂的是______,H2O做氧化剂的是______,属于氧化还原反应,但水既不做氧化剂又不做还原剂的是______ 。
① ⑤
③
④
②
作业本:课本27、28页课后习题。
氧化性还原性强弱比较
氧化性强弱:物质得电子越容易,其氧化性就越强。
还原性强弱:物质失电子越容易,其还原性就越强。
氧化性、还原性的强弱取决于物质得失电子的难易程度,与得失电子数目的多少无关。
二、氧化性还原性强弱比较
1.根据反应方程式来比较
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
“强” 制“弱”
例1:根据下列三个氧化还原反应:
(1)2 Fe3+ + 2 I- = 2Fe2+ + I2
(2)2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
试比较:
① Cl2 、Fe3+ 、I2三四种微粒的氧化性强弱
② Cl- 、Fe2+、I-三四种微粒的还原性强弱
Cl2 > Fe3+ > I2
I- > Fe2+ > Cl-
例2:已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,还原性的强弱顺序:Cl-< Fe2+ < H2O2 < I- < SO2。则下列反应不能发生的是( )
①2Fe3++ SO2 + 2H2O = 2Fe2++ SO42- + 4H+
②Cl2 + SO2+ 2H2O = H2SO4 + 2HCl
③H2O2+ 2H++ SO42- = SO2↑ + O2↑ + 2H2O
A.① B.② C.③ D.① ②
C
2 .根据金属活动性顺序进行判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Fe3+Hg2+ Ag+
得电子能力逐渐增强,氧化性逐渐增强
如:还原性:Mg>Zn>Cu
氧化性:Cu2+>Zn2+>Mg2+
越易失e-的物质,失去后就越难得e-;
越易得e-的物质,得到后就越难失e-。
3.根据与同种物质反应生成不同价态产物的情况判断。
氧化性:Cl2>S
4.根据反应条件判断
与同物质反应,产物相同时,条件越简单,氧化性或还原性越强。
从是否加热、温度高低、有无催化剂等方面判断。如:
氧化性:KMnO4>KClO3>MnO2
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
KClO3 + 6HCl (浓) KCl + 3Cl2↑ + 3H2O
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
△
5.某些物质的氧化性或还原性还与“三度”有关:
温度:温度升高,某些物质的氧化性或还原性增强。
浓度:同物质,一般浓度越大,其氧化性或还原性越强。
如氧化性:浓硫酸>稀硫酸,浓硝酸>稀硝酸
还原性:浓盐酸>稀盐酸
酸碱度:
如,碱性和中性环境中NO3-不显氧化性;
酸性环境中NO3-显强氧化性;
MnO4-的氧化性随溶液酸性的增强而增强。
练习:1、请用双线桥法表示出下列反应中电子转移情况并指出各反应的氧化剂、还原剂、氧化产物、还原产物。
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
2、用双(单)线桥表示下列氧化还原反应的电子转移,并指出氧化剂、还原剂、氧化产物和还原产物。
4P +3KOH+3H2O = 3KH2PO2+PH3
4P + 3KOH + 3H2O = 3KH2PO2 + PH3
得1×3e- ,化合价降低,被还原
0
-3
+1
失3×e- ,化合价升高,被氧化
3e-
氧化剂: P
还原剂:P
氧化产物: KH2PO2
还原产物: PH3
氧化还原反应的基本规律
例:下列粒子既有氧化性又有还原性的是( )
A.Cu2+ B.Cl- C.Al D.Fe2+
三、氧化还原反应的规律
1.价态规律:
⑴元素处于最高价,只有氧化性
如Fe3+、MnO4- 、浓H2SO4等。
⑵元素处于最低价,只有还原性
如金属单质、Cl-、Br -、I -、S 2-等。
⑶元素处于中间价态,既有氧化性又有还原性
如Fe2+ 、Cl2、H2O2等。
应用:判断物质有无氧化性、还原性。
D
2.先后规律:某氧化剂(或还原剂)同时与几种还原剂(或氧化剂)相遇时,还原性(氧化性)最强的先反应。
强者先行
应用:判断反应的先后顺序或是否能够发生。
例:在含有Al2(NO3)3、 Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,最先置换出的是( )
A.Al B.Cu C.Ag D. Mg
C
3.守恒规律:电子得失总数相等或化合价升降数相等。
应用:有关氧化还原反应的计算及其方程式的配平。
例:一定条件下,PbO2与Cr3+反应,产物是Cr2O72 -和Pb2+,则与1个 Cr3+反应需要 个PbO2
1.5
3.守恒规律:电子得失总数相等或化合价升降数相等。
4.转化规律:
①同种元素不同价态之间邻价转化最容易。
②同种元素相邻价态之间不发生氧化还原反应。
如浓H2SO4与SO2不能反应。
结论:a.强氧化剂与强还原剂不一定能反应;
b.SO2气体可用浓H2SO4干燥。
H2SO4 (浓) + H2S = SO2 + S ↓ + 2H2O
失1×2e-,化合价升高,被氧化
得1×2e-,化合价降低,被还原
+6 -2 +4 0
应用:有关氧化还原反应的计算及反应能否进行。
例:2KClO3 + 4HCl = 2KCl + 2ClO2 ↑ + Cl2↑ + 2H2O
(1)请标出上述氧化还原反应的电子转移方向和总数。
(2)其氧化剂是 ,还原剂 ,氧化产物和还原产物的物质的量比为 。
(3)当生成1molCl2时,有 mol的HCl被氧化。
(4)当生成a个ClO2分子时,电子转移数为 个。
2e-
KClO3
HCl
2
1:2
a
注:在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。
四、离子共存问题
① Fe3+与S2-、I-等不能大量共存。
② NO3- + H+组合(强氧化性) 、MnO4-、ClO-均与Fe2+、SO32-、S2-、I-等不能大量共存。
例1:在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Fe2+、K+、Cl-、NO3-
B.Ag+、Na+、NO3-、MnO4-
C.Mg2+、Al3+、SO42-、Cl-
D.Ca2+、NH4+、Cl-、HCO3-
C
因发生氧化还原反应而不能大量共存的离子:
例2:下列离子在对应的溶液中能大量共存的是( )
A.pH=0的溶液中:Na+、CO32- 、ClO-、I-
B.在能使酚酞试液变红的溶液中:
Ca2+、Ba2+、NO3- 、HCO3-
C.在含有Cl-、Ba2+的溶液中:
Na+、K+、HCO3-、NO3-
D.在无色透明溶液中:
Ba2+、Cu2+、Mg2+、NO3-、SO32-
C
1.下列三个氧化还原反应:
(1)2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
(2)2FeCl2 + Cl2 = 2FeCl3
(3)2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
若某溶液中有Fe2+、I- 、 Cl-共存,要除去I-而不影响Fe2+和Cl-,则可加入的试剂是( )。
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
C
课堂练习
2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4FeI3
B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O
D.2Fe3+ + 2I- = 2Fe2+ + I2
A
3.有下列三个反应:
①Cl2 + FeI2= FeCl2 + I2
②2Fe2++ Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑ + 3H2O,
下列说法中正确的是( )
A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+
C.在反应③中生成1 个Cl2时,有2个 HCl被氧化
D.可以发生:Cl2 + FeBr2 = FeCl2+Br2
C
4.在6HCl + KClO3 = KCl + 3Cl2 + 3H2O的反应中,得到和失去电子的原子个数之比为 。
1:5
5.一定条件下硝酸铵受热分解的化学方程式(未配平):NH4NO3 → HNO3+ N2 + H2O的反应中,被氧化与被还原的原子个数之比为 。
5:3
6.R2O4x- 离子在酸性溶液中与MnO4-反应,产物为RO2 、Mn2+ 、H2O,已知反应中氧化剂与还原剂的物质的量之比为2︰5,则x 的值 。
2
7.在一定条件下,NO跟NH3可以发生反应:
6NO+4NH3 = 5N2 + 6H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
