2.2.1化学平衡课件(共21张PPT)
文档属性
| 名称 | 2.2.1化学平衡课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 400.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-21 17:10:09 | ||
图片预览








文档简介
(共21张PPT)
第二节 化学平衡
年 级:高二 学 科:化学(统编版)
v(正)
v(正)=v(逆)
时间
速率
v(逆)
0
N2(g)+3H2(g) 2NH3(g)
时间
浓度
0
NH3
H2
N2
如果充入 NH3发生反应呢?
在一定条件下,容积不变的密闭容器中,充入N2和H2发生反应,反应中各物质的浓度随时间如何变化?正逆反应速率随时间如何变化?请分别作出相应的浓度-时间图和速率-时间图。
化学平衡状态的建立
一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
一、化学平衡状态
1.定义:
v(逆)
v(正)=v(逆)
时间
速率
v(正)
0
时间
浓度
0
N2
H2
标志
本质
平衡状态是在一定条件下,可逆反应所能进行的最大程度,即可逆反应的限度。
NH3
N2(g)+3H2(g) 2NH3(g)
达到化学平衡时,反应达到该条件下物质化的最大“限度”,即反应物的转化率最大。
转化率=
反应物的减少量
×100%
反应物的起始量
一定温度下,在密闭容器中充入2molN2和6molH2 ,达平衡时生成0.8molNH3,计算的N2平衡转化率?
N2(g)+3H2(g) 2NH3(g)
始
变
平
2 6 0
0.8 2.4 1.6
1.2 3.6 1.6
N2转化率=
0.8mol
2mol
×100%
=40%
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量________
动
v正 ____ v逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
2.化学平衡状态的特征:
“标志”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
【例1 】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______ ① 单位时间内消耗1 mol N2 ,同时生成1 mol N2 ;② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3 ;③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2;④ 断裂3 mol H-H键 ,同时生成6 mol N-H键。
(1)同种物质—— v正(A) = v逆(A)
化学平衡状态的判定
1.
“等”
(2)不同物质—— v正(A) : v逆(B) = a : b(化学计量数之比)
①③
正逆相等
【思维模型】
v正= v逆
①方向
②数值
相反
同一物质
不同物质
相同
化学计量比
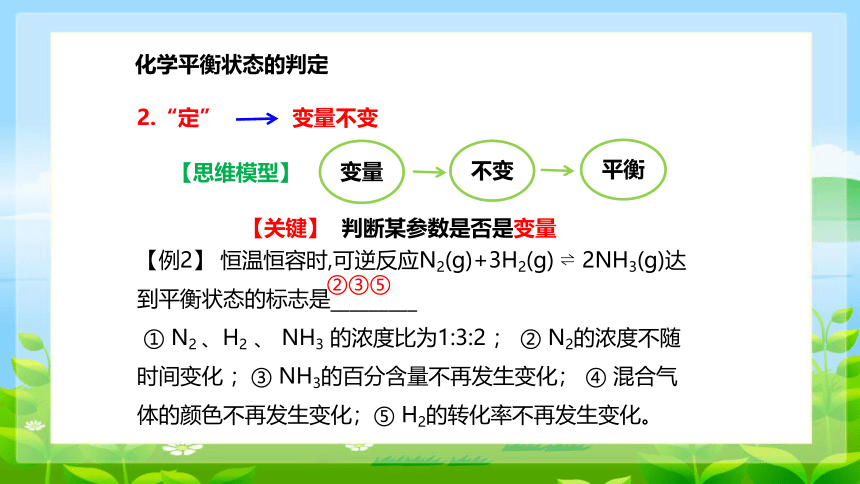
2.“定”
变量不变
【思维模型】
变量
不变
平衡
【关键】 判断某参数是否是变量
【例2】 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2 ; ② N2的浓度不随时间变化 ;③ NH3的百分含量不再发生变化; ④ 混合气体的颜色不再发生变化;⑤ H2的转化率不再发生变化。
②③⑤
化学平衡状态的判定
化学平衡状态的判断有规律可循吗?不同的化学平衡状态,反应物和生成物的浓度之间有什么关系呢?
探寻规律
序 号 起始时的浓度 (×10-2mol·L-1) 平衡时的浓度 (×10-2mol·L-1) 平衡时c(CO2) · c(H2)
c(CO) ·c(H20)
c(CO) c(H20) c(CO2) c(H2) c(CO) c(H20) c(CO2) c(H2) 1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1
1
1
800℃,在容积不变的密闭容器中发生反应:
CO(g) +H20(g) C02(g) + H2(g)
表1 800℃时反应体系中各物质的浓度
序 号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(HI)
c(H2).c(l2)
c(H2) c(l2) c(HI) c(H2) c(l2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
比较两个反应,结果的不同可能跟什么因素有关?
考虑化学计量数?
H2(g)+l2(g) 2HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
c(CO2) · c(H2)
c(CO) ·c(H2O)
c(HI)
c(H2).c(l2)
是定值
不是定值
H2(g)+l2(g) 2HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
2c(HI)
c(H2).c(l2)
是定值吗?
探寻规律
序 号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
2c(HI)
c(H2).c(l2)
c(H2) c(l2) c(HI) c(H2) c(l2) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
7613
5764
6669
8211
9740
3306
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
c2(HI)
c(H2).c(l2)
H2(g)+l2(g) HI(g) + HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
c(CO2) · c(H2)
c(CO) ·c(H2O)
c(HI).c(HI)
c(H2).c(l2)
再次比较两个反应,如果将反应的书写形式改变,会出现什么结果呢?
H2(g)+l2(g) 2HI(g)
是定值吗 即 是定值吗?
是定值
序 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol-L-1) 平衡时
c2(HI)
c(H2).c(l2)
号 c(H2) c(l2) c(HI) c(H2) c(l2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
48.38
48.61
49.54
48.48
48.71
48.81
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
探寻规律
在一定温度下,以化学计量数为指数,生成物平衡时浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)。
该结论适用于其他可逆反应吗?
序号 平衡时的浓度/( mol·L-1) 平衡时
c2(NH3)
c3(H2)c(N2)
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
表3 在500℃时,3H2(g)+N2(g) 2NH3(g)反应体系中各物质的浓度
5.98×10-2
5.71×10-2
6.00×10-2
6.08×10-2
5.93×10-2
探寻规律
科学家们通过大量数据验证,证明了上述结论成立,计算得出的定值称为化学平衡常数,用 K 来表示。
对于一般的可逆反应
写一写
在一定温度下达到化学平衡时,各物质的浓度满足的数学关系式为:
aA + bB cC + dD
K是平衡常数,c为各组分的平衡浓度。
二、化学平衡常数
在一定温度下,当一个可逆反应反应达到平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,用K表示。
【随堂练习2】830K时,密闭容器中发生反应
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,4s达平衡时
CO的转化率为60%,该温度下,该反应平衡常数K=_______
(2)在相同温度下,若起始时c(CO)=1mol·L-1,
c(H2O)=2mol·L-1,反应进行一段时间后,测得H2浓度为
0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”
或“否”)
生活中存在很多平衡,如草原的生态平衡,人体内的酸碱平衡等。
第二节 化学平衡
年 级:高二 学 科:化学(统编版)
v(正)
v(正)=v(逆)
时间
速率
v(逆)
0
N2(g)+3H2(g) 2NH3(g)
时间
浓度
0
NH3
H2
N2
如果充入 NH3发生反应呢?
在一定条件下,容积不变的密闭容器中,充入N2和H2发生反应,反应中各物质的浓度随时间如何变化?正逆反应速率随时间如何变化?请分别作出相应的浓度-时间图和速率-时间图。
化学平衡状态的建立
一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
一、化学平衡状态
1.定义:
v(逆)
v(正)=v(逆)
时间
速率
v(正)
0
时间
浓度
0
N2
H2
标志
本质
平衡状态是在一定条件下,可逆反应所能进行的最大程度,即可逆反应的限度。
NH3
N2(g)+3H2(g) 2NH3(g)
达到化学平衡时,反应达到该条件下物质化的最大“限度”,即反应物的转化率最大。
转化率=
反应物的减少量
×100%
反应物的起始量
一定温度下,在密闭容器中充入2molN2和6molH2 ,达平衡时生成0.8molNH3,计算的N2平衡转化率?
N2(g)+3H2(g) 2NH3(g)
始
变
平
2 6 0
0.8 2.4 1.6
1.2 3.6 1.6
N2转化率=
0.8mol
2mol
×100%
=40%
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量________
动
v正 ____ v逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
2.化学平衡状态的特征:
“标志”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
【例1 】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______ ① 单位时间内消耗1 mol N2 ,同时生成1 mol N2 ;② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3 ;③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2;④ 断裂3 mol H-H键 ,同时生成6 mol N-H键。
(1)同种物质—— v正(A) = v逆(A)
化学平衡状态的判定
1.
“等”
(2)不同物质—— v正(A) : v逆(B) = a : b(化学计量数之比)
①③
正逆相等
【思维模型】
v正= v逆
①方向
②数值
相反
同一物质
不同物质
相同
化学计量比
2.“定”
变量不变
【思维模型】
变量
不变
平衡
【关键】 判断某参数是否是变量
【例2】 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2 ; ② N2的浓度不随时间变化 ;③ NH3的百分含量不再发生变化; ④ 混合气体的颜色不再发生变化;⑤ H2的转化率不再发生变化。
②③⑤
化学平衡状态的判定
化学平衡状态的判断有规律可循吗?不同的化学平衡状态,反应物和生成物的浓度之间有什么关系呢?
探寻规律
序 号 起始时的浓度 (×10-2mol·L-1) 平衡时的浓度 (×10-2mol·L-1) 平衡时c(CO2) · c(H2)
c(CO) ·c(H20)
c(CO) c(H20) c(CO2) c(H2) c(CO) c(H20) c(CO2) c(H2) 1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1
1
1
800℃,在容积不变的密闭容器中发生反应:
CO(g) +H20(g) C02(g) + H2(g)
表1 800℃时反应体系中各物质的浓度
序 号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(HI)
c(H2).c(l2)
c(H2) c(l2) c(HI) c(H2) c(l2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
比较两个反应,结果的不同可能跟什么因素有关?
考虑化学计量数?
H2(g)+l2(g) 2HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
c(CO2) · c(H2)
c(CO) ·c(H2O)
c(HI)
c(H2).c(l2)
是定值
不是定值
H2(g)+l2(g) 2HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
2c(HI)
c(H2).c(l2)
是定值吗?
探寻规律
序 号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
2c(HI)
c(H2).c(l2)
c(H2) c(l2) c(HI) c(H2) c(l2) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
7613
5764
6669
8211
9740
3306
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
c2(HI)
c(H2).c(l2)
H2(g)+l2(g) HI(g) + HI(g)
CO(g) +H2O(g) CO2(g) + H2(g)
c(CO2) · c(H2)
c(CO) ·c(H2O)
c(HI).c(HI)
c(H2).c(l2)
再次比较两个反应,如果将反应的书写形式改变,会出现什么结果呢?
H2(g)+l2(g) 2HI(g)
是定值吗 即 是定值吗?
是定值
序 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol-L-1) 平衡时
c2(HI)
c(H2).c(l2)
号 c(H2) c(l2) c(HI) c(H2) c(l2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.58 0.973 14.86
4 0 0 15.2 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10
6 0 0 37.77 4.213 4.213 29.34
48.38
48.61
49.54
48.48
48.71
48.81
表2 457.6℃时反应体系H2(g)+l2(g) 2HI(g)中各物质的浓度
探寻规律
在一定温度下,以化学计量数为指数,生成物平衡时浓度幂之积与反应物平衡时浓度幂之积的比值是一个定值(扣除实验误差)。
该结论适用于其他可逆反应吗?
序号 平衡时的浓度/( mol·L-1) 平衡时
c2(NH3)
c3(H2)c(N2)
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.087
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
表3 在500℃时,3H2(g)+N2(g) 2NH3(g)反应体系中各物质的浓度
5.98×10-2
5.71×10-2
6.00×10-2
6.08×10-2
5.93×10-2
探寻规律
科学家们通过大量数据验证,证明了上述结论成立,计算得出的定值称为化学平衡常数,用 K 来表示。
对于一般的可逆反应
写一写
在一定温度下达到化学平衡时,各物质的浓度满足的数学关系式为:
aA + bB cC + dD
K是平衡常数,c为各组分的平衡浓度。
二、化学平衡常数
在一定温度下,当一个可逆反应反应达到平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,用K表示。
【随堂练习2】830K时,密闭容器中发生反应
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,4s达平衡时
CO的转化率为60%,该温度下,该反应平衡常数K=_______
(2)在相同温度下,若起始时c(CO)=1mol·L-1,
c(H2O)=2mol·L-1,反应进行一段时间后,测得H2浓度为
0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”
或“否”)
生活中存在很多平衡,如草原的生态平衡,人体内的酸碱平衡等。
