【任务驱动式】4.1.2 化学电源 课件(共25张PPT)高中化学人教版2019选择性必修1
文档属性
| 名称 | 【任务驱动式】4.1.2 化学电源 课件(共25张PPT)高中化学人教版2019选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-25 12:34:16 | ||
图片预览







文档简介
(共25张PPT)
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
学习目标
1.通过对常见化学电源的分析,建立对原电池过程系统认识的思维模型,提高对原电池本质的认识。
2.增强科技意识,不断研发新型电池,满足人类社会发展的需求。积极回收利用废旧电池,减少其对环境的污染。
情境引入
一次电池
二次电池
燃料电池
燃料电池
干电池
铅酸电池
锂电池
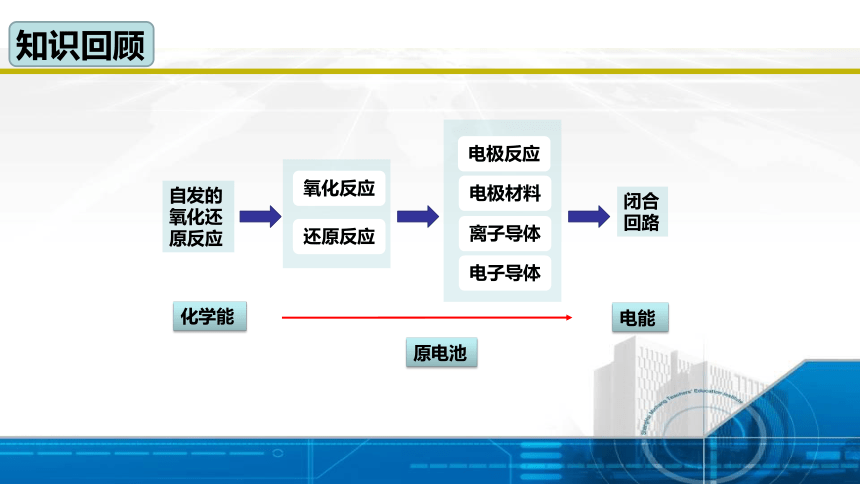
知识回顾
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
任务一
一次电池(放电后不可充电的电池)
1.普通锌锰干电池
【资料卡片】普通锌锰干电池是最早进入市场的实用干电池。因其电解质溶液用淀粉糊固定化,称为干电池。
普通锌锰干电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2 Zn(NH3)2Cl2+2MnO(OH)
请同学们结合资料和示意图分析:电极反应中的还原剂和氧化剂、电极材料、离子导体。
还原剂:
氧化剂:
负极:
正极:
离子导体:
锌筒
Zn
MnO2
石墨棒
NH4Cl和ZnCl2混合物
一次电池
任务一
思考1
分析普通锌锰干电池长期占据市场和现在逐渐被替代的可能原因。
干电池漏液
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
原因1:会发生自放电
原因2:电解质氯化氨为酸性,会腐蚀电池的锌筒且反应有氢气生成,易造成电池膨胀及漏液现象
一次电池
任务一
2.碱性锌锰干电池
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
【资料卡片】已知该电池总反应为:
Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2
根据示意图和资料:
分析各部分的作用并写出电极反应式。
电极反应 还原剂:Zn粉
氧化剂 :MnO2
电极材料 负极:铜针
正极:金属外壳
离子导体 KOH、离子型导电隔膜
负极:
Zn - 2e- + 2OH- Zn(OH)2
正极:
2MnO2 + 2e- + 2H2O 2MnO(OH) + 2OH-
一次电池
任务一
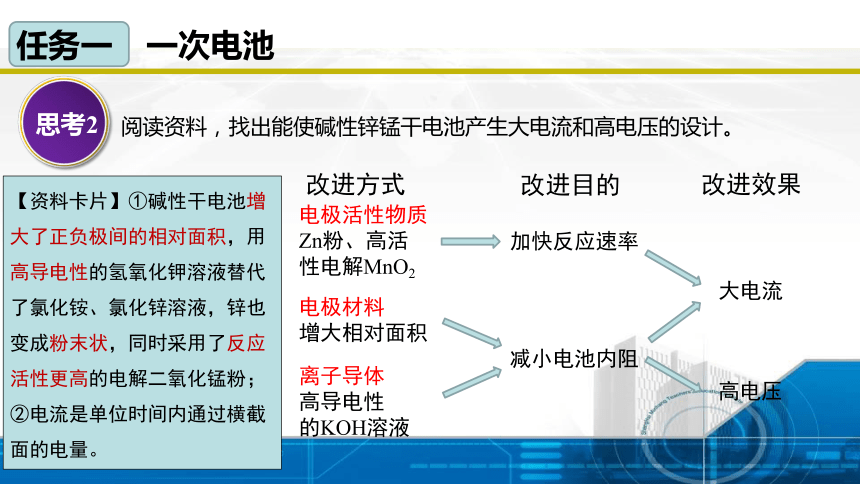
思考2
阅读资料,找出能使碱性锌锰干电池产生大电流和高电压的设计。
【资料卡片】①碱性干电池增大了正负极间的相对面积,用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,锌也变成粉末状,同时采用了反应活性更高的电解二氧化锰粉;
②电流是单位时间内通过横截面的电量。
电极活性物质
Zn粉、高活性电解MnO2
电极材料
增大相对面积
离子导体
高导电性
的KOH溶液
加快反应速率
减小电池内阻
大电流
高电压
改进方式
改进目的
改进效果
二次电池
任务二
二次电池又称可充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
1.铅酸蓄电池
根据铅蓄电池放电过程的总反应写出电极反应式。
【资料卡片】铅蓄电池放电时的总反应为:
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
PbSO4难溶于水,充电过程与上述过程相反。
负极:Pb + SO42-- 2e- PbSO4
正极:PbO2 + 4H+ + SO42- + 2e- PbSO4 + 2H2O
优点:电压稳定使用方便安全可靠价格低廉
缺点:比能量低、笨重
二次电池
任务二
思考3
铅蓄电池的电极反应物(Pb、PbO2)和放电后的产物(PbSO4)均以固体形式附着在电极材料表面,分析这样设计的目的。
目的:使电极反应物和产物富集在电极材料表面,充、放电时可以循环转化,实现电池重复使用。
Pb
PbSO4
放电
充电
负极
PbO2
PbSO4
放电
充电
正极
知识拓展
各种新能源汽车电池
电池类型 镍镉电池 镍氢电池 锂离子电池
比能量/ (W·h·kg-1) 55 60~70 120
循环寿命/次 500以上 1000以上 1000以上
优点 比能量较高、寿命长、耐过充放性好 比能量高、寿命长 比能量高、
寿命长
缺点 镉有毒、有记忆效应、价格较高 价格高、高温充电性差 价高、存在一定安全性问题
比能量(比功率):电池单位质量或单位体积所能输出
电能的多少(或功率的大小)
二次电池
任务二
2.锂离子电池
2019诺贝尔化学奖得主
斯坦利·惠廷厄姆在1976年提出了第一个嵌入脱出型的正极材料TiS2,这几乎标志着从早期的Li—MnO2一次电池到现代二次锂电池的转变。
TiS2
Li+
【资料卡片】TiS2是一种微观上具有层状结构的固体材料。充、放电时,Ti元素的化合价发生变化,层状结构所带电荷量发生改变,锂离子会因此从其中脱出或嵌入。
二次电池
任务二
2.锂离子电池
结合资料、总反应与示意图,分析:
1.放电时Li+迁移方向和电极反应;
2.简单说明其能够反复充电的理由。
Li
固体TiS2
隔膜
含Li+的
电解质溶液
:Li+
:e-
放电总反应:
x Li + TiS2 LixTiS2
放电时Li+移向正极
负极:x Li – x e- x Li+
正极:TiS2 + x Li+ + x e- LixTiS2
约翰·古迪纳夫发现了LiCoO2等一系列正极材料,减少了枝晶短路的可能,进而大幅提升锂电池的稳定性 。
2019年诺贝尔化学奖得主
二次电池
任务二
2.锂离子电池
钴酸锂LiCoO2
2019诺贝尔化学奖得主
吉野彰将碳基材料用作负极,依旧用钴酸锂做正极,并采用聚乙烯或聚丙烯为隔膜,LiClO4的碳酸丙烯酯液为电解质溶液。确立了现代锂离子电池的基本框架。
二次电池
任务二
2.锂离子电池
负极材料
正极材料
放电时的总反应:
LixCy + Li1-xCoO2 LiCoO2 + Cy
负极:LixCy-xe-===xLi++Cy
正极:Li1-xCoO2+xLi++xe-===LiCoO2
燃料电池
任务三
1.燃料电池
燃料电池是一种连续地将_____和_______的化学能直接转化为_____的化学电源。燃料电池的电极本身不包含_________,只是一个催化转化元件。
燃料
氧化剂
电能
活性物质
燃料电池的特点
① 燃料和氧化剂连续的由外部供给,生成物不断地被排出,可以连续不断地提供电能。
② 电池内部的电极材料和离子导体在工作过程中不发生改变,使燃料电池可以持续工作。
燃料电池
任务三
2.氢氧燃料电池
(1)基本构造
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
H2 + O2 = H2O
1
2
(2)工作原理
总反应:
燃料电池
任务三
(3)能量转换
所有的燃烧均为放热反应,若能量以电的形式向外释放,则形成燃料电池,所以燃料电池的总方程式类似燃烧的总方程式,条件不同。
理论上来说,所有的燃烧反应均可设计成燃料电池,所以燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等液体或气体,且能量转化率超高。其电能的转化率超过80%,远高于转化率仅30% 多的火力发电,大大提高了能源的利用率。
燃料电池
任务三
3.燃料电池电极反应式的书写方法
负极为燃料失电子发生氧化反应。
正极为O2得电子发生还原反应。
例:CH3OH燃料电池电极反应式的书写:
(1)酸性电解质:
负极:CH3OH-6e-+H2O===CO2+6H+
配平小技巧:根据环境用H+调电荷守恒
燃料电池
任务三
配平小技巧:根据环境用OH-调电荷守恒
配平小技巧:根据环境用CO32-调电荷守恒
燃料电池
任务三
固体氧化物燃料电池采用固体氧化物为电解质(ZrO2/Y2O3)。固体氧化物在高温下具有传递O2-的能力,在电池中起传递O2-和分离燃料和氧化剂的作用。
配平小技巧:根据环境用O2-调电荷守恒
总结提升
化学电源电极反应式的书写
(1)根据电源总反应式或装置确定正、负极的反应物;原电池的正极大多数只起导电作用,而化学电源的正极材料得电子参与电极反应。
(2)根据电源总反应式的产物或装置中微粒的种类确定稳定的产物,要特别注意溶液的酸碱性和离子共存问题。
(3)利用氧化还原配平方法配平电极反应式,运用原子守恒和电荷守恒进行检查。
巩固练习
1.镍 镉电池是一种可充电的“干电池”,使用寿命长达10~15年。其总反应为Cd+2NiO(OH)+2H2O ===2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )A.放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2B.充电时,正极反应为Ni(OH)2-e-+OH-===NiO(OH)+H2OC.电池工作时,负极区pH增大,正极区pH减小D.该电池充电时将电能转化为化学能
C
放电
充电
巩固练习
2.甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图所示。下列有关叙述正确的是( )
A.该装置能将电能转化为化学能
B.电流由乙电极经导线流向甲电极
C.负极的电极反应式为:CH3OH+6OH--6e-===CO2+5H2O
D.b口通入空气,c口通入甲醇
B
电池类型 原理 工艺及目的
一次电池 原电池原理 加入隔膜分隔氧化剂与还原剂,减少电池自损耗。
二次电池 原电池及 电解池原理 将相关活性物质富集在电极材料表面,实现物质循环转化。
燃料电池 原电池原理 燃料和氧化剂连续由外部提供,保持电极材料和离子导体稳定,能够实现连续工作。
总结提升
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
学习目标
1.通过对常见化学电源的分析,建立对原电池过程系统认识的思维模型,提高对原电池本质的认识。
2.增强科技意识,不断研发新型电池,满足人类社会发展的需求。积极回收利用废旧电池,减少其对环境的污染。
情境引入
一次电池
二次电池
燃料电池
燃料电池
干电池
铅酸电池
锂电池
知识回顾
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
任务一
一次电池(放电后不可充电的电池)
1.普通锌锰干电池
【资料卡片】普通锌锰干电池是最早进入市场的实用干电池。因其电解质溶液用淀粉糊固定化,称为干电池。
普通锌锰干电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2 Zn(NH3)2Cl2+2MnO(OH)
请同学们结合资料和示意图分析:电极反应中的还原剂和氧化剂、电极材料、离子导体。
还原剂:
氧化剂:
负极:
正极:
离子导体:
锌筒
Zn
MnO2
石墨棒
NH4Cl和ZnCl2混合物
一次电池
任务一
思考1
分析普通锌锰干电池长期占据市场和现在逐渐被替代的可能原因。
干电池漏液
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
原因1:会发生自放电
原因2:电解质氯化氨为酸性,会腐蚀电池的锌筒且反应有氢气生成,易造成电池膨胀及漏液现象
一次电池
任务一
2.碱性锌锰干电池
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
【资料卡片】已知该电池总反应为:
Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2
根据示意图和资料:
分析各部分的作用并写出电极反应式。
电极反应 还原剂:Zn粉
氧化剂 :MnO2
电极材料 负极:铜针
正极:金属外壳
离子导体 KOH、离子型导电隔膜
负极:
Zn - 2e- + 2OH- Zn(OH)2
正极:
2MnO2 + 2e- + 2H2O 2MnO(OH) + 2OH-
一次电池
任务一
思考2
阅读资料,找出能使碱性锌锰干电池产生大电流和高电压的设计。
【资料卡片】①碱性干电池增大了正负极间的相对面积,用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,锌也变成粉末状,同时采用了反应活性更高的电解二氧化锰粉;
②电流是单位时间内通过横截面的电量。
电极活性物质
Zn粉、高活性电解MnO2
电极材料
增大相对面积
离子导体
高导电性
的KOH溶液
加快反应速率
减小电池内阻
大电流
高电压
改进方式
改进目的
改进效果
二次电池
任务二
二次电池又称可充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
1.铅酸蓄电池
根据铅蓄电池放电过程的总反应写出电极反应式。
【资料卡片】铅蓄电池放电时的总反应为:
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
PbSO4难溶于水,充电过程与上述过程相反。
负极:Pb + SO42-- 2e- PbSO4
正极:PbO2 + 4H+ + SO42- + 2e- PbSO4 + 2H2O
优点:电压稳定使用方便安全可靠价格低廉
缺点:比能量低、笨重
二次电池
任务二
思考3
铅蓄电池的电极反应物(Pb、PbO2)和放电后的产物(PbSO4)均以固体形式附着在电极材料表面,分析这样设计的目的。
目的:使电极反应物和产物富集在电极材料表面,充、放电时可以循环转化,实现电池重复使用。
Pb
PbSO4
放电
充电
负极
PbO2
PbSO4
放电
充电
正极
知识拓展
各种新能源汽车电池
电池类型 镍镉电池 镍氢电池 锂离子电池
比能量/ (W·h·kg-1) 55 60~70 120
循环寿命/次 500以上 1000以上 1000以上
优点 比能量较高、寿命长、耐过充放性好 比能量高、寿命长 比能量高、
寿命长
缺点 镉有毒、有记忆效应、价格较高 价格高、高温充电性差 价高、存在一定安全性问题
比能量(比功率):电池单位质量或单位体积所能输出
电能的多少(或功率的大小)
二次电池
任务二
2.锂离子电池
2019诺贝尔化学奖得主
斯坦利·惠廷厄姆在1976年提出了第一个嵌入脱出型的正极材料TiS2,这几乎标志着从早期的Li—MnO2一次电池到现代二次锂电池的转变。
TiS2
Li+
【资料卡片】TiS2是一种微观上具有层状结构的固体材料。充、放电时,Ti元素的化合价发生变化,层状结构所带电荷量发生改变,锂离子会因此从其中脱出或嵌入。
二次电池
任务二
2.锂离子电池
结合资料、总反应与示意图,分析:
1.放电时Li+迁移方向和电极反应;
2.简单说明其能够反复充电的理由。
Li
固体TiS2
隔膜
含Li+的
电解质溶液
:Li+
:e-
放电总反应:
x Li + TiS2 LixTiS2
放电时Li+移向正极
负极:x Li – x e- x Li+
正极:TiS2 + x Li+ + x e- LixTiS2
约翰·古迪纳夫发现了LiCoO2等一系列正极材料,减少了枝晶短路的可能,进而大幅提升锂电池的稳定性 。
2019年诺贝尔化学奖得主
二次电池
任务二
2.锂离子电池
钴酸锂LiCoO2
2019诺贝尔化学奖得主
吉野彰将碳基材料用作负极,依旧用钴酸锂做正极,并采用聚乙烯或聚丙烯为隔膜,LiClO4的碳酸丙烯酯液为电解质溶液。确立了现代锂离子电池的基本框架。
二次电池
任务二
2.锂离子电池
负极材料
正极材料
放电时的总反应:
LixCy + Li1-xCoO2 LiCoO2 + Cy
负极:LixCy-xe-===xLi++Cy
正极:Li1-xCoO2+xLi++xe-===LiCoO2
燃料电池
任务三
1.燃料电池
燃料电池是一种连续地将_____和_______的化学能直接转化为_____的化学电源。燃料电池的电极本身不包含_________,只是一个催化转化元件。
燃料
氧化剂
电能
活性物质
燃料电池的特点
① 燃料和氧化剂连续的由外部供给,生成物不断地被排出,可以连续不断地提供电能。
② 电池内部的电极材料和离子导体在工作过程中不发生改变,使燃料电池可以持续工作。
燃料电池
任务三
2.氢氧燃料电池
(1)基本构造
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
H2 + O2 = H2O
1
2
(2)工作原理
总反应:
燃料电池
任务三
(3)能量转换
所有的燃烧均为放热反应,若能量以电的形式向外释放,则形成燃料电池,所以燃料电池的总方程式类似燃烧的总方程式,条件不同。
理论上来说,所有的燃烧反应均可设计成燃料电池,所以燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等液体或气体,且能量转化率超高。其电能的转化率超过80%,远高于转化率仅30% 多的火力发电,大大提高了能源的利用率。
燃料电池
任务三
3.燃料电池电极反应式的书写方法
负极为燃料失电子发生氧化反应。
正极为O2得电子发生还原反应。
例:CH3OH燃料电池电极反应式的书写:
(1)酸性电解质:
负极:CH3OH-6e-+H2O===CO2+6H+
配平小技巧:根据环境用H+调电荷守恒
燃料电池
任务三
配平小技巧:根据环境用OH-调电荷守恒
配平小技巧:根据环境用CO32-调电荷守恒
燃料电池
任务三
固体氧化物燃料电池采用固体氧化物为电解质(ZrO2/Y2O3)。固体氧化物在高温下具有传递O2-的能力,在电池中起传递O2-和分离燃料和氧化剂的作用。
配平小技巧:根据环境用O2-调电荷守恒
总结提升
化学电源电极反应式的书写
(1)根据电源总反应式或装置确定正、负极的反应物;原电池的正极大多数只起导电作用,而化学电源的正极材料得电子参与电极反应。
(2)根据电源总反应式的产物或装置中微粒的种类确定稳定的产物,要特别注意溶液的酸碱性和离子共存问题。
(3)利用氧化还原配平方法配平电极反应式,运用原子守恒和电荷守恒进行检查。
巩固练习
1.镍 镉电池是一种可充电的“干电池”,使用寿命长达10~15年。其总反应为Cd+2NiO(OH)+2H2O ===2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )A.放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2B.充电时,正极反应为Ni(OH)2-e-+OH-===NiO(OH)+H2OC.电池工作时,负极区pH增大,正极区pH减小D.该电池充电时将电能转化为化学能
C
放电
充电
巩固练习
2.甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图所示。下列有关叙述正确的是( )
A.该装置能将电能转化为化学能
B.电流由乙电极经导线流向甲电极
C.负极的电极反应式为:CH3OH+6OH--6e-===CO2+5H2O
D.b口通入空气,c口通入甲醇
B
电池类型 原理 工艺及目的
一次电池 原电池原理 加入隔膜分隔氧化剂与还原剂,减少电池自损耗。
二次电池 原电池及 电解池原理 将相关活性物质富集在电极材料表面,实现物质循环转化。
燃料电池 原电池原理 燃料和氧化剂连续由外部提供,保持电极材料和离子导体稳定,能够实现连续工作。
总结提升
