【任务驱动式】4.2.1 电解原理(课件)(共22张PPT)-高二化学(人教版2019选择性必修1)
文档属性
| 名称 | 【任务驱动式】4.2.1 电解原理(课件)(共22张PPT)-高二化学(人教版2019选择性必修1) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-25 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
第四单元 化学反应与电能
第二节 电解原理及其应用
第1课时 电解原理
学习目标
1.以电解氯化铜为例,分析理解电解池的工作原理。
2.会判断离子的放电顺序,会书写其电极反应式。
3.认识电解在实现物质转化和储存能量中的具体应用,可以应用电解的知识分析解决新型电解池。
铜
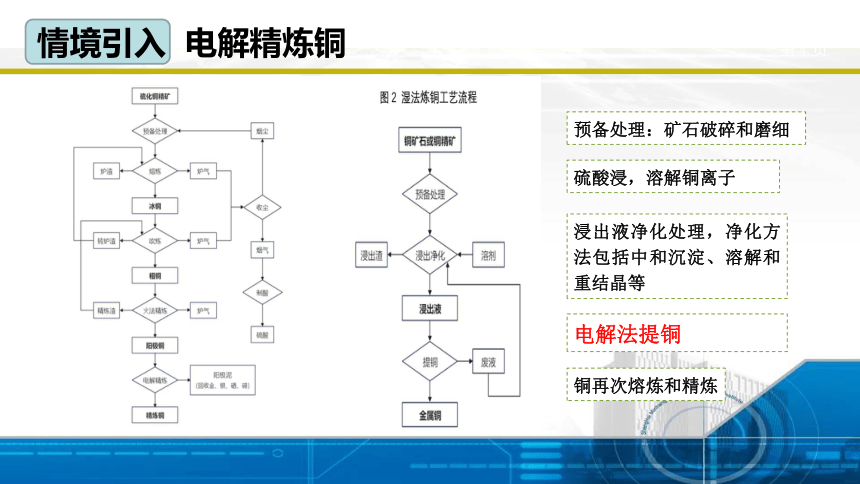
生活中铜制品纯度很高。高纯度的铜是通过火法冶炼和湿法冶炼制备的。那么,大致流程是什么呢?
情境引入 高纯铜的制备
预备处理:矿石破碎和磨细
电解法提铜
硫酸浸,溶解铜离子
浸出液净化处理,净化方法包括中和沉淀、溶解和重结晶等
铜再次熔炼和精炼
情境引入 电解精炼铜
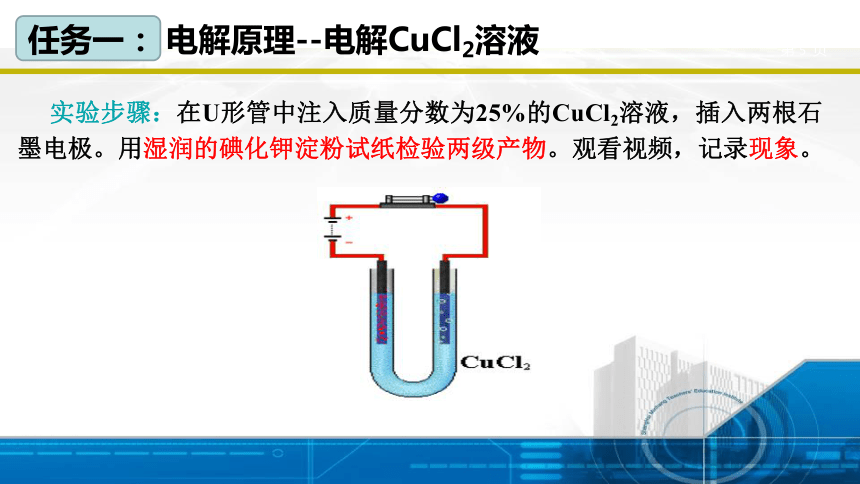
实验步骤:在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨电极。用湿润的碘化钾淀粉试纸检验两级产物。观看视频,记录现象。
任务一: 电解原理--电解CuCl2溶液
任务一: 电解原理--电解CuCl2溶液实验
观看视频之前,根据所学知识预测实验现象。
思考1
任务一: 电解原理--电解CuCl2溶液
实验现象:
1、与负极相连的石墨棒上逐渐覆盖一层红色的固体
2、与正极相连的石墨棒上有气泡产生。
实验结论: CuCl2溶液在通电条件下生成了Cu和Cl2
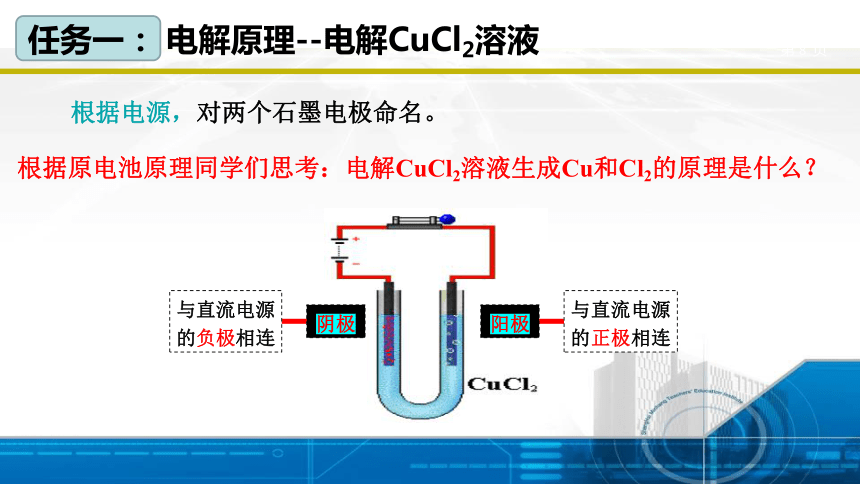
任务一: 电解原理--电解CuCl2溶液
阴极
与直流电源的负极相连
阳极
与直流电源的正极相连
根据电源,对两个石墨电极命名。
根据原电池原理同学们思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
任务一: 电解原理--电解CuCl2溶液
学生活动一:小组讨论以下问题
(1)通电前,氯化铜溶液里主要存在哪些离子?这些离子的运动情况怎样?
(2)通电后,这些离子的运动情况有什么改变?
(3)当离子定向运动到电极表面上时,发生了什么变化?
思考2
任务一: 电解原理--电解CuCl2溶液
电解氯化铜溶液的微观反应过程
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
无规则运动
Cu2+、Cl—
定向运动
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
发生电子得失
Cl
Cl
Cl
Cl
Cu
Cu
阴阳两极上
生成Cu、Cl2
Cl2
Cl2
e
+ -
+ -
+ -
e
任务一: 电解原理--电解CuCl2溶液
外加电源,有动力,此时不能忽略水的电离。 即是,水溶液中考虑H+和OH-的放电。
注意
CuCl2
Cu2+
+
2Cl-
H2O
H+
OH-
+
Cu2+、H+向阴极迁移
Cl-、OH-向阳极迁移
任务一: 电解原理
1、电解:使电流通过电解质溶液,而在阴、阳两极引
起氧化还原反应的过程。
2、电解池:借助于电流引起氧化还原反应的装置,
也就是把电能转化为化学能的装置叫做
电解池或电解槽。
3、电解池构成条件:
①直流电源
②两个电极(惰性电极:Pt、Au或石墨)
③电解质溶液
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
电解原理
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电解池能将化学能转化为电能( )
(2)电解池的阳极与电源的负极相连( )
(3)电解池中,阳离子向阴极移动,阴离子向阳极移动( )
(4)原电池的负极和电解池的阳极均发生氧化反应( )
Ⅹ
Ⅹ
√
√
练习1
任务二: 电解原理--电极反应式书写
阴极Cu2+
Cu2+
+
2Cl-
总反应CuCl2
电解
Cl2↑ + Cu
2e-
阳极 2Cl-
Cl2↑
-
学生活动二:根据现象,两极放电离子分别是什么?
思考讨论1:H+和OH-既然能放电,何没有参与电极反应呢?
任务三: 溶液中离子的放电顺序
思考讨论2:离子放电顺序如何判断呢?
离子放电顺序实质:阳离子氧化性强弱顺序,阴离子还原性强弱顺序
任务三: 溶液中离子的放电顺序
阳离子得电子或阴离子失电子使离子电荷降低的过程叫做放电。
电解时离子放电顺序
1、阴极:阳离子放电,金属活动顺序的反顺序
得电子能力(氧化性)强的阳离子先放电
电极反应产物判断
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+
>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
只在熔融状态下放电
浓度很大时排在H+前
任务三: 溶液中离子的放电顺序
2、阳极:
S2->I->Br->Cl- >OH->含氧酸根>F-
(2)若阳极材料为惰性电极(Pt、Au、石墨),则阳极电极反应为溶液中阴离子放电
(1)若阳极材料为金属电极(除Pt 、Au、外),
则阳极电极反应为金属失电子
金属-ne- = 金属阳离子
阴离子放电顺序
失电子能力(还原性)强的阴离子先放电
任务三: 溶液中离子的放电顺序
阳极
阴极
电源
溶液中离子
金属或阴离子
阳离子
电极 反应
放电 顺序
负阴还原反应
正阳氧化反应
总结提升
思考预测:据电解的基本原理,思考预测电解饱和食盐水的产物,并说明验证产物的方法。
练习2
2.按要求书写电极反应式和总反应式。
(1)用惰性电极电解AgNO3溶液
阳极反应式:_____________________________________________________;
阴极反应式:______________________________________________________;
总反应离子方程式:____________________________________________________。
(3)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:________________________________________________;
阴极反应式:_____________________________________________________;
总反应离子方程式:_________________________________________________。
2H2O-4e-==O2↑+4H+
4Ag++4e-==4Ag
电解
4Ag+O2↑+4H+
4Ag++2H2O
电解
Al2O3+3H2↑
2Al+3H2O
2Al-6e-+3H2O==Al2O3+6H+
6H++6e-===3H2↑
练习3
第四单元 化学反应与电能
第二节 电解原理及其应用
第1课时 电解原理
学习目标
1.以电解氯化铜为例,分析理解电解池的工作原理。
2.会判断离子的放电顺序,会书写其电极反应式。
3.认识电解在实现物质转化和储存能量中的具体应用,可以应用电解的知识分析解决新型电解池。
铜
生活中铜制品纯度很高。高纯度的铜是通过火法冶炼和湿法冶炼制备的。那么,大致流程是什么呢?
情境引入 高纯铜的制备
预备处理:矿石破碎和磨细
电解法提铜
硫酸浸,溶解铜离子
浸出液净化处理,净化方法包括中和沉淀、溶解和重结晶等
铜再次熔炼和精炼
情境引入 电解精炼铜
实验步骤:在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨电极。用湿润的碘化钾淀粉试纸检验两级产物。观看视频,记录现象。
任务一: 电解原理--电解CuCl2溶液
任务一: 电解原理--电解CuCl2溶液实验
观看视频之前,根据所学知识预测实验现象。
思考1
任务一: 电解原理--电解CuCl2溶液
实验现象:
1、与负极相连的石墨棒上逐渐覆盖一层红色的固体
2、与正极相连的石墨棒上有气泡产生。
实验结论: CuCl2溶液在通电条件下生成了Cu和Cl2
任务一: 电解原理--电解CuCl2溶液
阴极
与直流电源的负极相连
阳极
与直流电源的正极相连
根据电源,对两个石墨电极命名。
根据原电池原理同学们思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
任务一: 电解原理--电解CuCl2溶液
学生活动一:小组讨论以下问题
(1)通电前,氯化铜溶液里主要存在哪些离子?这些离子的运动情况怎样?
(2)通电后,这些离子的运动情况有什么改变?
(3)当离子定向运动到电极表面上时,发生了什么变化?
思考2
任务一: 电解原理--电解CuCl2溶液
电解氯化铜溶液的微观反应过程
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
无规则运动
Cu2+、Cl—
定向运动
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
发生电子得失
Cl
Cl
Cl
Cl
Cu
Cu
阴阳两极上
生成Cu、Cl2
Cl2
Cl2
e
+ -
+ -
+ -
e
任务一: 电解原理--电解CuCl2溶液
外加电源,有动力,此时不能忽略水的电离。 即是,水溶液中考虑H+和OH-的放电。
注意
CuCl2
Cu2+
+
2Cl-
H2O
H+
OH-
+
Cu2+、H+向阴极迁移
Cl-、OH-向阳极迁移
任务一: 电解原理
1、电解:使电流通过电解质溶液,而在阴、阳两极引
起氧化还原反应的过程。
2、电解池:借助于电流引起氧化还原反应的装置,
也就是把电能转化为化学能的装置叫做
电解池或电解槽。
3、电解池构成条件:
①直流电源
②两个电极(惰性电极:Pt、Au或石墨)
③电解质溶液
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
电解原理
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电解池能将化学能转化为电能( )
(2)电解池的阳极与电源的负极相连( )
(3)电解池中,阳离子向阴极移动,阴离子向阳极移动( )
(4)原电池的负极和电解池的阳极均发生氧化反应( )
Ⅹ
Ⅹ
√
√
练习1
任务二: 电解原理--电极反应式书写
阴极Cu2+
Cu2+
+
2Cl-
总反应CuCl2
电解
Cl2↑ + Cu
2e-
阳极 2Cl-
Cl2↑
-
学生活动二:根据现象,两极放电离子分别是什么?
思考讨论1:H+和OH-既然能放电,何没有参与电极反应呢?
任务三: 溶液中离子的放电顺序
思考讨论2:离子放电顺序如何判断呢?
离子放电顺序实质:阳离子氧化性强弱顺序,阴离子还原性强弱顺序
任务三: 溶液中离子的放电顺序
阳离子得电子或阴离子失电子使离子电荷降低的过程叫做放电。
电解时离子放电顺序
1、阴极:阳离子放电,金属活动顺序的反顺序
得电子能力(氧化性)强的阳离子先放电
电极反应产物判断
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+
>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
只在熔融状态下放电
浓度很大时排在H+前
任务三: 溶液中离子的放电顺序
2、阳极:
S2->I->Br->Cl- >OH->含氧酸根>F-
(2)若阳极材料为惰性电极(Pt、Au、石墨),则阳极电极反应为溶液中阴离子放电
(1)若阳极材料为金属电极(除Pt 、Au、外),
则阳极电极反应为金属失电子
金属-ne- = 金属阳离子
阴离子放电顺序
失电子能力(还原性)强的阴离子先放电
任务三: 溶液中离子的放电顺序
阳极
阴极
电源
溶液中离子
金属或阴离子
阳离子
电极 反应
放电 顺序
负阴还原反应
正阳氧化反应
总结提升
思考预测:据电解的基本原理,思考预测电解饱和食盐水的产物,并说明验证产物的方法。
练习2
2.按要求书写电极反应式和总反应式。
(1)用惰性电极电解AgNO3溶液
阳极反应式:_____________________________________________________;
阴极反应式:______________________________________________________;
总反应离子方程式:____________________________________________________。
(3)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:________________________________________________;
阴极反应式:_____________________________________________________;
总反应离子方程式:_________________________________________________。
2H2O-4e-==O2↑+4H+
4Ag++4e-==4Ag
电解
4Ag+O2↑+4H+
4Ag++2H2O
电解
Al2O3+3H2↑
2Al+3H2O
2Al-6e-+3H2O==Al2O3+6H+
6H++6e-===3H2↑
练习3
