【任务驱动式】4.2.2 电解原理的应用 课件(共27张PPT)高二化学人教版2019选择性必修1
文档属性
| 名称 | 【任务驱动式】4.2.2 电解原理的应用 课件(共27张PPT)高二化学人教版2019选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 35.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-25 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第四单元 化学反应与电能
第二节 电解原理及其应用
第2课时 电解原理的应用
学习目标
1. 能利用电解池的工作原理解释氯碱工业,电镀,电解精炼以及电冶金的基本原理,会书写电极反应式和总反应。
2. 进一步理解电解在实现物质转化和储存能量中的具体应用,并能够熟练分析新型的电解池装置。
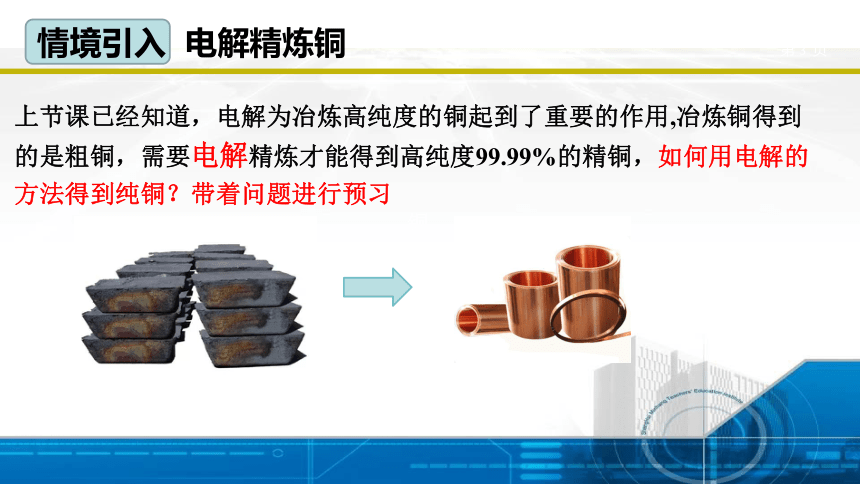
上节课已经知道,电解为冶炼高纯度的铜起到了重要的作用,冶炼铜得到的是粗铜,需要电解精炼才能得到高纯度99.99%的精铜,如何用电解的方法得到纯铜?带着问题进行预习
铜
情境引入 电解精炼铜
思考以下问题:
(1)食盐水中的离子:
湿润的淀粉
KI试纸变蓝
(2)离子移动方向:
Cl-、OH- 移向阳极,
H+、Na+ 移向阴极。
(3)预测现象:
阴极有无色气体产生,阴极端溶液变红,阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
H+、Na+、Cl-、OH-
任务一: 电解饱和食盐水原理
思考1
任务一: 电解饱和食盐水原理
电解饱和食盐水(模拟氯碱工业),根据原理,预测实验现象
电解饱和NaCl溶液
阴极
阳极
铁钉
石墨
实验阴极使用金属材料,目的在于增强导电性能
注意:选择电极材料时,注意阳极材料可能参与电极反应
任务一: 电解饱和食盐水原理
阳极 阴极
存在离子
电极反应
产物检验
总反应 Cl-、OH-
2e-
2Cl-
Cl2↑
-
Na+ 、H+
2e-
2H+
+
H2↑
2e-
[ 2H2O
H2↑ +2OH-]
+
点燃法检验H2
酚酞变红检验碱性
2NaCl +
2H2O
电解
H2↑ + 2NaOH + Cl2↑
湿润的淀粉KI试纸
变蓝检验Cl2
总结归纳
学生活动一:思考讨论1:上述装置的缺点,并小组展示。
(1)H2和Cl2 混合不安全。
(2)Cl2会和NaOH反应,会使得到的NaOH不纯。
思考2
任务二: 电解饱和食盐水实验改进
学生活动一:思考讨论2::如何改进装置呢?
提示:隔离阴阳极,控制离子移动
使用离子交换膜隔离阴阳极
Cl2+2NaOH =NaCl+NaClO+H2O
遇火或强光会爆炸
(1)离子交换膜的作用:
a.防止H2和Cl2混合而引起爆炸;
b.避免Cl2和NaOH反应影响NaOH的产量。
c.平衡电荷,形成闭合回路的作用
(2)常用的离子交换膜
阳离子交换膜:只允许阳离子和水通过,不允许阴离子和气体通过
阴离子交换膜:只允许阴离子和水通过,不允许阳离子和气体通过
质子交换膜: 只允许质子(H+)和水分子通过
任务二: 电解饱和食盐水实验改进
思考:使用阳离子膜更合适
总结:(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛
阳离子交换膜:只允许阳离子通过
(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
任务二: 电解饱和食盐水实验改进
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
钛
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极室
阴极室
a、避免氢气和氯气混合爆炸
b、避免氯气和氢氧化钠反应,降低氢氧化钠产量
碳钢
淡盐水
任务二: 电解饱和食盐水实验改进
氯碱工业产品及其应用
以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
湿氯气
液碱
H2
Cl2
含氯漂白剂
NaOH
金属冶炼
有机合成
HCl
盐酸
有机合成
氯化物合成
农药
有机合成、造纸
玻璃、肥皂
纺织、印染
任务二: 电解饱和食盐水实验改进
粗铜制备精铜,如何设计电解装置?
思考(1)粗铜生成铜离子,应该在哪一极进行?
(2)电解质溶液选择原则。
任务三: 电解精炼铜
思考3
实验装置
阳极
阴极
(粗铜) :
(纯铜) :
Cu-2e-= Cu2+
Cu2+ + 2e-= Cu
硫酸铜溶液
阳极反应书写准确吗?
思考4
任务三: 电解精炼铜
精铜精炼:
①电极反应式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电解液:
含Cu2+离子的电解质溶液
Fe - 2e- = Fe2+ Zn - 2e- = Zn2+
Ni - 2e- = Ni2+
硫酸铜溶液
任务三: 电解精炼铜
说明:粗铜制备精铜
1.粗铜作阳极,纯铜作阴极。
2.粗铜中排在Cu前的金属在失电子,包括锌、铁、镍和铜,而排在Cu后的银、金、铂等以金属单质的形式沉积在电解槽底部,形成阳极泥,阴极放电顺序:Cu2+>H+>Ni2+>Fe2+>Zn2+,仅有Cu2+放电
3.溶液中Cu2+的浓度有所下降。
4.铜离子变为铜单质,其他离子留在溶液中,从而达到精炼的目的
任务三: 电解精炼铜
1、定义:用电解法可将通常极难被还厦的活泼金属 从它们的化合物中还原出来即称为电治金
2、原理:Mn+ + ne- = M
3、适用范围:电解是最强有力的氧化还原手段,适用于冶炼活泼金属单质,如钠、钙、镁、铝等金属
任务四: 电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl(熔融) === 2Na+Cl2↑
电解
4.电解熔融NaCl制金属钠
阳极:
2 Cl-- 2e- = Cl2↑
阴极:
2 Na++2e- = 2Na
任务四: 电冶金
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) === 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
5.电解熔融Al2O3制金属铝
任务四: 电冶金
5、冶炼金属的方法总结
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
总结归纳
使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
2.电镀的特点
阳极本身参加电极反应;电解质溶液的浓度保持不变。
阳极:镀层金属
阴极:待镀金属制品(即镀件)
1.主要目的
任务五: 电镀
1.如图是某同学用Cu片在Fe片上镀铜的实验装置,下列说法正确的是( )
A.Cu2+在A极被还原
B.溶液蓝色逐渐变浅
C.Cu片为A极,Fe片为B极
D.若A极和B极直接相连,则金属铜被氧化
练习一
C
电镀 电解精炼
装置
阳极材料 镀层金属Cu 粗铜(含锌、银、金等杂质)
阴极材料 镀件金属Fe 纯铜
阳极反应 Cu-2e-===Cu2+ Zn-2e-===Zn2+、Cu-2e-===Cu2+等
阴极反应 Cu2++2e-===Cu Cu2++2e-===Cu
溶液变化 Cu2+浓度保持不变 Cu2+浓度减小,金、银等金属沉积形成阳极泥
总结归纳
2.许多手机都采用了阳极氧化工艺,铝型材阳极氧化是一种电解氧化,铝及其合金在外加电流的作用下,在铝制品(阳极)上形成一层多孔而致密,平整且均匀的氧化铝,以防止铝合金进一步氧化
阳极:2Al-6e- + 3H2O= Al2O3 + 6H+
阴极:2H+ + 2e-= H2↑
练习二
3.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
练习三
3.下列描述中不符合生产实际的是( )
A.电解水制氢气时,用铜作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
A
练习三
4.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
练习四
第四单元 化学反应与电能
第二节 电解原理及其应用
第2课时 电解原理的应用
学习目标
1. 能利用电解池的工作原理解释氯碱工业,电镀,电解精炼以及电冶金的基本原理,会书写电极反应式和总反应。
2. 进一步理解电解在实现物质转化和储存能量中的具体应用,并能够熟练分析新型的电解池装置。
上节课已经知道,电解为冶炼高纯度的铜起到了重要的作用,冶炼铜得到的是粗铜,需要电解精炼才能得到高纯度99.99%的精铜,如何用电解的方法得到纯铜?带着问题进行预习
铜
情境引入 电解精炼铜
思考以下问题:
(1)食盐水中的离子:
湿润的淀粉
KI试纸变蓝
(2)离子移动方向:
Cl-、OH- 移向阳极,
H+、Na+ 移向阴极。
(3)预测现象:
阴极有无色气体产生,阴极端溶液变红,阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
H+、Na+、Cl-、OH-
任务一: 电解饱和食盐水原理
思考1
任务一: 电解饱和食盐水原理
电解饱和食盐水(模拟氯碱工业),根据原理,预测实验现象
电解饱和NaCl溶液
阴极
阳极
铁钉
石墨
实验阴极使用金属材料,目的在于增强导电性能
注意:选择电极材料时,注意阳极材料可能参与电极反应
任务一: 电解饱和食盐水原理
阳极 阴极
存在离子
电极反应
产物检验
总反应 Cl-、OH-
2e-
2Cl-
Cl2↑
-
Na+ 、H+
2e-
2H+
+
H2↑
2e-
[ 2H2O
H2↑ +2OH-]
+
点燃法检验H2
酚酞变红检验碱性
2NaCl +
2H2O
电解
H2↑ + 2NaOH + Cl2↑
湿润的淀粉KI试纸
变蓝检验Cl2
总结归纳
学生活动一:思考讨论1:上述装置的缺点,并小组展示。
(1)H2和Cl2 混合不安全。
(2)Cl2会和NaOH反应,会使得到的NaOH不纯。
思考2
任务二: 电解饱和食盐水实验改进
学生活动一:思考讨论2::如何改进装置呢?
提示:隔离阴阳极,控制离子移动
使用离子交换膜隔离阴阳极
Cl2+2NaOH =NaCl+NaClO+H2O
遇火或强光会爆炸
(1)离子交换膜的作用:
a.防止H2和Cl2混合而引起爆炸;
b.避免Cl2和NaOH反应影响NaOH的产量。
c.平衡电荷,形成闭合回路的作用
(2)常用的离子交换膜
阳离子交换膜:只允许阳离子和水通过,不允许阴离子和气体通过
阴离子交换膜:只允许阴离子和水通过,不允许阳离子和气体通过
质子交换膜: 只允许质子(H+)和水分子通过
任务二: 电解饱和食盐水实验改进
思考:使用阳离子膜更合适
总结:(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛
阳离子交换膜:只允许阳离子通过
(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
任务二: 电解饱和食盐水实验改进
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
钛
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极室
阴极室
a、避免氢气和氯气混合爆炸
b、避免氯气和氢氧化钠反应,降低氢氧化钠产量
碳钢
淡盐水
任务二: 电解饱和食盐水实验改进
氯碱工业产品及其应用
以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
湿氯气
液碱
H2
Cl2
含氯漂白剂
NaOH
金属冶炼
有机合成
HCl
盐酸
有机合成
氯化物合成
农药
有机合成、造纸
玻璃、肥皂
纺织、印染
任务二: 电解饱和食盐水实验改进
粗铜制备精铜,如何设计电解装置?
思考(1)粗铜生成铜离子,应该在哪一极进行?
(2)电解质溶液选择原则。
任务三: 电解精炼铜
思考3
实验装置
阳极
阴极
(粗铜) :
(纯铜) :
Cu-2e-= Cu2+
Cu2+ + 2e-= Cu
硫酸铜溶液
阳极反应书写准确吗?
思考4
任务三: 电解精炼铜
精铜精炼:
①电极反应式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电解液:
含Cu2+离子的电解质溶液
Fe - 2e- = Fe2+ Zn - 2e- = Zn2+
Ni - 2e- = Ni2+
硫酸铜溶液
任务三: 电解精炼铜
说明:粗铜制备精铜
1.粗铜作阳极,纯铜作阴极。
2.粗铜中排在Cu前的金属在失电子,包括锌、铁、镍和铜,而排在Cu后的银、金、铂等以金属单质的形式沉积在电解槽底部,形成阳极泥,阴极放电顺序:Cu2+>H+>Ni2+>Fe2+>Zn2+,仅有Cu2+放电
3.溶液中Cu2+的浓度有所下降。
4.铜离子变为铜单质,其他离子留在溶液中,从而达到精炼的目的
任务三: 电解精炼铜
1、定义:用电解法可将通常极难被还厦的活泼金属 从它们的化合物中还原出来即称为电治金
2、原理:Mn+ + ne- = M
3、适用范围:电解是最强有力的氧化还原手段,适用于冶炼活泼金属单质,如钠、钙、镁、铝等金属
任务四: 电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl(熔融) === 2Na+Cl2↑
电解
4.电解熔融NaCl制金属钠
阳极:
2 Cl-- 2e- = Cl2↑
阴极:
2 Na++2e- = 2Na
任务四: 电冶金
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) === 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
5.电解熔融Al2O3制金属铝
任务四: 电冶金
5、冶炼金属的方法总结
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
总结归纳
使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
2.电镀的特点
阳极本身参加电极反应;电解质溶液的浓度保持不变。
阳极:镀层金属
阴极:待镀金属制品(即镀件)
1.主要目的
任务五: 电镀
1.如图是某同学用Cu片在Fe片上镀铜的实验装置,下列说法正确的是( )
A.Cu2+在A极被还原
B.溶液蓝色逐渐变浅
C.Cu片为A极,Fe片为B极
D.若A极和B极直接相连,则金属铜被氧化
练习一
C
电镀 电解精炼
装置
阳极材料 镀层金属Cu 粗铜(含锌、银、金等杂质)
阴极材料 镀件金属Fe 纯铜
阳极反应 Cu-2e-===Cu2+ Zn-2e-===Zn2+、Cu-2e-===Cu2+等
阴极反应 Cu2++2e-===Cu Cu2++2e-===Cu
溶液变化 Cu2+浓度保持不变 Cu2+浓度减小,金、银等金属沉积形成阳极泥
总结归纳
2.许多手机都采用了阳极氧化工艺,铝型材阳极氧化是一种电解氧化,铝及其合金在外加电流的作用下,在铝制品(阳极)上形成一层多孔而致密,平整且均匀的氧化铝,以防止铝合金进一步氧化
阳极:2Al-6e- + 3H2O= Al2O3 + 6H+
阴极:2H+ + 2e-= H2↑
练习二
3.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
练习三
3.下列描述中不符合生产实际的是( )
A.电解水制氢气时,用铜作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
A
练习三
4.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
练习四
