到实验室去:探究酸和碱的化学性质 2023-2024学年九年级化学下册同步课堂(鲁教版) 课件
文档属性
| 名称 | 到实验室去:探究酸和碱的化学性质 2023-2024学年九年级化学下册同步课堂(鲁教版) 课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-30 08:51:32 | ||
图片预览










文档简介
(共35张PPT)
到实验室去:
探究酸和碱的化学性质
第七章 常见的酸和碱
学习目标
CONTENTS
1
通过实验进一步认识酸、碱的化学通性
2
初步学会使用酸碱指示剂和pH试纸检验溶液的酸碱性
3
初步学会运用间接观察法收集证据,感悟探究物质化学性质的一般思路和方法
课堂导入
酸都能解离出相同阳离子—氢离子,碱都能解离出相同的阴离子—氢氧根离子,所以酸碱都有通性。但酸的酸根阴离子和碱的金属阳离子不同,有都存在差异。
一、实验用品
1.化学试剂
1.石蕊试液、酚酞试液、pH试纸、pH计
2.稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液(澄清石灰水)、氯化钠溶液
3.镁条、石灰石、2%氯化铜溶液、生锈铁钉、2%碳酸钠溶液
一、实验用品
2.化学仪器
试管、烧杯、胶头滴管、点滴板、玻璃片、白瓷板、玻璃棒
【友情提示】
因酸、碱溶液都具有腐蚀性,故取用时要小心,如果不慎洒落在皮肤或衣物上,应立即_________;万一溅到眼睛里,要立即_______________,同时报告老师。
用水冲洗
用大量的水冲洗
二、实验过程
1.酸、碱与指示剂作用
(1)实验步骤
①在洁净的点滴板上或小试管中分别滴加5~6滴稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液和氯化钠溶液。
②用5片pH试纸分别测上述5种溶液的pH,读出并记录溶液的pH。
③分别向上述5种溶液中滴加1~2滴石蕊试液,观察溶液颜色的变化。将石蕊试液换成酚酞试液,重复上述操作,观察溶液颜色的变化。
二、实验过程
1.酸、碱与指示剂作用
(2)实验现象与结果
①稀盐酸、稀硫酸的pH___,
能使紫色石蕊试液_______,使酚酞试液_______;
②NaOH溶液、Ca(OH)2溶液的pH___,能使紫色石蕊试液 ,使酚酞试液_______。
③氯化钠溶液pH___,不能使石蕊试液和酚酞试液变色,即石蕊试液仍是___色,酚酞试液仍是___色。
<7
变红色
不变色
>7
变蓝色
变红色
=7
紫
无
稀盐酸 稀硫酸 氢氧化钠 氢氧化钙 食盐水
紫色石蕊
无色酚酞
二、实验过程
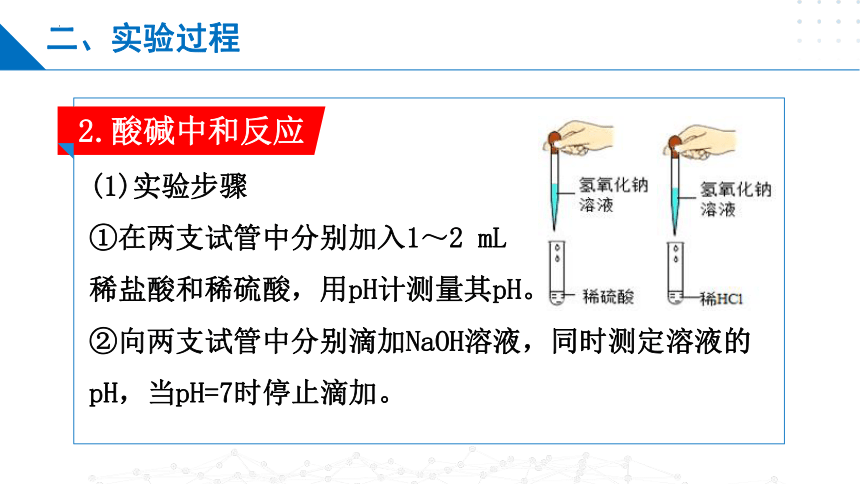
2.酸碱中和反应
(1)实验步骤
①在两支试管中分别加入1~2 mL
稀盐酸和稀硫酸,用pH计测量其pH。
②向两支试管中分别滴加NaOH溶液,同时测定溶液的pH,当pH=7时停止滴加。
二、实验过程
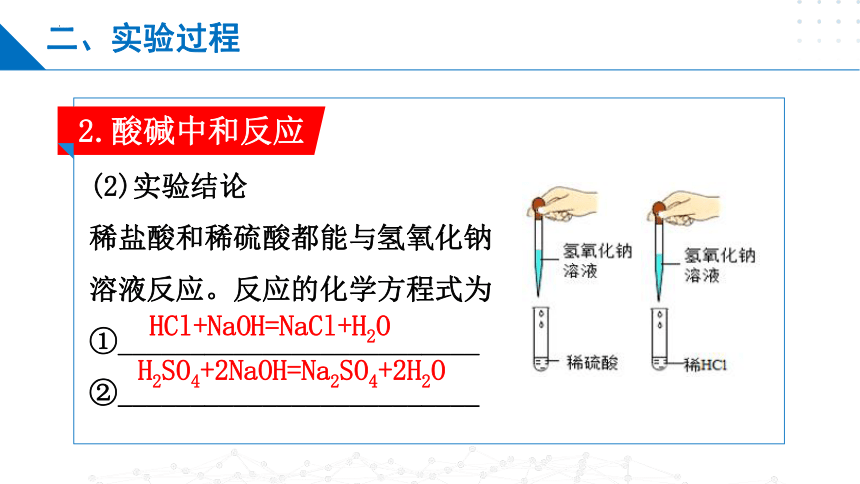
2.酸碱中和反应
(2)实验结论
稀盐酸和稀硫酸都能与氢氧化钠
溶液反应。反应的化学方程式为
①_________________________
②_________________________
HCl+NaOH=NaCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
镁条
稀 盐 酸 现象 有_____产生
化学 方程式 ______________________
气泡
Mg+2HCl=MgCl2+H2↑
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
石灰石
稀 盐 酸 现象 有_____产生
化学 方程式 ____________________
气泡
CaCO3+2HCl=CaCl2+CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
生锈铁钉
稀 盐 酸 现象 溶液逐渐变成_____,铁钉逐渐变得光亮,有_____生成
化学 方程式 ________________________
______________________
黄色
气泡
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
碳酸钠溶液
稀 盐 酸 现象 有_____生成
化学 方程式 _________________________
气泡
Na2CO3+2HCl=2NaCl+CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
镁条 石灰石 生锈铁钉 碳酸钠溶液
稀 硫 酸 现象 有_____产生 有_____产生,产生气体的速率逐渐变小至停止 溶液逐渐变成_____,铁钉逐渐变得光亮,有_____产生 有_____产生
化学 方程式 ________________ _____________________ ______________________ ______________________ __________
__________
_________
气泡
气泡
黄色
气泡
气泡
Mg+H2SO4=MgSO4+H2↑
CaCO3+H2SO4=CaSO4+CO2↑+H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe+H2SO4=FeSO4+H2↑
Na2CO3+H2SO4
=Na2SO4+
CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
(2)碱的其他化学性质
氯化铜溶液 碳酸钠溶液 生锈铁钉
氢氧化钠溶液 现象 有_________生成 不反应 不反应
化学 方程式 _______________ _______________
氢氧化钙溶液 现象 有_________生成 有_________生成 不反应
化学 方程式 _________________ _______________ ______________ ____________
蓝色沉淀
CuCl2+2NaOH=
2NaCl+Cu(OH)2↓
蓝色沉淀
白色沉淀
CuCl2+Ca(OH)2=
CaCl2+Cu(OH)2↓
Na2CO3+Ca(OH)2
=CaCO3↓+2NaOH
三、实验反思
1.点滴板
实验室中你使用的是试管还是点滴板 你认为使用哪种仪器更方便
提示:大多数实验使用点滴板,少数实验使用试管,相比较而言,点滴板现象明显直观、可操作性好、药品用量节约、环境污染小,属于一种比较方便的仪器,但也有一定的局限性,如生锈铁钉过大时,就不宜采用点滴板,只有液体量少,所用固体较小时才可采用点滴板。
三、实验反思
2.酸碱与酸碱性
王强认为酸性溶液即酸溶液,碱性溶液即碱溶液,你认为他的观点是否正确,为什么
提示:不正确。酸溶液呈酸性,但酸性溶液不一定是酸溶液,如硫酸铵溶液呈酸性,但属于盐溶液;碱溶液呈碱性,但碱性溶液不一定是碱溶液,如碳酸钠属于盐,但其水溶液呈碱性。
三、实验反思
3.测定溶液的pH
测定某溶液的pH时,若将pH试纸用水润湿后,放到白瓷板上,再用玻璃棒蘸取溶液滴到pH试纸上,你认为这种操作对测定溶液的pH会产生什么影响
提示:pH试纸用水润湿后,再滴上待测液,相当于将待测液体稀释了,对于酸、碱及中性液体会产生不同的影响,如测量的液体为酸性液体,则稀释后酸性降低,pH会增大;如测量的液体为碱性液体,则稀释后碱性降低,pH会减小;如测量的为中性液体,pH将不变。
三、实验反思
4.稀硫酸与石灰石反应
为什么稀硫酸与石灰石反应时,开始有较多气泡产生,而后是逐渐变少至停止
提示:硫酸与碳酸钙反应生成硫酸钙,硫酸钙是一种在水中溶解量较少的物质,开始时,硫酸钙的量少,随着反应的进行,产生的硫酸钙逐渐增多,这些硫酸钙不能都溶解,会沉积在石灰石的表面,从而将硫酸与石灰石隔绝开来,使得反应停止。
四、方法归纳
酸碱盐的鉴别规律
物质的鉴别通常是利用所鉴别物质的性质差异来寻找合适的方法加以区分,酸碱盐的鉴别题也是如此,也有一定规律可循,现归纳如下:
(1)三种溶液加一种试剂鉴别。
①三种溶液恰好为酸性、中性、碱性一次性鉴别可用
紫色石蕊试液或pH试纸。而如果使用无色酚酞试液鉴
别,则必须进一步利用组内物质相互反应进行鉴别。
②加试剂,产生气体、沉淀和无现象。
酸性 中性 碱性
石蕊 红 紫 蓝
pH试纸 pH<7 pH=7 pH>7
四、方法归纳
酸碱盐的鉴别规律
(2)不加试剂。
①从溶液颜色入手,依次鉴别;②利用组内溶液两两混合鉴别。
(3)只用水就可以鉴别的物质。
只用水鉴别的物质一般分以下三种情况:
①可溶于水和不溶于水的物质。如鉴别碳酸钙和碳酸钠两种白色固体。碳酸钙不溶于水,而碳酸钠溶于水。
②溶于水后是否会变色的物质。如鉴别白色的无水硫酸铜和碳酸钠。白色的无水硫酸铜遇水变蓝,碳酸钠溶于水为无色。
③溶于水后是否有温度改变的物质。如鉴别硝酸铵、氢氧化钠和氯化钠。硝酸铵溶于水后会降温,固体氢氧化钠溶于水后会升温,氯化钠溶于水后温度不变。
实验演练
典型例题1:
【典例1】某化学兴趣小组为探究盐酸的化学
性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A中观察到紫色石蕊试液变 色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了 (填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式 。
(3)试管C中发生反应的化学方程式是 。
(4)试管D中加稀盐酸至过量,始终没有明显现象。请你设计实验方案证明试管D中的NaOH与HCl发生了反应, (写出操作及其现象)。
红
FeCl3
Fe+2HCl=FeCl2+H2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
向氢氧化钠溶液中滴入几滴酚酞试液,再逐滴加入稀盐酸;溶液由红色变为无色
实验演练
典型例题2:
下列图像与对应的实验操作相符合的是( )
A.图甲一定量NaOH固体投入到蒸馏水中
B.图乙一定量NaOH溶液加水稀释
C.图丙一定量NaOH溶液中滴加稀盐酸
D.图丁一定量NaOH溶液中滴加硫酸铜溶液
A
课堂达标
(二)药理作用
1. “酸”对我们来说一定不陌生。下列说法正确的是( )
A.稀盐酸不能用于除铁锈
B.浓硫酸具有腐蚀性
C.浓盐酸没有挥发性
D.稀盐酸能使无色酚酞溶液变红
B
课堂达标
(二)药理作用
2.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )
A.① B.②
C.③ D.④
C
课堂达标
(二)药理作用
3.物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )
A.稀盐酸中含有氢离子-具有酸性-检验溶液中是否含有银离子
B.稀盐酸中含有氯离子-具有酸性-检验溶液中是否含有银离子
C.氢氧化钠溶液中含有钠离子-具有碱性-吸收二氧化硫气体
D.氢氧化钠溶液中含有氢氧根离子-具有碱性-吸收二氧化硫气体
D
课堂达标
(二)药理作用
4.从不同的角度认识NaOH+HCl═NaCl+H2O,下列选项正确的是( )
A.基本反应类型:该反应为中和反应
B.反应实质:氢离子与氧氧根离子结合生成水
C.反应物:氢氧化钠可以用来治疗胃酸过多
D.读法:氢氧化钠加氯化氢完全反应生成氯化钠加水
B
课堂达标
(二)药理作用
5.氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不正确的是( )
A.盐酸中存在的微粒有水分子和氯化氢分子
B.该反应的微观实质是H+和OH﹣结合生成水分子
C.Na+和Cl﹣在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
课堂达标
6.如图甲所示装置,同学们借助传感器监测溶液pH和温度的变化情况来探究稀盐酸和氢氧化钠溶液的反应,图乙为反应过程中溶液的pH变化曲线,图丙为反应过程中溶液温度的变化曲线,则下列说法正确的是( )
A.该反应属于化合反应
B.由图丙可知该反应为吸热反应
C.图乙曲线的c点表示该反应恰好完全反应
D.图乙曲线的d点溶液中溶质为NaCl
C
课堂达标
(二)药理作用
7.东营某化工厂产生的污水pH=2,主要污染物是硫酸。现要将污水调节至接近中性,达标后再排放,下列说法不正确的是( )
A.检测:用pH试纸或pH计检测污水的酸碱度
B.原理:处理酸性污水的实质是消耗污水中的氢离子C.验证:取水样,加入少量氯化钡溶液后出现白色沉淀,证明处理未达标
D.应用:可与造纸厂排放的碱性污水混合,达标后再排放
C
课堂小结
(二)药理作用
8.化学精灵提供的实验仪器和药品还有很多。某同学在做“稀盐酸中和氢氧化钠溶液”的实验时,发现向烧杯中滴加稀盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度,他赶紧补滴酚酞溶液,发现溶液仍然为无色。于是他和同学们一起对烧杯内溶液的溶质成分进行探究。
【提出问题】该烧杯内溶液的溶质除酚酞外还有什么?
【提出猜想】猜想一:只有NaCl;
猜想二:有 (填化学式);
猜想三:有NaCl和NaOH。
【分析与思考】根据已有的实验现象,小爱认为其中猜想 肯定不正确。
【进行实验】为进一步确认溶液的溶质成分,小荷进行了如下实验:取样,加入适量的碳酸钠溶液,观察到 。
【得出结论】上述现象说明猜想二正确。
【反思与交流】小平认为,另选与小荷实验中不同类别的物质,如 (填一种物质名称即可),也能得到上述相同的结论。
NaCl和HCl
三
锌
有气泡产生
课堂小结
(二)药理作用
9.兴趣小组用稀盐酸清洗铁夹表面的铁锈(主要成分为氧化铁),并进行保护实验。
(1)除铁锈的反应属于 (填基本反应类型)。
(2)铁夹在稀盐酸中浸泡较长时间,有气体产生。产生气体的化学方程式为 。
(3)将清洗过的铁夹进行“发蓝”处理,形成致密的氧化物保护膜,其主要成分与铁在氧气中燃烧的产物相同,该氧化物的化学式为 。
(4)验证废液显酸性,可选用的一种试剂或用品是 。
(5)用氢氧化钠中和废液中的盐酸,反应的化学方程式为
。
复分解反应
Fe+2HCl═FeCl2+H2↑
Fe3O4
pH试纸或紫色石蕊溶液等
HCl+NaOH═NaCl+H2O
课堂小结
(二)药理作用
10.常温下,向盛有100gKOH溶液的烧杯逐滴加入溶质的质量分数为7.3%的稀盐酸,滴加过程中溶液pH变化如图所示。(说明:KCl溶液呈中性)
(1)恰好完全反应时,所加稀
盐酸的质量为 g。
(2)该KOH溶液中溶质的质量分
数是多少?(答案精确到0.1%)
课堂小结
(二)药理作用
解:(1)当盐酸的质量为50g时,此时溶液的pH=7,说明此时盐酸与氢氧化钾恰好完全反应;
(2)消耗的稀盐酸的质量为50g×7.3%=3.65g
设氢氧化钾的质量为x
KOH + HCl = KCl + H2O
56 36.5
x 3.65g
56/36.5=x/3.65g
x=5.6g
答:KOH溶液中溶质的质量分数是 5.6g/100g×100%=5.6%。
谢谢观看
THANKS
到实验室去:
探究酸和碱的化学性质
第七章 常见的酸和碱
学习目标
CONTENTS
1
通过实验进一步认识酸、碱的化学通性
2
初步学会使用酸碱指示剂和pH试纸检验溶液的酸碱性
3
初步学会运用间接观察法收集证据,感悟探究物质化学性质的一般思路和方法
课堂导入
酸都能解离出相同阳离子—氢离子,碱都能解离出相同的阴离子—氢氧根离子,所以酸碱都有通性。但酸的酸根阴离子和碱的金属阳离子不同,有都存在差异。
一、实验用品
1.化学试剂
1.石蕊试液、酚酞试液、pH试纸、pH计
2.稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液(澄清石灰水)、氯化钠溶液
3.镁条、石灰石、2%氯化铜溶液、生锈铁钉、2%碳酸钠溶液
一、实验用品
2.化学仪器
试管、烧杯、胶头滴管、点滴板、玻璃片、白瓷板、玻璃棒
【友情提示】
因酸、碱溶液都具有腐蚀性,故取用时要小心,如果不慎洒落在皮肤或衣物上,应立即_________;万一溅到眼睛里,要立即_______________,同时报告老师。
用水冲洗
用大量的水冲洗
二、实验过程
1.酸、碱与指示剂作用
(1)实验步骤
①在洁净的点滴板上或小试管中分别滴加5~6滴稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液和氯化钠溶液。
②用5片pH试纸分别测上述5种溶液的pH,读出并记录溶液的pH。
③分别向上述5种溶液中滴加1~2滴石蕊试液,观察溶液颜色的变化。将石蕊试液换成酚酞试液,重复上述操作,观察溶液颜色的变化。
二、实验过程
1.酸、碱与指示剂作用
(2)实验现象与结果
①稀盐酸、稀硫酸的pH___,
能使紫色石蕊试液_______,使酚酞试液_______;
②NaOH溶液、Ca(OH)2溶液的pH___,能使紫色石蕊试液 ,使酚酞试液_______。
③氯化钠溶液pH___,不能使石蕊试液和酚酞试液变色,即石蕊试液仍是___色,酚酞试液仍是___色。
<7
变红色
不变色
>7
变蓝色
变红色
=7
紫
无
稀盐酸 稀硫酸 氢氧化钠 氢氧化钙 食盐水
紫色石蕊
无色酚酞
二、实验过程
2.酸碱中和反应
(1)实验步骤
①在两支试管中分别加入1~2 mL
稀盐酸和稀硫酸,用pH计测量其pH。
②向两支试管中分别滴加NaOH溶液,同时测定溶液的pH,当pH=7时停止滴加。
二、实验过程
2.酸碱中和反应
(2)实验结论
稀盐酸和稀硫酸都能与氢氧化钠
溶液反应。反应的化学方程式为
①_________________________
②_________________________
HCl+NaOH=NaCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
镁条
稀 盐 酸 现象 有_____产生
化学 方程式 ______________________
气泡
Mg+2HCl=MgCl2+H2↑
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
石灰石
稀 盐 酸 现象 有_____产生
化学 方程式 ____________________
气泡
CaCO3+2HCl=CaCl2+CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
生锈铁钉
稀 盐 酸 现象 溶液逐渐变成_____,铁钉逐渐变得光亮,有_____生成
化学 方程式 ________________________
______________________
黄色
气泡
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
碳酸钠溶液
稀 盐 酸 现象 有_____生成
化学 方程式 _________________________
气泡
Na2CO3+2HCl=2NaCl+CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
采用试管、滴管等仪器使酸碱与某些金属、氧化物、盐反应,观察、记录并分析现象。
(1)酸的其他化学性质
镁条 石灰石 生锈铁钉 碳酸钠溶液
稀 硫 酸 现象 有_____产生 有_____产生,产生气体的速率逐渐变小至停止 溶液逐渐变成_____,铁钉逐渐变得光亮,有_____产生 有_____产生
化学 方程式 ________________ _____________________ ______________________ ______________________ __________
__________
_________
气泡
气泡
黄色
气泡
气泡
Mg+H2SO4=MgSO4+H2↑
CaCO3+H2SO4=CaSO4+CO2↑+H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe+H2SO4=FeSO4+H2↑
Na2CO3+H2SO4
=Na2SO4+
CO2↑+H2O
二、实验过程
3.酸、碱的其他化学性质
(2)碱的其他化学性质
氯化铜溶液 碳酸钠溶液 生锈铁钉
氢氧化钠溶液 现象 有_________生成 不反应 不反应
化学 方程式 _______________ _______________
氢氧化钙溶液 现象 有_________生成 有_________生成 不反应
化学 方程式 _________________ _______________ ______________ ____________
蓝色沉淀
CuCl2+2NaOH=
2NaCl+Cu(OH)2↓
蓝色沉淀
白色沉淀
CuCl2+Ca(OH)2=
CaCl2+Cu(OH)2↓
Na2CO3+Ca(OH)2
=CaCO3↓+2NaOH
三、实验反思
1.点滴板
实验室中你使用的是试管还是点滴板 你认为使用哪种仪器更方便
提示:大多数实验使用点滴板,少数实验使用试管,相比较而言,点滴板现象明显直观、可操作性好、药品用量节约、环境污染小,属于一种比较方便的仪器,但也有一定的局限性,如生锈铁钉过大时,就不宜采用点滴板,只有液体量少,所用固体较小时才可采用点滴板。
三、实验反思
2.酸碱与酸碱性
王强认为酸性溶液即酸溶液,碱性溶液即碱溶液,你认为他的观点是否正确,为什么
提示:不正确。酸溶液呈酸性,但酸性溶液不一定是酸溶液,如硫酸铵溶液呈酸性,但属于盐溶液;碱溶液呈碱性,但碱性溶液不一定是碱溶液,如碳酸钠属于盐,但其水溶液呈碱性。
三、实验反思
3.测定溶液的pH
测定某溶液的pH时,若将pH试纸用水润湿后,放到白瓷板上,再用玻璃棒蘸取溶液滴到pH试纸上,你认为这种操作对测定溶液的pH会产生什么影响
提示:pH试纸用水润湿后,再滴上待测液,相当于将待测液体稀释了,对于酸、碱及中性液体会产生不同的影响,如测量的液体为酸性液体,则稀释后酸性降低,pH会增大;如测量的液体为碱性液体,则稀释后碱性降低,pH会减小;如测量的为中性液体,pH将不变。
三、实验反思
4.稀硫酸与石灰石反应
为什么稀硫酸与石灰石反应时,开始有较多气泡产生,而后是逐渐变少至停止
提示:硫酸与碳酸钙反应生成硫酸钙,硫酸钙是一种在水中溶解量较少的物质,开始时,硫酸钙的量少,随着反应的进行,产生的硫酸钙逐渐增多,这些硫酸钙不能都溶解,会沉积在石灰石的表面,从而将硫酸与石灰石隔绝开来,使得反应停止。
四、方法归纳
酸碱盐的鉴别规律
物质的鉴别通常是利用所鉴别物质的性质差异来寻找合适的方法加以区分,酸碱盐的鉴别题也是如此,也有一定规律可循,现归纳如下:
(1)三种溶液加一种试剂鉴别。
①三种溶液恰好为酸性、中性、碱性一次性鉴别可用
紫色石蕊试液或pH试纸。而如果使用无色酚酞试液鉴
别,则必须进一步利用组内物质相互反应进行鉴别。
②加试剂,产生气体、沉淀和无现象。
酸性 中性 碱性
石蕊 红 紫 蓝
pH试纸 pH<7 pH=7 pH>7
四、方法归纳
酸碱盐的鉴别规律
(2)不加试剂。
①从溶液颜色入手,依次鉴别;②利用组内溶液两两混合鉴别。
(3)只用水就可以鉴别的物质。
只用水鉴别的物质一般分以下三种情况:
①可溶于水和不溶于水的物质。如鉴别碳酸钙和碳酸钠两种白色固体。碳酸钙不溶于水,而碳酸钠溶于水。
②溶于水后是否会变色的物质。如鉴别白色的无水硫酸铜和碳酸钠。白色的无水硫酸铜遇水变蓝,碳酸钠溶于水为无色。
③溶于水后是否有温度改变的物质。如鉴别硝酸铵、氢氧化钠和氯化钠。硝酸铵溶于水后会降温,固体氢氧化钠溶于水后会升温,氯化钠溶于水后温度不变。
实验演练
典型例题1:
【典例1】某化学兴趣小组为探究盐酸的化学
性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A中观察到紫色石蕊试液变 色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了 (填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式 。
(3)试管C中发生反应的化学方程式是 。
(4)试管D中加稀盐酸至过量,始终没有明显现象。请你设计实验方案证明试管D中的NaOH与HCl发生了反应, (写出操作及其现象)。
红
FeCl3
Fe+2HCl=FeCl2+H2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
向氢氧化钠溶液中滴入几滴酚酞试液,再逐滴加入稀盐酸;溶液由红色变为无色
实验演练
典型例题2:
下列图像与对应的实验操作相符合的是( )
A.图甲一定量NaOH固体投入到蒸馏水中
B.图乙一定量NaOH溶液加水稀释
C.图丙一定量NaOH溶液中滴加稀盐酸
D.图丁一定量NaOH溶液中滴加硫酸铜溶液
A
课堂达标
(二)药理作用
1. “酸”对我们来说一定不陌生。下列说法正确的是( )
A.稀盐酸不能用于除铁锈
B.浓硫酸具有腐蚀性
C.浓盐酸没有挥发性
D.稀盐酸能使无色酚酞溶液变红
B
课堂达标
(二)药理作用
2.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )
A.① B.②
C.③ D.④
C
课堂达标
(二)药理作用
3.物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )
A.稀盐酸中含有氢离子-具有酸性-检验溶液中是否含有银离子
B.稀盐酸中含有氯离子-具有酸性-检验溶液中是否含有银离子
C.氢氧化钠溶液中含有钠离子-具有碱性-吸收二氧化硫气体
D.氢氧化钠溶液中含有氢氧根离子-具有碱性-吸收二氧化硫气体
D
课堂达标
(二)药理作用
4.从不同的角度认识NaOH+HCl═NaCl+H2O,下列选项正确的是( )
A.基本反应类型:该反应为中和反应
B.反应实质:氢离子与氧氧根离子结合生成水
C.反应物:氢氧化钠可以用来治疗胃酸过多
D.读法:氢氧化钠加氯化氢完全反应生成氯化钠加水
B
课堂达标
(二)药理作用
5.氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不正确的是( )
A.盐酸中存在的微粒有水分子和氯化氢分子
B.该反应的微观实质是H+和OH﹣结合生成水分子
C.Na+和Cl﹣在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
课堂达标
6.如图甲所示装置,同学们借助传感器监测溶液pH和温度的变化情况来探究稀盐酸和氢氧化钠溶液的反应,图乙为反应过程中溶液的pH变化曲线,图丙为反应过程中溶液温度的变化曲线,则下列说法正确的是( )
A.该反应属于化合反应
B.由图丙可知该反应为吸热反应
C.图乙曲线的c点表示该反应恰好完全反应
D.图乙曲线的d点溶液中溶质为NaCl
C
课堂达标
(二)药理作用
7.东营某化工厂产生的污水pH=2,主要污染物是硫酸。现要将污水调节至接近中性,达标后再排放,下列说法不正确的是( )
A.检测:用pH试纸或pH计检测污水的酸碱度
B.原理:处理酸性污水的实质是消耗污水中的氢离子C.验证:取水样,加入少量氯化钡溶液后出现白色沉淀,证明处理未达标
D.应用:可与造纸厂排放的碱性污水混合,达标后再排放
C
课堂小结
(二)药理作用
8.化学精灵提供的实验仪器和药品还有很多。某同学在做“稀盐酸中和氢氧化钠溶液”的实验时,发现向烧杯中滴加稀盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度,他赶紧补滴酚酞溶液,发现溶液仍然为无色。于是他和同学们一起对烧杯内溶液的溶质成分进行探究。
【提出问题】该烧杯内溶液的溶质除酚酞外还有什么?
【提出猜想】猜想一:只有NaCl;
猜想二:有 (填化学式);
猜想三:有NaCl和NaOH。
【分析与思考】根据已有的实验现象,小爱认为其中猜想 肯定不正确。
【进行实验】为进一步确认溶液的溶质成分,小荷进行了如下实验:取样,加入适量的碳酸钠溶液,观察到 。
【得出结论】上述现象说明猜想二正确。
【反思与交流】小平认为,另选与小荷实验中不同类别的物质,如 (填一种物质名称即可),也能得到上述相同的结论。
NaCl和HCl
三
锌
有气泡产生
课堂小结
(二)药理作用
9.兴趣小组用稀盐酸清洗铁夹表面的铁锈(主要成分为氧化铁),并进行保护实验。
(1)除铁锈的反应属于 (填基本反应类型)。
(2)铁夹在稀盐酸中浸泡较长时间,有气体产生。产生气体的化学方程式为 。
(3)将清洗过的铁夹进行“发蓝”处理,形成致密的氧化物保护膜,其主要成分与铁在氧气中燃烧的产物相同,该氧化物的化学式为 。
(4)验证废液显酸性,可选用的一种试剂或用品是 。
(5)用氢氧化钠中和废液中的盐酸,反应的化学方程式为
。
复分解反应
Fe+2HCl═FeCl2+H2↑
Fe3O4
pH试纸或紫色石蕊溶液等
HCl+NaOH═NaCl+H2O
课堂小结
(二)药理作用
10.常温下,向盛有100gKOH溶液的烧杯逐滴加入溶质的质量分数为7.3%的稀盐酸,滴加过程中溶液pH变化如图所示。(说明:KCl溶液呈中性)
(1)恰好完全反应时,所加稀
盐酸的质量为 g。
(2)该KOH溶液中溶质的质量分
数是多少?(答案精确到0.1%)
课堂小结
(二)药理作用
解:(1)当盐酸的质量为50g时,此时溶液的pH=7,说明此时盐酸与氢氧化钾恰好完全反应;
(2)消耗的稀盐酸的质量为50g×7.3%=3.65g
设氢氧化钾的质量为x
KOH + HCl = KCl + H2O
56 36.5
x 3.65g
56/36.5=x/3.65g
x=5.6g
答:KOH溶液中溶质的质量分数是 5.6g/100g×100%=5.6%。
谢谢观看
THANKS
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
