2015年12月海南省海口实验中学人教版高中化学必修2第二章第三节化学反应的速率和限度课件
文档属性
| 名称 | 2015年12月海南省海口实验中学人教版高中化学必修2第二章第三节化学反应的速率和限度课件 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-12 00:00:00 | ||
图片预览









文档简介
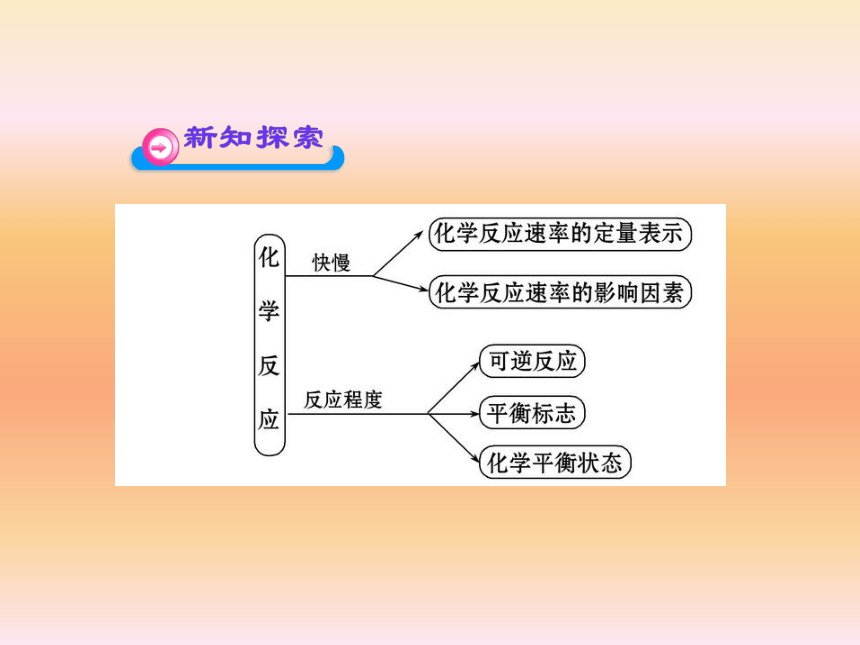
课件55张PPT。1.在“锌和稀盐酸制氢气”的化学反应中,能否用锌的浓度变化来表示化学反应速率?
提示:不能。锌为固体,固体的浓度在反应过程中保持不变,不能用它的变化来表示化学反应速率。
2.在“钠和水”的化学反应中,能否用水的浓度变化来表示化学反应速率?
提示:不能。纯液体的浓度在反应过程中保持不变,不能用纯液体的浓度变化来表示化学反应速率。3.在同一个化学反应中,反应速率既可以用反应物浓度的减少来表示,也可以用生成物浓度的增加来表示。请以N2+3H2
2NH3为例,探究同一反应中,用不同物质的浓度变化来
表示的反应速率数值是否相同?其大小有什么关系?
(1)在2 L容积不变的容器中,发生 N2+3H2 2NH3的反应。现通入0.8 mol H2和0.4 mol N2,2 min后生成了
0.12 mol NH3,求v(N2)、v(H2)、v(NH3)。提示: N2 + 3H2 2NH3
初始(mol) 0.4 0.8 0
反应(mol) 0.06 0.18 0.12
v(N2) =0.06 mol÷2 L÷2 min=0.015 mol/(L·min);
v(H2) =0.18 mol÷2 L÷2 min=0.045 mol/(L·min);
v(NH3)= 0.12 mol÷2 L÷2 min=0.03 mol/(L·min)。(2)计算v(N2)、v(H2)、v(NH3)的比值。
提示:v(N2)∶v(H2)∶v(NH3)=0.015 mol/(L·min)∶
0.045 mol/(L·min)∶0.03 mol/(L·min)=1∶3∶2。
(3)由此可以得到什么结论?
提示:同一反应中,用不同物质的浓度变化来表示的反应速率数值不相同,其速率之比等于反应方程式中相应物质的化学计量数之比,即:对于反应aA+bB====cC+dD,有v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。4.探究除温度、压强、催化剂外,影响反应速率的因素。
(1)实验时通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应,原因是什么?
提示:固体药品研得越细,其表面积越大,混匀后反应物之间接触的面积也越大,反应更加迅速、充分。
(2)实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应,原因是什么?
提示:一些固体物质溶于水后,发生了电解质的电离,离子在溶液里受水分子作用而运动,增大了离子之间接触的机会,从而提高了化学反应速率。(3)实验室常用约30%左右的硫酸(约3.7 mol/L)与锌粒反应制取H2,当反应一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来,原因是什么?
提示:Zn+H2SO4====ZnSO4+H2↑,离子方程式为:Zn+2H+====Zn2+ + H2↑。c(H+)的大小影响着该反应的反应速率。气泡变稀少了,是因为c(H+)减小了,反应速率减慢。如果添加适当浓度的硫酸溶液,由于溶液中c(H+)又迅速增大,使反应物之间的接触机会增大,因而反应速率加快,产生气泡的速率又加快了。(4)根据以上分析,试总结出影响反应速率的因素。
提示:从上面的事例可以看出,固体的表面积、反应物的状态、溶液的浓度都可以影响化学反应速率。例1 分析下列实例,根据已有的知识和经验,填写下表。【规范解答】本题考查外界条件对化学反应速率的影响,可以分别从温度、浓度、固体表面积、催化剂、压强等方面进行分析。答案: 【互动探究】块状的碳酸钙与盐酸反应时,如果增加碳酸钙用量,能否加快反应速率?
提示:不能。因为碳酸钙为固体,其浓度不变,增加碳酸钙用量,也不能加快反应速率。1.化学反应速率是用物质浓度的变化来表示的,由于固体或纯液体的浓度为常数,因此不能用固体或纯液体来表示化学反应速率。
2.在同一个反应中可以用不同物质的浓度的变化表示化学反应速率。
3.影响化学反应速率的最主要因素是内因,即反应物本身的化学性质。
4.利用表达式所求速率为平均速率,不是瞬时速率。1.已知:2H2+O2 2H2O 2H2O 2H2↑+O2↑以上反应是可逆反应吗?
提示:不是可逆反应。可逆反应是在相同条件下同时发生,上述两反应发生所需的条件不同,也不是同时发生的。2.已知2SO2+O2 2SO3为可逆反应,把2 mol SO2和
1 mol O2充入密闭容器中反应,最终可能生成2 mol SO3吗?
提示:不可能。该反应是可逆反应,当反应进行到一定限度后反应物就不再减少,生成物也不再增多,即可逆反应不能进行到底。3.试讨论:在化学平衡状态,是否v(正)=v(逆)=0?
提示:不是。达到化学平衡时反应并未停止,仍在进行,只不过单位时间内某物质消耗量和生成量相等。是一种动态平衡,即v(正)=v(逆)≠0。
4.化学平衡状态时为什么反应体系中各成分的含量保持恒定?
提示:化学平衡的实质是反应的正、逆反应速率相等,即单位时间内,各物质的消耗量与生成量相等,所以达到平衡时,各成分的含量不再发生变化。5.在研究化学平衡时为什么强调一定条件下?
提示:化学平衡是相对平衡,在一定条件下达到化学平衡状态后,若改变反应条件,化学平衡就可能要被破坏。例2 (双选)在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)
达到平衡的标志是
A.Z生成的速率与Z分解的速率相等
B.单位时间内生成n mol X,同时生成3n mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1∶3∶2【规范解答】选A、C。由化学平衡状态的定义可知达到平衡状态的根本标志有两个:一是正反应速率等于逆反应速率,二是各组分的浓度不再变化。故A、C是正确的。而B只表示出了逆反应速率,无法确定正逆反应速率是否相等,故B项错误;化学平衡状态时,三种分子数之比与方程式中的化学计量数比没有必然的联系,它们可能相等,也可能不相等,所以分子数之比不能作为判据,故D项错误。 【互动探究】如果单位时间内生成n mol X,同时消耗3n mol Y,能否判断该反应达到平衡状态?
提示:能。单位时间内生成n mol X,必定同时生成3n mol Y,而同时又消耗3n mol Y,说明Y既没增多,也没减少,所以是平衡状态。1.可逆反应
在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应。这一类反应都有一定的限度。2.化学平衡状态的特征
可以用5个字概括:逆、等、动、定、变。1.煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
提示:煤被研磨得越细,粉末越小,与空气中O2的接触面积越大。燃烧越充分,反应速率越快。
2.空气用量对煤的充分燃烧有什么影响?为什么?
提示:空气越充足,煤燃烧生成CO2越充分,放热越多;若空气不足,则煤燃烧部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减少。3.应选择什么样的炉(灶)膛材料?理由是什么?
提示:应选择保温、耐热、隔热的炉(灶)膛材料。虽然燃烧是放热反应,但反应过程中燃烧需提供部分热量来维持反应的继续进行,选用保温、隔热材料的目的是为了防止热量散失。
4.如何充分利用煤燃烧后废气中的热量?
提示:将燃烧后的废气通过交换装置供其他方面使用,充分利用反应产生的热量。例3 下列措施可以提高燃料燃烧效率的是
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理
④通入足量的空气
A.①③ B.①②③ C.①③④ D.①②③④
【规范解答】选D。固体燃料粉碎、液体燃料雾化、煤经气化处理均是为了增大与空气或氧气的接触面积;足量的空气也是保证燃料充分燃烧的必要条件之一,故选D。 【互动探究】燃烧时是否通入的空气越多越有利于可燃物燃烧?
提示:不是。空气过多时会使部分热量散失,对燃烧不利。1.控制反应条件的目的有两方面:一是控制反应速率;二是控制反应的限度。
2.提高燃烧效率的目的有两方面:一是提高能量转化率;二是提高能量利用率。一、化学反应速率的大小比较
化学反应有快有慢。化学反应速率是表示化学反应快慢的物理量,通常用单位时间内反应物浓度的减小量或生成物浓度的增大量来表示。
探究:
1.已知2A(g)+3B(g)====2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5 mol·L-1·min-1
②v(B)=0.6 mol·L-1·min-1
③v(C)=0.35 mol·L-1·min-1
④v(D)=0.4 mol·L-1·min-1
哪一个表示的化学反应速率最快?提示:同一反应的反应速率,可以用不同的反应物或生成物表示,不同物质表示的化学反应速率的数值之比等于化学方程式中各物质的化学计量数之比。所以,可以将以上四种表示化为用同一种物质表示,并且单位相同,数值大的化学反应速率最大,④最快。2.在甲乙两个不同容器中充入等量的反应物,分别进行X(g)+3Y(g) 2Z(g)的反应,5 min后测定,甲中生成了4mol Z,乙中生成了2 mol Z。能否判断甲中反应速率比乙中快?
提示:不能。因为化学反应速率是用单位时间内反应物或生成物的浓度变化量表示的,单位时间内物质的量变化大,浓度不一定变化大。二、判断可逆反应是否达到平衡状态的方法
可逆反应是否达到化学平衡状态,一个标志是正逆反应的速率
是否相等,另一个是各反应物或生成物的含量是否保持不变。
若在容积不变密闭容器中,发生合成氨反应:N2+3H2
2NH3。
探究:
1.若在相同时间内消耗a mol N2同时生成2a mol NH3,是否达到了化学平衡状态?
提示:不能判定是否达到平衡状态。因为消耗N2和生成NH3都是正反应,不能说明正逆反应速率相等。2.当N2的浓度不随时间变化而变化时,能否说明已经达到化学平衡状态?
提示:能。N2的浓度不再变化时,其他反应物或生成物的浓度也不再变化。
3.若一个N≡N 键断裂的同时,6个N—H键断裂,能否说明已经达到化学平衡状态?
提示:能。一个NH3中有三个N—H键。由方程式可知“一个 N≡N”对应“6个 N—H 键”, N—H 键断裂表示逆反应速率,N≡N 键断裂表示正反应速率。4.若2v正(H2)=3v逆(NH3),能否说明已经达到化学平衡状态?
提示:能。用不同物质的速率表示平衡要符合两个要点:速率之比等于化学计量数之比,且要体现正逆两个方向。
5.若c(NH3)=2c(N2),能否说明已经达到化学平衡状态?
提示:不能。因为浓度不变并不是说浓度比等于反应化学计量数比,该关系不能说明浓度不再变化。6.若容器内密度不再变化,能否说明已经达到化学平衡状态?
提示:不能。反应容器体积不变,容器内气体总质量不变(遵循质量守恒),所以达到平衡之前容器内的密度也是定值。不能说明是否平衡。1.(2011·德州高一检测)下列过程中需要减慢化学反应速率的是( )
A.炼铁 B.炼钢
C.合成纤维 D.食物腐败
【解析】选D。对人类有害的反应才应使其减慢。2.不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是( )
A.温度 B.浓度
C.催化剂 D.反应物的性质
【解析】选D。温度、浓度、催化剂等,都是影响速率大小的外界因素;决定化学反应速率的主要因素是反应物本身的性质。3.对于化学反应3W(g)+2X(g)====4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
【解析】选C。对于任一化学反应,用不同的物质表示该反应的速率,其数值之比等于其化学计量数之比,v(W)∶v(X)∶
v(Y)∶v(Z)=3∶2∶4∶3。v(W)=v(Z),A错;3v(X)=2v(Z),
B错;2v(X)=v(Y),C正确;2v(W)=3v(X),D错。4.反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容
器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,
则此反应的平均速率可表示为( )
A.v(NH3)=0.010 mol·L-1·s-1
B.v(O2)=0.001 0 mol·L-1·s-1
C.v(NO)=0.001 0 mol·L-1·s-1
D.v(H2O)=0.045 mol·L-1·s-1【解析】选C。
v(H2O)= =0.001 5 mol·L-1·s-1
v(NH3)= =0.001 0 mol·L-1·s-1
v(O2)= =0.001 25 mol·L-1·s-1
v(NO)= =0.001 0 mol·L-1·s-15.(2011·郴州高一检测)能够说明可逆反应H2(g)+I2(g)
2HI(g)已达平衡状态的是( )
A.一个H—H键形成的同时有一个H—I键形成
B.一个I—I键断裂的同时有两个H—I键形成
C.一个H—H键断裂的同时有一个H—H键形成
D.一个H—H键断裂的同时有两个H—I键形成
【解析】选C。用不同物质的反应速率判断化学平衡状态时,必须满足“双向,成比例”。A中,v逆(H2)∶v正(HI)=1∶1,不满足反应速率比是方程式中化学计量数之比;B、D均只表示了正反应速率;C中v正(H2)=v逆(H2),符合化学平衡状态的特征。6.把除去氧化膜的镁条投入到盛有少量稀
盐酸的试管中,发现氢气产生的速率变化
情况如图所示。其中t1~t2速率变化的主
要原因是___________________________,
t2~t3速率变化的主要原因是_________。【解析】镁与盐酸反应是放热反应,该反应中并存两个影响化学反应速率的外因:一是反应放出的热量使反应体系温度升高,化学反应速率增大;二是反应过程中盐酸的浓度不断减小,使化学反应速率减小。由图像可知,在t1~t2时间段,温度变化是影响化学反应速率的主要因素,在t2~t3时间段,盐酸的浓度变化是影响化学反应速率的主要因素。
答案:镁与盐酸反应是放热反应,放出的热量使反应体系温度升高,化学反应速率增大
反应过程中盐酸的浓度不断减小,使化学反应速率减小Thank you!
提示:不能。锌为固体,固体的浓度在反应过程中保持不变,不能用它的变化来表示化学反应速率。
2.在“钠和水”的化学反应中,能否用水的浓度变化来表示化学反应速率?
提示:不能。纯液体的浓度在反应过程中保持不变,不能用纯液体的浓度变化来表示化学反应速率。3.在同一个化学反应中,反应速率既可以用反应物浓度的减少来表示,也可以用生成物浓度的增加来表示。请以N2+3H2
2NH3为例,探究同一反应中,用不同物质的浓度变化来
表示的反应速率数值是否相同?其大小有什么关系?
(1)在2 L容积不变的容器中,发生 N2+3H2 2NH3的反应。现通入0.8 mol H2和0.4 mol N2,2 min后生成了
0.12 mol NH3,求v(N2)、v(H2)、v(NH3)。提示: N2 + 3H2 2NH3
初始(mol) 0.4 0.8 0
反应(mol) 0.06 0.18 0.12
v(N2) =0.06 mol÷2 L÷2 min=0.015 mol/(L·min);
v(H2) =0.18 mol÷2 L÷2 min=0.045 mol/(L·min);
v(NH3)= 0.12 mol÷2 L÷2 min=0.03 mol/(L·min)。(2)计算v(N2)、v(H2)、v(NH3)的比值。
提示:v(N2)∶v(H2)∶v(NH3)=0.015 mol/(L·min)∶
0.045 mol/(L·min)∶0.03 mol/(L·min)=1∶3∶2。
(3)由此可以得到什么结论?
提示:同一反应中,用不同物质的浓度变化来表示的反应速率数值不相同,其速率之比等于反应方程式中相应物质的化学计量数之比,即:对于反应aA+bB====cC+dD,有v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。4.探究除温度、压强、催化剂外,影响反应速率的因素。
(1)实验时通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应,原因是什么?
提示:固体药品研得越细,其表面积越大,混匀后反应物之间接触的面积也越大,反应更加迅速、充分。
(2)实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应,原因是什么?
提示:一些固体物质溶于水后,发生了电解质的电离,离子在溶液里受水分子作用而运动,增大了离子之间接触的机会,从而提高了化学反应速率。(3)实验室常用约30%左右的硫酸(约3.7 mol/L)与锌粒反应制取H2,当反应一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来,原因是什么?
提示:Zn+H2SO4====ZnSO4+H2↑,离子方程式为:Zn+2H+====Zn2+ + H2↑。c(H+)的大小影响着该反应的反应速率。气泡变稀少了,是因为c(H+)减小了,反应速率减慢。如果添加适当浓度的硫酸溶液,由于溶液中c(H+)又迅速增大,使反应物之间的接触机会增大,因而反应速率加快,产生气泡的速率又加快了。(4)根据以上分析,试总结出影响反应速率的因素。
提示:从上面的事例可以看出,固体的表面积、反应物的状态、溶液的浓度都可以影响化学反应速率。例1 分析下列实例,根据已有的知识和经验,填写下表。【规范解答】本题考查外界条件对化学反应速率的影响,可以分别从温度、浓度、固体表面积、催化剂、压强等方面进行分析。答案: 【互动探究】块状的碳酸钙与盐酸反应时,如果增加碳酸钙用量,能否加快反应速率?
提示:不能。因为碳酸钙为固体,其浓度不变,增加碳酸钙用量,也不能加快反应速率。1.化学反应速率是用物质浓度的变化来表示的,由于固体或纯液体的浓度为常数,因此不能用固体或纯液体来表示化学反应速率。
2.在同一个反应中可以用不同物质的浓度的变化表示化学反应速率。
3.影响化学反应速率的最主要因素是内因,即反应物本身的化学性质。
4.利用表达式所求速率为平均速率,不是瞬时速率。1.已知:2H2+O2 2H2O 2H2O 2H2↑+O2↑以上反应是可逆反应吗?
提示:不是可逆反应。可逆反应是在相同条件下同时发生,上述两反应发生所需的条件不同,也不是同时发生的。2.已知2SO2+O2 2SO3为可逆反应,把2 mol SO2和
1 mol O2充入密闭容器中反应,最终可能生成2 mol SO3吗?
提示:不可能。该反应是可逆反应,当反应进行到一定限度后反应物就不再减少,生成物也不再增多,即可逆反应不能进行到底。3.试讨论:在化学平衡状态,是否v(正)=v(逆)=0?
提示:不是。达到化学平衡时反应并未停止,仍在进行,只不过单位时间内某物质消耗量和生成量相等。是一种动态平衡,即v(正)=v(逆)≠0。
4.化学平衡状态时为什么反应体系中各成分的含量保持恒定?
提示:化学平衡的实质是反应的正、逆反应速率相等,即单位时间内,各物质的消耗量与生成量相等,所以达到平衡时,各成分的含量不再发生变化。5.在研究化学平衡时为什么强调一定条件下?
提示:化学平衡是相对平衡,在一定条件下达到化学平衡状态后,若改变反应条件,化学平衡就可能要被破坏。例2 (双选)在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)
达到平衡的标志是
A.Z生成的速率与Z分解的速率相等
B.单位时间内生成n mol X,同时生成3n mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1∶3∶2【规范解答】选A、C。由化学平衡状态的定义可知达到平衡状态的根本标志有两个:一是正反应速率等于逆反应速率,二是各组分的浓度不再变化。故A、C是正确的。而B只表示出了逆反应速率,无法确定正逆反应速率是否相等,故B项错误;化学平衡状态时,三种分子数之比与方程式中的化学计量数比没有必然的联系,它们可能相等,也可能不相等,所以分子数之比不能作为判据,故D项错误。 【互动探究】如果单位时间内生成n mol X,同时消耗3n mol Y,能否判断该反应达到平衡状态?
提示:能。单位时间内生成n mol X,必定同时生成3n mol Y,而同时又消耗3n mol Y,说明Y既没增多,也没减少,所以是平衡状态。1.可逆反应
在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应。这一类反应都有一定的限度。2.化学平衡状态的特征
可以用5个字概括:逆、等、动、定、变。1.煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
提示:煤被研磨得越细,粉末越小,与空气中O2的接触面积越大。燃烧越充分,反应速率越快。
2.空气用量对煤的充分燃烧有什么影响?为什么?
提示:空气越充足,煤燃烧生成CO2越充分,放热越多;若空气不足,则煤燃烧部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减少。3.应选择什么样的炉(灶)膛材料?理由是什么?
提示:应选择保温、耐热、隔热的炉(灶)膛材料。虽然燃烧是放热反应,但反应过程中燃烧需提供部分热量来维持反应的继续进行,选用保温、隔热材料的目的是为了防止热量散失。
4.如何充分利用煤燃烧后废气中的热量?
提示:将燃烧后的废气通过交换装置供其他方面使用,充分利用反应产生的热量。例3 下列措施可以提高燃料燃烧效率的是
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理
④通入足量的空气
A.①③ B.①②③ C.①③④ D.①②③④
【规范解答】选D。固体燃料粉碎、液体燃料雾化、煤经气化处理均是为了增大与空气或氧气的接触面积;足量的空气也是保证燃料充分燃烧的必要条件之一,故选D。 【互动探究】燃烧时是否通入的空气越多越有利于可燃物燃烧?
提示:不是。空气过多时会使部分热量散失,对燃烧不利。1.控制反应条件的目的有两方面:一是控制反应速率;二是控制反应的限度。
2.提高燃烧效率的目的有两方面:一是提高能量转化率;二是提高能量利用率。一、化学反应速率的大小比较
化学反应有快有慢。化学反应速率是表示化学反应快慢的物理量,通常用单位时间内反应物浓度的减小量或生成物浓度的增大量来表示。
探究:
1.已知2A(g)+3B(g)====2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5 mol·L-1·min-1
②v(B)=0.6 mol·L-1·min-1
③v(C)=0.35 mol·L-1·min-1
④v(D)=0.4 mol·L-1·min-1
哪一个表示的化学反应速率最快?提示:同一反应的反应速率,可以用不同的反应物或生成物表示,不同物质表示的化学反应速率的数值之比等于化学方程式中各物质的化学计量数之比。所以,可以将以上四种表示化为用同一种物质表示,并且单位相同,数值大的化学反应速率最大,④最快。2.在甲乙两个不同容器中充入等量的反应物,分别进行X(g)+3Y(g) 2Z(g)的反应,5 min后测定,甲中生成了4mol Z,乙中生成了2 mol Z。能否判断甲中反应速率比乙中快?
提示:不能。因为化学反应速率是用单位时间内反应物或生成物的浓度变化量表示的,单位时间内物质的量变化大,浓度不一定变化大。二、判断可逆反应是否达到平衡状态的方法
可逆反应是否达到化学平衡状态,一个标志是正逆反应的速率
是否相等,另一个是各反应物或生成物的含量是否保持不变。
若在容积不变密闭容器中,发生合成氨反应:N2+3H2
2NH3。
探究:
1.若在相同时间内消耗a mol N2同时生成2a mol NH3,是否达到了化学平衡状态?
提示:不能判定是否达到平衡状态。因为消耗N2和生成NH3都是正反应,不能说明正逆反应速率相等。2.当N2的浓度不随时间变化而变化时,能否说明已经达到化学平衡状态?
提示:能。N2的浓度不再变化时,其他反应物或生成物的浓度也不再变化。
3.若一个N≡N 键断裂的同时,6个N—H键断裂,能否说明已经达到化学平衡状态?
提示:能。一个NH3中有三个N—H键。由方程式可知“一个 N≡N”对应“6个 N—H 键”, N—H 键断裂表示逆反应速率,N≡N 键断裂表示正反应速率。4.若2v正(H2)=3v逆(NH3),能否说明已经达到化学平衡状态?
提示:能。用不同物质的速率表示平衡要符合两个要点:速率之比等于化学计量数之比,且要体现正逆两个方向。
5.若c(NH3)=2c(N2),能否说明已经达到化学平衡状态?
提示:不能。因为浓度不变并不是说浓度比等于反应化学计量数比,该关系不能说明浓度不再变化。6.若容器内密度不再变化,能否说明已经达到化学平衡状态?
提示:不能。反应容器体积不变,容器内气体总质量不变(遵循质量守恒),所以达到平衡之前容器内的密度也是定值。不能说明是否平衡。1.(2011·德州高一检测)下列过程中需要减慢化学反应速率的是( )
A.炼铁 B.炼钢
C.合成纤维 D.食物腐败
【解析】选D。对人类有害的反应才应使其减慢。2.不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是( )
A.温度 B.浓度
C.催化剂 D.反应物的性质
【解析】选D。温度、浓度、催化剂等,都是影响速率大小的外界因素;决定化学反应速率的主要因素是反应物本身的性质。3.对于化学反应3W(g)+2X(g)====4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
【解析】选C。对于任一化学反应,用不同的物质表示该反应的速率,其数值之比等于其化学计量数之比,v(W)∶v(X)∶
v(Y)∶v(Z)=3∶2∶4∶3。v(W)=v(Z),A错;3v(X)=2v(Z),
B错;2v(X)=v(Y),C正确;2v(W)=3v(X),D错。4.反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容
器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,
则此反应的平均速率可表示为( )
A.v(NH3)=0.010 mol·L-1·s-1
B.v(O2)=0.001 0 mol·L-1·s-1
C.v(NO)=0.001 0 mol·L-1·s-1
D.v(H2O)=0.045 mol·L-1·s-1【解析】选C。
v(H2O)= =0.001 5 mol·L-1·s-1
v(NH3)= =0.001 0 mol·L-1·s-1
v(O2)= =0.001 25 mol·L-1·s-1
v(NO)= =0.001 0 mol·L-1·s-15.(2011·郴州高一检测)能够说明可逆反应H2(g)+I2(g)
2HI(g)已达平衡状态的是( )
A.一个H—H键形成的同时有一个H—I键形成
B.一个I—I键断裂的同时有两个H—I键形成
C.一个H—H键断裂的同时有一个H—H键形成
D.一个H—H键断裂的同时有两个H—I键形成
【解析】选C。用不同物质的反应速率判断化学平衡状态时,必须满足“双向,成比例”。A中,v逆(H2)∶v正(HI)=1∶1,不满足反应速率比是方程式中化学计量数之比;B、D均只表示了正反应速率;C中v正(H2)=v逆(H2),符合化学平衡状态的特征。6.把除去氧化膜的镁条投入到盛有少量稀
盐酸的试管中,发现氢气产生的速率变化
情况如图所示。其中t1~t2速率变化的主
要原因是___________________________,
t2~t3速率变化的主要原因是_________。【解析】镁与盐酸反应是放热反应,该反应中并存两个影响化学反应速率的外因:一是反应放出的热量使反应体系温度升高,化学反应速率增大;二是反应过程中盐酸的浓度不断减小,使化学反应速率减小。由图像可知,在t1~t2时间段,温度变化是影响化学反应速率的主要因素,在t2~t3时间段,盐酸的浓度变化是影响化学反应速率的主要因素。
答案:镁与盐酸反应是放热反应,放出的热量使反应体系温度升高,化学反应速率增大
反应过程中盐酸的浓度不断减小,使化学反应速率减小Thank you!
