【考点突破】第一章第2课时 物质的转化(共39张PPT)-2024~2025学年高一化学同步课件(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第一章第2课时 物质的转化(共39张PPT)-2024~2025学年高一化学同步课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-01 20:29:50 | ||
图片预览





文档简介
(共39张PPT)
第一节 物质的分类与转化
第一章 物质及其变化
第2课时 物质的转化
酸、碱、盐的性质
01
物质的转化
02
课堂练习
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
酸、碱、盐的性质
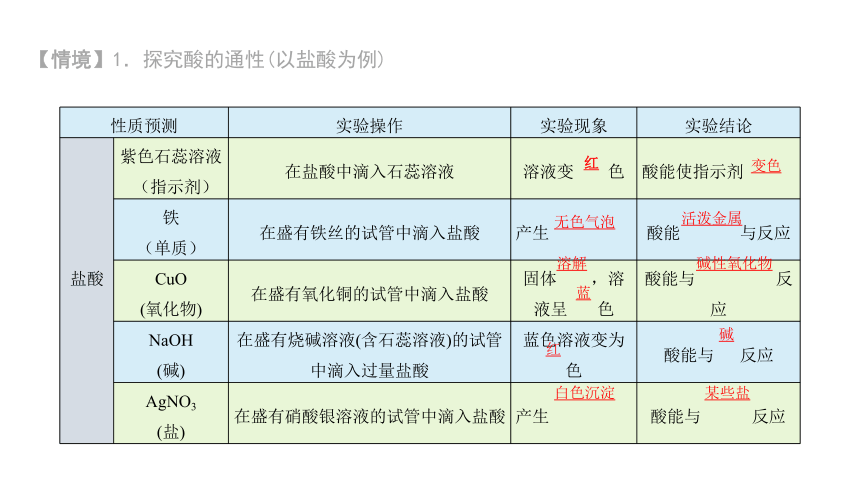
【情境】1.探究酸的通性(以盐酸为例)
性质预测 实验操作 实验现象 实验结论
盐酸 紫色石蕊溶液 (指示剂) 在盐酸中滴入石蕊溶液 溶液变 色 酸能使指示剂
铁 (单质) 在盛有铁丝的试管中滴入盐酸 产生 酸能 与反应
CuO (氧化物) 在盛有氧化铜的试管中滴入盐酸 固体 ,溶液呈 色 酸能与 反应
NaOH (碱) 在盛有烧碱溶液(含石蕊溶液)的试管中滴入过量盐酸 蓝色溶液变为色 酸能与 反应
AgNO3 (盐) 在盛有硝酸银溶液的试管中滴入盐酸 产生 酸能与 反应
红
变色
无色气泡
活泼金属
溶解
蓝
碱性氧化物
红
碱
白色沉淀
某些盐
(1)为什么不同的酸具有相似的化学性质?
【解析】不同的碱在组成上相似,从微观视角来看,不同碱溶液中都含有OH-,从而决定了不同碱的化学性质相似。
写出盐酸分别与上述物质反应的化学方程式,并注明反应类型。
(1)铁: ; 反应。
(2)氧化铜: ; 反应。
(3)烧碱: ; 反应。
(4)硝酸银: ; 反应。
【问题探究】
Fe+2HCl===FeCl2+H2↑
置换
CuO+2HCl===CuCl2+H2O
复分解
NaOH+HCl===NaCl+H2O
复分解
AgNO3+HCl===AgCl↓+HNO3
复分解
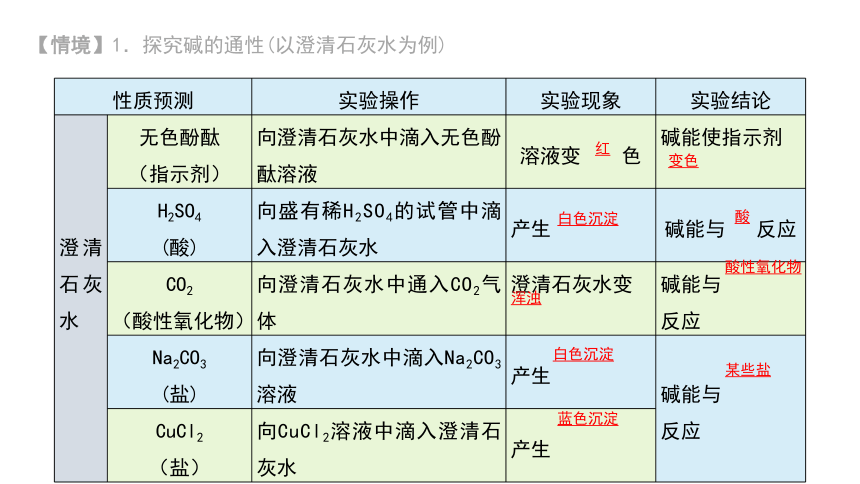
【情境】1.探究碱的通性(以澄清石灰水为例)
性质预测 实验操作 实验现象 实验结论
澄清石灰水 无色酚酞 (指示剂) 向澄清石灰水中滴入无色酚酞溶液 溶液变 色 碱能使指示剂
H2SO4 (酸) 向盛有稀H2SO4的试管中滴入澄清石灰水 产生 碱能与 反应
CO2 (酸性氧化物) 向澄清石灰水中通入CO2气体 澄清石灰水变 碱能与
反应
Na2CO3 (盐) 向澄清石灰水中滴入Na2CO3溶液 产生 碱能与
反应
CuCl2 (盐) 向CuCl2溶液中滴入澄清石灰水 产生 红
变色
白色沉淀
酸
浑浊
酸性氧化物
白色沉淀
某些盐
蓝色沉淀
(1)为什么不同的碱具有相似的化学性质?
【解析】不同的碱在组成上相似,从微观视角来看,不同碱溶液中都含有OH-,从而决定了不同碱的化学性质相似。
【问题探究】
写出澄清石灰水分别与上述物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ; 反应。
(2)CO2: ; 反应。
(3)Na2CO3: ; 反应。
(4)CuCl2: ; 反应。
Ca(OH)2+H2SO4===CaSO4↓+2H2O
复分解
CO2+Ca(OH)2===CaCO3↓+H2O
复分解
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
复分解
CuCl2+Ca(OH)2===CaCl2+Cu(OH)2↓
复分解
【情境】1.探究盐的通性(以Na2CO3溶液为例)
性质预测 实验操作 实验现象 实验结论
Na2CO3 溶液 稀硫酸 (酸) 向盛有稀硫酸的试管中滴加Na2CO3溶液 产生大量 某些盐能与 反应
Ba(OH)2 (碱) 向Na2CO3溶液中滴加Ba(OH)2溶液 产生 某些盐能与 反应
氯化钙 (盐) 向Na2CO3溶液中滴加CaCl2溶液 产生 盐能与
反应
写出Na2CO3溶液分别与上述物质反应的化学方程式,并注明反应类型。
(1)H2SO4:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑; 反应。
(2)Ba(OH)2:Na2CO3+Ba(OH)2===BaCO3↓+2NaOH; 反应。
(3)CaCl2:Na2CO3+CaCl2===CaCO3↓+2NaCl; 反应。
无色气泡
酸
白色沉淀
碱
白色沉淀
某些盐
复分解
复分解
复分解
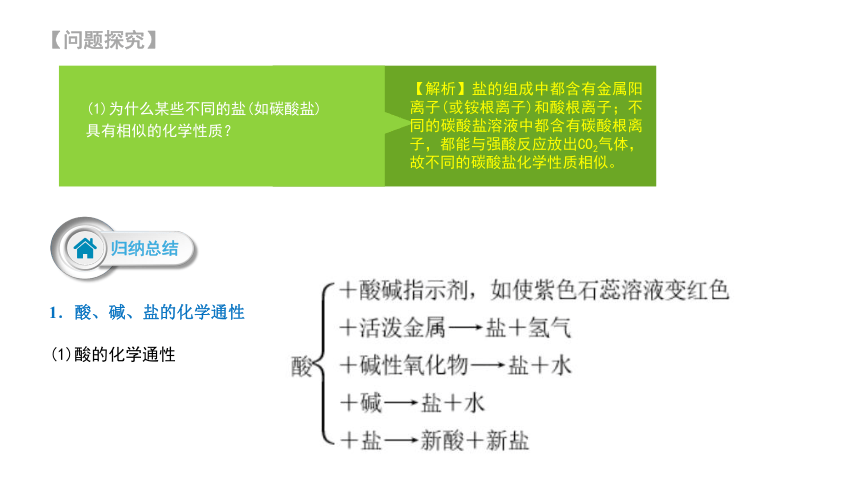
(1)为什么某些不同的盐(如碳酸盐)具有相似的化学性质?
【解析】盐的组成中都含有金属阳离子(或铵根离子)和酸根离子;不同的碳酸盐溶液中都含有碳酸根离子,都能与强酸反应放出CO2气体,故不同的碳酸盐化学性质相似。
【问题探究】
归纳总结
1.酸、碱、盐的化学通性
(1)酸的化学通性
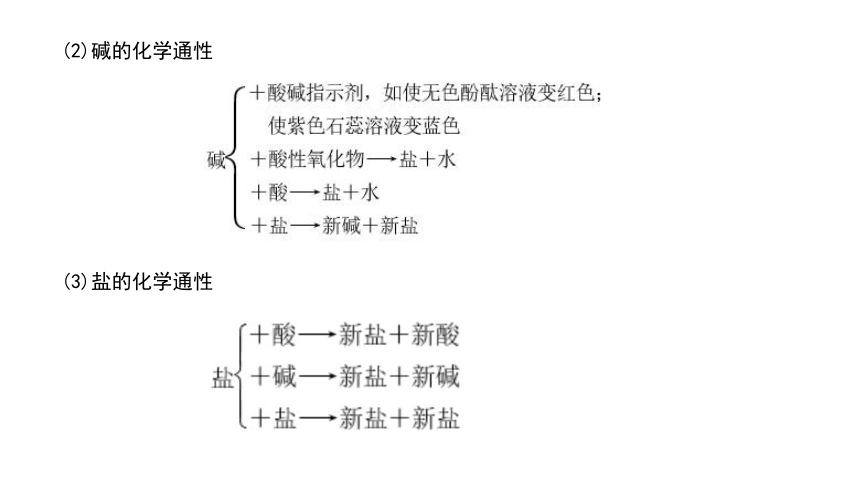
(2)碱的化学通性
(3)盐的化学通性
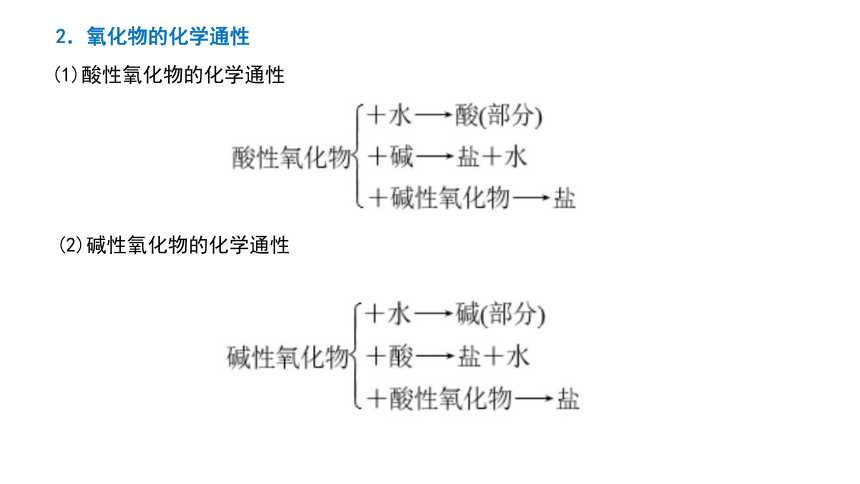
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
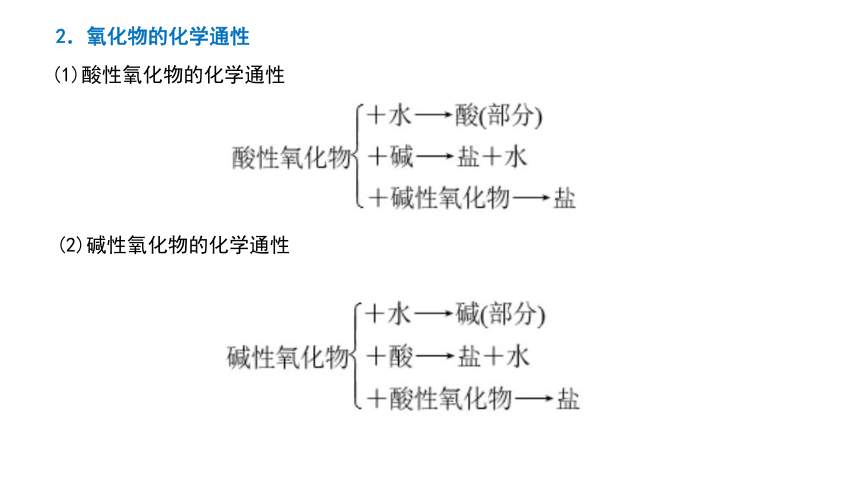
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
分散系及其分类
易错点
课堂练习
(1)能溶于水的含氧酸,对应的酸性氧化物一般能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O===H2SO4。
(2)能溶于水的碱(NH3·H2O除外),对应的碱性氧化物一般能与H2O反应生成相应的碱,如NaOH:Na2O+H2O===2NaOH。
(3)有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱反应、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
1.盐是一类常见的物质,下列物质通过一步反应可直接形成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③⑥ B.①④⑤⑥ C.②③⑤⑥ D.全部
【答案】D
【解析】①金属单质与非金属单质可生成盐,如Na与Cl2反应可生成氯化钠,①符合题意;②碱性氧化物与酸性氧化物、酸都可能生成盐,如Na2O与CO2反应生成碳酸钠,氧化钠与盐酸反应生成氯化钠,②符合题意;③碱和酸发生中和反应生成盐和水,③符合题意;④酸性氧化物与碱性氧化物、碱、某些盐反应都可能生成盐,如二氧化碳与氧化钠、氢氧化钠、碳酸钠溶液都能反应生成盐,④符合题意;⑤酸与金属、碱性氧化物、碱、某些盐反应,都可能生成盐,如盐酸与钠、氧化钠、氢氧化钠、碳酸钠都能反应生成盐,⑤符合题意;⑥酸与碱反应可以生成盐,如盐酸与氢氧化钠反应生成氯化钠,⑥符合题意;综合以上分析,①②③④⑤⑥都可通过一步反应生成盐,故选D。
2.下列四组实验中,不能体现酸的通性的是( )
解析:选C 盐酸与BaCl2溶液不反应,稀H2SO4与BaCl2溶液反应生成BaSO4沉淀,与酸的通性无关。
3.如图是小红学习“常见的碱”课题后,总结出的氢氧化钙的化学性质。下列说法不正确的是( )
A.①中的酚酞溶液变红
B.②中与盐酸反应的化学方程式为
Ca(OH)2+2HCl=CaCl2+2H2O
C.③中与硝酸钠溶液能发生反应
D.④可解释久置的澄清石灰水变质
【答案】C
【解析】A.①中Ca(OH)2能使酚酞溶液变红,A正确;
B.②中Ca(OH)2与HCl反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O,B正确;
C.③中NaNO3溶液与Ca(OH)2不反应,C错误;
D.④中久置的澄清石灰水变质的原因是Ca(OH)2+CO2=CaCO3↓+H2O,D正确;
故答案选C。
4.碳元素能形成多种氧化物,如CO、 CO2、C2O、C2O3,其中C2O、C2O3能燃烧生成CO2 ;C2O3能与H2O反应生成二元酸(H2C2O4),下列反应的化学方程式肯定错误的是
A.H2C2O4+Zn=ZnC2O4+H2↑
B.C2O3+CaO=CaC2O4
C.2C2O+3O2= 4CO2
D.C2O3+2NaOH=Na2CO3+H2O
【答案】D
【解析】A.由题干信息中H2C2O4是二元酸,可知其会与锌发生置换反应生成氢气,A正确;
B.由C2O3能与水反应生成二元酸及CO2的性质类推,可知C2O3能与CaO反应生成盐CaC2O4,B正确;
C.由题可知,C2O、C2O3能燃烧生成CO2,C正确;
D.C2O3能与H2O反应生成二元酸(H2C2O4),氧化物与碱的反应中,碳元素的化合价不变,故和氢氧化钠反应的生成物应为Na2C2O4,D错误;
答案D。
EPB
考点突破
02
物质的转化
【情境】纸是中国劳动人民长期经验的积累和智慧的结晶,纸是用以书写、印刷、绘画或包装等的片状纤维制品。
中国古代常用石灰水或草木灰水为丝麻脱胶,这种技术也给造纸中为植物纤维脱胶以启示。纸张就是借助这些技术发展起来的。
【问题探究】
(1)熟石灰、石灰石、生石灰都含有相同的元素,你能分别写出它们的主要成分的化学式吗?
【解析】Ca(OH)2、CaCO3、CaO。
(2)工业以石灰石制石灰水,请写出有关的化学方程式。
【解析】
CaCO3 CaO+CO2↑、
CaO+H2O=Ca(OH)2。
(3)某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
Ⅰ.写出第③步转化的化学方程式。
Ⅱ.以石灰石为原料,请设计制备CaCO3的另一方案,并写出流程图。
归纳总结
1.单质、氧化物、酸、碱、盐之间的转化关系
(1)转化图示
分散系及其分类
易错点
①上述转化关系并非包含所有反应,如H2、CO、C还原CuO或Fe2O3,CuSO4+5H2O===CuSO4·5H2O等反应均未包含。
②上述转化关系表示的是一般的共性,但学习时还要关注特殊性。例如,金属+酸―→盐+氢气,但铜与盐酸就不反应。
③有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱反应、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
(2)转化示例:在硫酸、二氧化碳、铜片、氯化钠、生石灰、一氧化碳、纯碱、铁和木炭9种物质间存在如图所示关系,给①~⑤选择适当的物质,使连线的两种物质能发生反应。
Ⅰ.它们的化学式分别为① ;② ;③ ;④ ;⑤ 。
Ⅱ.写出下列物质之间发生反应的化学方程式。
①和②Fe+H2SO4===FeSO4+H2↑;
②和④CaO+H2SO4===CaSO4↓+H2O;
②和⑤Na2CO3+H2SO4===Na2SO4+H2O+CO2↑;
③和④CO2+CaO===CaCO3。
Fe
H2SO4
CO2
CaO
Na2CO3
2.无机基本反应类型
(1)化合反应:A+B+……―→C;
(2)分解反应:A―→B+C+……;
(3)置换反应:A+BC―→AC+B;
(4)复分解反应:AB+CD―→AD+CB。
易错点
①常见的置换反应有a.金属与酸、盐的置换反应;b.H2还原某些金属氧化物(如CuO);c.碳与H2O(g)反应制取水煤气等。
②复分解反应一般是酸、碱、盐之间的反应。
3.金属(或非金属)单质→盐的转化关系
①2Ca+O2 2CaO;
②CaO+H2O===Ca(OH)2;
③Ca(OH)2+CO2===CaCO3↓+H2O;
④CaCO3+2HCl===CaCl2+H2O+CO2↑。
4.物质转化的应用
(1)化学反应遵循质量守恒定律,故通过物质间的转化可以合成物质,如由单质可以得到盐,且有多条途径:
(2)在实际生产中,通过物质的转化制备具体物质时,除了要考虑反应进行的可能性,还需要考虑原料来源、成本高低和设备要求等因素。例如,NaOH可以用Na2O和H2O反应制取,化学方程式: ,但Na2O来源少、成本高,故工业上通常用 的方法来制取NaOH。
课堂练习
【答案】D
【解析】A.铁和氯气点燃的条件下生成氯化铁,不是氯化亚铁,A错误;
B.二氧化碳和氯化钠溶液不反应,B错误;
C.CuO与水不反应,C错误;
D.氯气与水反应生成次氯酸和盐酸,次氯酸不稳定,受热分解为氯化氢和氧气,D正确;
故选D。
Na2O+H2O===2NaOH
电解饱和食盐水
【解析】选B C和CuO发生置换反应生成Cu和CO2;CO2与H2O发生化合反应生成H2CO3;H2CO3和Ca(OH)2发生复分解反应生成CaCO3和H2O;CaCO3高温分解生成CaO和CO2。
【答案】D
【解析】A.根据反应原理可知,氢氧化钙和碳酸钠生成碳酸钙沉淀、和二氧化碳生成碳酸钙沉淀;而氢氧化钙和氯化钡不反应,A不符合题意;
B.Fe不能与Ca(OH)2反应,氢氧化钙和碳酸钠、碳酸钾均生成碳酸钙沉淀,故B不符合题意;
C.Fe2O3、CO、Ba(NO3)2都不能与Ca(OH)2反应,故C不符合题意;
D.根据反应原理可知,碳酸钠和盐酸生成二氧化碳气体,氢氧化钙和碳酸钠生成碳酸钙沉淀、和二氧化碳生成碳酸钙沉淀、和氯化镁生成氢氧化镁沉淀,故D符合题意;
故选D。
EPB
考点突破
04
巩固提升
01
练习与应用
1.“四大发明”、《天工开物》和《淮南万毕术》等都体现了我国古代劳动人民的智慧,下列过程中不涉及化学变化的是
A.制作冰雕 B.黑火药爆炸 C.火法炼锌 D.湿法炼铜
【答案】A
【解析】A.制作冰雕时冰的形状发生了变化,不涉及化学变化,A符合题意;
B.黑火药爆炸时有新物质产生,如二氧化硫和二氧化碳,属于化学变化,B不符合题意;
C.火法炼锌时有锌单质生成,发生了化学变化,C不符合题意;
D.湿法炼铜时有铁生成,发生了化学变化,D不符合题意;
故选A。
练习与应用
02
03
练习与应用
03
练习与应用
练习与应用
04
练习与应用
05
5.氯化镁是一种盐。下列途径,不能得到氯化镁的是
A.金属单质与非金属单质反应 B.酸性氧化物与碱反应
C.酸与碱发生中和反应 D.金属与酸反应
练习与应用
06
6.酸式盐是盐的一种,可看作是多元酸未被完全中和所得到的盐。常见的酸式盐有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2与足量的KOH反应只能生成一种盐KH2PO2。下列说法中,正确的是
A.KH2PO2属于正盐 B.KH2PO2溶液一定为酸性
C.H3PO2属于三元酸 D.KH2PO2可以与KOH反应生成K3PO2
【答案】A
【解析】A.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,说明KH2PO2属于正盐,不属于酸式盐,故A正确;
B.根据A选项分析得到KH2PO2属于正盐,则KH2PO2溶液一定不为酸性,故B错误;
C.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,说明H3PO2属于一元酸,故C错误;
D.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,则说明KH2PO2与KOH反应不能生成K3PO2,故D错误。
综上所述,答案为A。
07
练习与应用
练习与应用
07
【答案】(1)人工降雨(其他正确答案均可) (2)2NaOH +CO2=Na2CO3+H2O (3)过滤
(4)AD
【分析】(1)反应②分离出的CO2可制成干冰,干冰常用于人工降雨;故答案为:人工降雨(其他正确答案均可)。
(2)“捕捉室”中主要是CO和CO2的混合气体通入到NaOH溶液中,CO2和NaOH溶液反应生成Na2CO3和H2O,发生反应的化学方程式为2NaOH +CO2=Na2CO3+H2O;故答案为:2NaOH +CO2=Na2CO3+H2O。
(3)反应①在“反应分离室”内进行,由于碳酸钙难溶于水,因此将NaOH溶液和CaCO3分离的操作是过滤;故答案为:过滤。
(4)A. CO2排放过量会导致温室效应,捕捉到的CO2可用于制备其他化工产品,减少了温室气体的排放,故A正确;B. “反应分离室”中的反应要放出大量热,故B错误;C. 整个过程中NaOH、CaO可循环利用,故C错误;D. 碳酸钙高温分解生成CaO,能耗大是该捕捉技术的一大缺点,故D正确;综上所述,答案为AD。
08
练习与应用
练习与应用
08
【答案】 盐酸具有挥发性,使制得气体不纯 固体消失,溶液变为黄色 HCl+AgNO3=AgCl↓+HNO3或BaCl2+H2SO4=BaSO4↓+2HCl D
【解析】(1)盐酸具有挥发性,挥发出氯化氢气体,制得的氢气中混有氯化氢气体,不纯净,因此要制得较纯的H2,选稀硫酸而不选盐酸,故答案为:盐酸具有挥发性,使制得气体不纯;
(2)氧化铁能与稀盐酸、稀硫酸反应生成氯化铁和水、硫酸铁和水,生成的氯化铁、硫酸铁溶液均显黄色,因此会观察到红棕色固体逐渐减少,溶液变成黄色,故答案为:固体消失,溶液变为黄色;
(3)盐酸与硝酸银溶液反应生成氯化银白色沉淀,反应的化学方程式为HCl+AgNO3=AgCl↓+HNO3,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀,反应的化学方程式为BaCl2+H2SO4=BaSO4↓+2HCl,故答案为:HCl+AgNO3=AgCl↓+HNO3或BaCl2+H2SO4=BaSO4↓+2HCl;
(4)酸的通性包括:能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,盐酸与硝酸盐反应,硫酸与盐酸盐反应,故五组实验中没有体现酸的通性的是D,故答案为:D。
THANK YOU
第一节 物质的分类与转化
第一章 物质及其变化
第2课时 物质的转化
酸、碱、盐的性质
01
物质的转化
02
课堂练习
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
酸、碱、盐的性质
【情境】1.探究酸的通性(以盐酸为例)
性质预测 实验操作 实验现象 实验结论
盐酸 紫色石蕊溶液 (指示剂) 在盐酸中滴入石蕊溶液 溶液变 色 酸能使指示剂
铁 (单质) 在盛有铁丝的试管中滴入盐酸 产生 酸能 与反应
CuO (氧化物) 在盛有氧化铜的试管中滴入盐酸 固体 ,溶液呈 色 酸能与 反应
NaOH (碱) 在盛有烧碱溶液(含石蕊溶液)的试管中滴入过量盐酸 蓝色溶液变为色 酸能与 反应
AgNO3 (盐) 在盛有硝酸银溶液的试管中滴入盐酸 产生 酸能与 反应
红
变色
无色气泡
活泼金属
溶解
蓝
碱性氧化物
红
碱
白色沉淀
某些盐
(1)为什么不同的酸具有相似的化学性质?
【解析】不同的碱在组成上相似,从微观视角来看,不同碱溶液中都含有OH-,从而决定了不同碱的化学性质相似。
写出盐酸分别与上述物质反应的化学方程式,并注明反应类型。
(1)铁: ; 反应。
(2)氧化铜: ; 反应。
(3)烧碱: ; 反应。
(4)硝酸银: ; 反应。
【问题探究】
Fe+2HCl===FeCl2+H2↑
置换
CuO+2HCl===CuCl2+H2O
复分解
NaOH+HCl===NaCl+H2O
复分解
AgNO3+HCl===AgCl↓+HNO3
复分解
【情境】1.探究碱的通性(以澄清石灰水为例)
性质预测 实验操作 实验现象 实验结论
澄清石灰水 无色酚酞 (指示剂) 向澄清石灰水中滴入无色酚酞溶液 溶液变 色 碱能使指示剂
H2SO4 (酸) 向盛有稀H2SO4的试管中滴入澄清石灰水 产生 碱能与 反应
CO2 (酸性氧化物) 向澄清石灰水中通入CO2气体 澄清石灰水变 碱能与
反应
Na2CO3 (盐) 向澄清石灰水中滴入Na2CO3溶液 产生 碱能与
反应
CuCl2 (盐) 向CuCl2溶液中滴入澄清石灰水 产生 红
变色
白色沉淀
酸
浑浊
酸性氧化物
白色沉淀
某些盐
蓝色沉淀
(1)为什么不同的碱具有相似的化学性质?
【解析】不同的碱在组成上相似,从微观视角来看,不同碱溶液中都含有OH-,从而决定了不同碱的化学性质相似。
【问题探究】
写出澄清石灰水分别与上述物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ; 反应。
(2)CO2: ; 反应。
(3)Na2CO3: ; 反应。
(4)CuCl2: ; 反应。
Ca(OH)2+H2SO4===CaSO4↓+2H2O
复分解
CO2+Ca(OH)2===CaCO3↓+H2O
复分解
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
复分解
CuCl2+Ca(OH)2===CaCl2+Cu(OH)2↓
复分解
【情境】1.探究盐的通性(以Na2CO3溶液为例)
性质预测 实验操作 实验现象 实验结论
Na2CO3 溶液 稀硫酸 (酸) 向盛有稀硫酸的试管中滴加Na2CO3溶液 产生大量 某些盐能与 反应
Ba(OH)2 (碱) 向Na2CO3溶液中滴加Ba(OH)2溶液 产生 某些盐能与 反应
氯化钙 (盐) 向Na2CO3溶液中滴加CaCl2溶液 产生 盐能与
反应
写出Na2CO3溶液分别与上述物质反应的化学方程式,并注明反应类型。
(1)H2SO4:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑; 反应。
(2)Ba(OH)2:Na2CO3+Ba(OH)2===BaCO3↓+2NaOH; 反应。
(3)CaCl2:Na2CO3+CaCl2===CaCO3↓+2NaCl; 反应。
无色气泡
酸
白色沉淀
碱
白色沉淀
某些盐
复分解
复分解
复分解
(1)为什么某些不同的盐(如碳酸盐)具有相似的化学性质?
【解析】盐的组成中都含有金属阳离子(或铵根离子)和酸根离子;不同的碳酸盐溶液中都含有碳酸根离子,都能与强酸反应放出CO2气体,故不同的碳酸盐化学性质相似。
【问题探究】
归纳总结
1.酸、碱、盐的化学通性
(1)酸的化学通性
(2)碱的化学通性
(3)盐的化学通性
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
2.氧化物的化学通性
(1)酸性氧化物的化学通性
(2)碱性氧化物的化学通性
分散系及其分类
易错点
课堂练习
(1)能溶于水的含氧酸,对应的酸性氧化物一般能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O===H2SO4。
(2)能溶于水的碱(NH3·H2O除外),对应的碱性氧化物一般能与H2O反应生成相应的碱,如NaOH:Na2O+H2O===2NaOH。
(3)有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱反应、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
1.盐是一类常见的物质,下列物质通过一步反应可直接形成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③⑥ B.①④⑤⑥ C.②③⑤⑥ D.全部
【答案】D
【解析】①金属单质与非金属单质可生成盐,如Na与Cl2反应可生成氯化钠,①符合题意;②碱性氧化物与酸性氧化物、酸都可能生成盐,如Na2O与CO2反应生成碳酸钠,氧化钠与盐酸反应生成氯化钠,②符合题意;③碱和酸发生中和反应生成盐和水,③符合题意;④酸性氧化物与碱性氧化物、碱、某些盐反应都可能生成盐,如二氧化碳与氧化钠、氢氧化钠、碳酸钠溶液都能反应生成盐,④符合题意;⑤酸与金属、碱性氧化物、碱、某些盐反应,都可能生成盐,如盐酸与钠、氧化钠、氢氧化钠、碳酸钠都能反应生成盐,⑤符合题意;⑥酸与碱反应可以生成盐,如盐酸与氢氧化钠反应生成氯化钠,⑥符合题意;综合以上分析,①②③④⑤⑥都可通过一步反应生成盐,故选D。
2.下列四组实验中,不能体现酸的通性的是( )
解析:选C 盐酸与BaCl2溶液不反应,稀H2SO4与BaCl2溶液反应生成BaSO4沉淀,与酸的通性无关。
3.如图是小红学习“常见的碱”课题后,总结出的氢氧化钙的化学性质。下列说法不正确的是( )
A.①中的酚酞溶液变红
B.②中与盐酸反应的化学方程式为
Ca(OH)2+2HCl=CaCl2+2H2O
C.③中与硝酸钠溶液能发生反应
D.④可解释久置的澄清石灰水变质
【答案】C
【解析】A.①中Ca(OH)2能使酚酞溶液变红,A正确;
B.②中Ca(OH)2与HCl反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O,B正确;
C.③中NaNO3溶液与Ca(OH)2不反应,C错误;
D.④中久置的澄清石灰水变质的原因是Ca(OH)2+CO2=CaCO3↓+H2O,D正确;
故答案选C。
4.碳元素能形成多种氧化物,如CO、 CO2、C2O、C2O3,其中C2O、C2O3能燃烧生成CO2 ;C2O3能与H2O反应生成二元酸(H2C2O4),下列反应的化学方程式肯定错误的是
A.H2C2O4+Zn=ZnC2O4+H2↑
B.C2O3+CaO=CaC2O4
C.2C2O+3O2= 4CO2
D.C2O3+2NaOH=Na2CO3+H2O
【答案】D
【解析】A.由题干信息中H2C2O4是二元酸,可知其会与锌发生置换反应生成氢气,A正确;
B.由C2O3能与水反应生成二元酸及CO2的性质类推,可知C2O3能与CaO反应生成盐CaC2O4,B正确;
C.由题可知,C2O、C2O3能燃烧生成CO2,C正确;
D.C2O3能与H2O反应生成二元酸(H2C2O4),氧化物与碱的反应中,碳元素的化合价不变,故和氢氧化钠反应的生成物应为Na2C2O4,D错误;
答案D。
EPB
考点突破
02
物质的转化
【情境】纸是中国劳动人民长期经验的积累和智慧的结晶,纸是用以书写、印刷、绘画或包装等的片状纤维制品。
中国古代常用石灰水或草木灰水为丝麻脱胶,这种技术也给造纸中为植物纤维脱胶以启示。纸张就是借助这些技术发展起来的。
【问题探究】
(1)熟石灰、石灰石、生石灰都含有相同的元素,你能分别写出它们的主要成分的化学式吗?
【解析】Ca(OH)2、CaCO3、CaO。
(2)工业以石灰石制石灰水,请写出有关的化学方程式。
【解析】
CaCO3 CaO+CO2↑、
CaO+H2O=Ca(OH)2。
(3)某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
Ⅰ.写出第③步转化的化学方程式。
Ⅱ.以石灰石为原料,请设计制备CaCO3的另一方案,并写出流程图。
归纳总结
1.单质、氧化物、酸、碱、盐之间的转化关系
(1)转化图示
分散系及其分类
易错点
①上述转化关系并非包含所有反应,如H2、CO、C还原CuO或Fe2O3,CuSO4+5H2O===CuSO4·5H2O等反应均未包含。
②上述转化关系表示的是一般的共性,但学习时还要关注特殊性。例如,金属+酸―→盐+氢气,但铜与盐酸就不反应。
③有盐和水生成的反应不一定是中和反应,如酸性氧化物与碱反应、碱性氧化物与酸反应均有盐和水生成,但不是中和反应。
(2)转化示例:在硫酸、二氧化碳、铜片、氯化钠、生石灰、一氧化碳、纯碱、铁和木炭9种物质间存在如图所示关系,给①~⑤选择适当的物质,使连线的两种物质能发生反应。
Ⅰ.它们的化学式分别为① ;② ;③ ;④ ;⑤ 。
Ⅱ.写出下列物质之间发生反应的化学方程式。
①和②Fe+H2SO4===FeSO4+H2↑;
②和④CaO+H2SO4===CaSO4↓+H2O;
②和⑤Na2CO3+H2SO4===Na2SO4+H2O+CO2↑;
③和④CO2+CaO===CaCO3。
Fe
H2SO4
CO2
CaO
Na2CO3
2.无机基本反应类型
(1)化合反应:A+B+……―→C;
(2)分解反应:A―→B+C+……;
(3)置换反应:A+BC―→AC+B;
(4)复分解反应:AB+CD―→AD+CB。
易错点
①常见的置换反应有a.金属与酸、盐的置换反应;b.H2还原某些金属氧化物(如CuO);c.碳与H2O(g)反应制取水煤气等。
②复分解反应一般是酸、碱、盐之间的反应。
3.金属(或非金属)单质→盐的转化关系
①2Ca+O2 2CaO;
②CaO+H2O===Ca(OH)2;
③Ca(OH)2+CO2===CaCO3↓+H2O;
④CaCO3+2HCl===CaCl2+H2O+CO2↑。
4.物质转化的应用
(1)化学反应遵循质量守恒定律,故通过物质间的转化可以合成物质,如由单质可以得到盐,且有多条途径:
(2)在实际生产中,通过物质的转化制备具体物质时,除了要考虑反应进行的可能性,还需要考虑原料来源、成本高低和设备要求等因素。例如,NaOH可以用Na2O和H2O反应制取,化学方程式: ,但Na2O来源少、成本高,故工业上通常用 的方法来制取NaOH。
课堂练习
【答案】D
【解析】A.铁和氯气点燃的条件下生成氯化铁,不是氯化亚铁,A错误;
B.二氧化碳和氯化钠溶液不反应,B错误;
C.CuO与水不反应,C错误;
D.氯气与水反应生成次氯酸和盐酸,次氯酸不稳定,受热分解为氯化氢和氧气,D正确;
故选D。
Na2O+H2O===2NaOH
电解饱和食盐水
【解析】选B C和CuO发生置换反应生成Cu和CO2;CO2与H2O发生化合反应生成H2CO3;H2CO3和Ca(OH)2发生复分解反应生成CaCO3和H2O;CaCO3高温分解生成CaO和CO2。
【答案】D
【解析】A.根据反应原理可知,氢氧化钙和碳酸钠生成碳酸钙沉淀、和二氧化碳生成碳酸钙沉淀;而氢氧化钙和氯化钡不反应,A不符合题意;
B.Fe不能与Ca(OH)2反应,氢氧化钙和碳酸钠、碳酸钾均生成碳酸钙沉淀,故B不符合题意;
C.Fe2O3、CO、Ba(NO3)2都不能与Ca(OH)2反应,故C不符合题意;
D.根据反应原理可知,碳酸钠和盐酸生成二氧化碳气体,氢氧化钙和碳酸钠生成碳酸钙沉淀、和二氧化碳生成碳酸钙沉淀、和氯化镁生成氢氧化镁沉淀,故D符合题意;
故选D。
EPB
考点突破
04
巩固提升
01
练习与应用
1.“四大发明”、《天工开物》和《淮南万毕术》等都体现了我国古代劳动人民的智慧,下列过程中不涉及化学变化的是
A.制作冰雕 B.黑火药爆炸 C.火法炼锌 D.湿法炼铜
【答案】A
【解析】A.制作冰雕时冰的形状发生了变化,不涉及化学变化,A符合题意;
B.黑火药爆炸时有新物质产生,如二氧化硫和二氧化碳,属于化学变化,B不符合题意;
C.火法炼锌时有锌单质生成,发生了化学变化,C不符合题意;
D.湿法炼铜时有铁生成,发生了化学变化,D不符合题意;
故选A。
练习与应用
02
03
练习与应用
03
练习与应用
练习与应用
04
练习与应用
05
5.氯化镁是一种盐。下列途径,不能得到氯化镁的是
A.金属单质与非金属单质反应 B.酸性氧化物与碱反应
C.酸与碱发生中和反应 D.金属与酸反应
练习与应用
06
6.酸式盐是盐的一种,可看作是多元酸未被完全中和所得到的盐。常见的酸式盐有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2与足量的KOH反应只能生成一种盐KH2PO2。下列说法中,正确的是
A.KH2PO2属于正盐 B.KH2PO2溶液一定为酸性
C.H3PO2属于三元酸 D.KH2PO2可以与KOH反应生成K3PO2
【答案】A
【解析】A.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,说明KH2PO2属于正盐,不属于酸式盐,故A正确;
B.根据A选项分析得到KH2PO2属于正盐,则KH2PO2溶液一定不为酸性,故B错误;
C.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,说明H3PO2属于一元酸,故C错误;
D.H3PO2与足量的KOH反应只能生成一种盐KH2PO2,则说明KH2PO2与KOH反应不能生成K3PO2,故D错误。
综上所述,答案为A。
07
练习与应用
练习与应用
07
【答案】(1)人工降雨(其他正确答案均可) (2)2NaOH +CO2=Na2CO3+H2O (3)过滤
(4)AD
【分析】(1)反应②分离出的CO2可制成干冰,干冰常用于人工降雨;故答案为:人工降雨(其他正确答案均可)。
(2)“捕捉室”中主要是CO和CO2的混合气体通入到NaOH溶液中,CO2和NaOH溶液反应生成Na2CO3和H2O,发生反应的化学方程式为2NaOH +CO2=Na2CO3+H2O;故答案为:2NaOH +CO2=Na2CO3+H2O。
(3)反应①在“反应分离室”内进行,由于碳酸钙难溶于水,因此将NaOH溶液和CaCO3分离的操作是过滤;故答案为:过滤。
(4)A. CO2排放过量会导致温室效应,捕捉到的CO2可用于制备其他化工产品,减少了温室气体的排放,故A正确;B. “反应分离室”中的反应要放出大量热,故B错误;C. 整个过程中NaOH、CaO可循环利用,故C错误;D. 碳酸钙高温分解生成CaO,能耗大是该捕捉技术的一大缺点,故D正确;综上所述,答案为AD。
08
练习与应用
练习与应用
08
【答案】 盐酸具有挥发性,使制得气体不纯 固体消失,溶液变为黄色 HCl+AgNO3=AgCl↓+HNO3或BaCl2+H2SO4=BaSO4↓+2HCl D
【解析】(1)盐酸具有挥发性,挥发出氯化氢气体,制得的氢气中混有氯化氢气体,不纯净,因此要制得较纯的H2,选稀硫酸而不选盐酸,故答案为:盐酸具有挥发性,使制得气体不纯;
(2)氧化铁能与稀盐酸、稀硫酸反应生成氯化铁和水、硫酸铁和水,生成的氯化铁、硫酸铁溶液均显黄色,因此会观察到红棕色固体逐渐减少,溶液变成黄色,故答案为:固体消失,溶液变为黄色;
(3)盐酸与硝酸银溶液反应生成氯化银白色沉淀,反应的化学方程式为HCl+AgNO3=AgCl↓+HNO3,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀,反应的化学方程式为BaCl2+H2SO4=BaSO4↓+2HCl,故答案为:HCl+AgNO3=AgCl↓+HNO3或BaCl2+H2SO4=BaSO4↓+2HCl;
(4)酸的通性包括:能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,盐酸与硝酸盐反应,硫酸与盐酸盐反应,故五组实验中没有体现酸的通性的是D,故答案为:D。
THANK YOU
