【新教材】鲁教版化学九年级上册第2单元第1节 原子 课件(共34张PPT)
文档属性
| 名称 | 【新教材】鲁教版化学九年级上册第2单元第1节 原子 课件(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 33.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-03 09:05:30 | ||
图片预览







文档简介
(共34张PPT)
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
第一节 原子
目
录
CONTENTS
1
知道原子由原子核和核外电子构成,记住核电荷数、质子数和核外电子数的关系
2
知道原子、离子、分子是构成物质的一种基本微粒,知道原子的性质
3
知道什么是相对原子质量,能根据相对原子质量的概念进行简单计算
感受化学魅力
探寻化学之美
4
知道原子与离子和分子之间可以相互转化,初步认识核外电子在化学反应中的作用
重点:原子等微观粒子概念的形成及原子构成
难点:微观粒子概念的形成及相对原子质量的理解
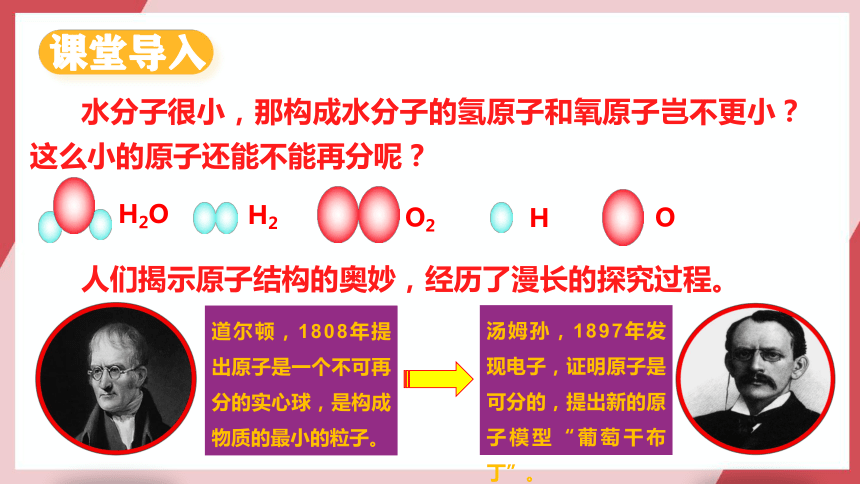
水分子很小,那构成水分子的氢原子和氧原子岂不更小?这么小的原子还能不能再分呢?
课堂导入
H2O
H
O
H2
O2
人们揭示原子结构的奥妙,经历了漫长的探究过程。
道尔顿,1808年提出原子是一个不可再分的实心球,是构成物质的最小的粒子。
汤姆孙,1897年发现电子,证明原子是可分的,提出新的原子模型“葡萄干布丁”。
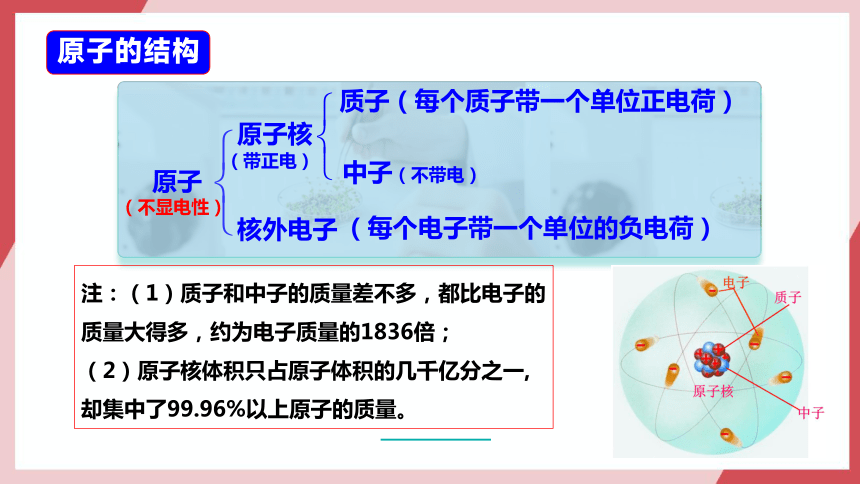
原子的结构
一、
原子里究竟有什么呢?若只有原子,怎样保证原子为电中性呢?
探究新知
汤姆孙原子模型
1911年卢瑟福和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。根据实验,提出新的原子模型,即“有核原子模型”。
α粒子轰击金箔
实验现象:
大多数α粒子穿过金箔未发生偏转;
少数α粒子穿过金箔方向发生偏转;
极少数α粒子被反弹回来。
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
原子的结构
原子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
原子核
核外电子
(带正电)
(不显电性)
注:(1)质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍;
(2)原子核体积只占原子体积的几千亿分之一,却集中了99.96%以上原子的质量。
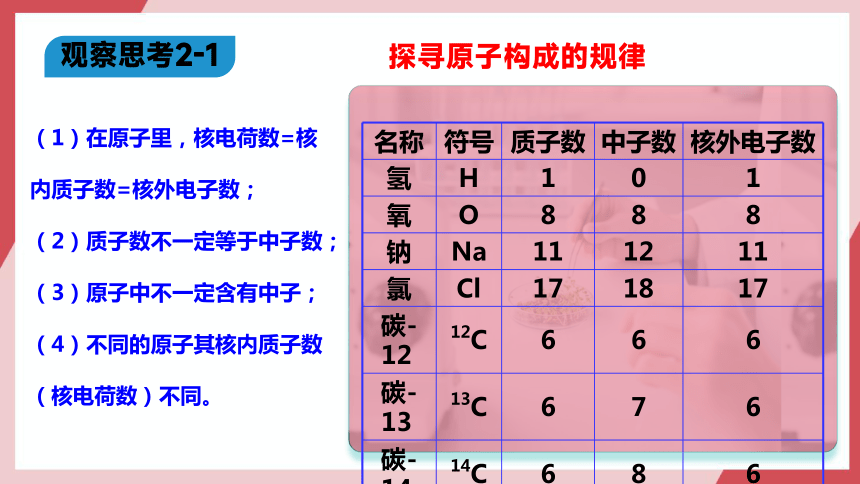
探寻原子构成的规律
观察思考2-1
名称 符号 质子数 中子数 核外电子数
氢 H 1 0 1
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 12C 6 6 6
碳-13 13C 6 7 6
碳-14 14C 6 8 6
(1)在原子里,核电荷数=核内质子数=核外电子数;
(2)质子数不一定等于中子数;
(3)原子中不一定含有中子;
(4)不同的原子其核内质子数(核电荷数)不同。
原子具有微观粒子的一般性质:
(1)原子体积和质量很小;
(2)原子总在不断运动;
(3)原子之间有间隔。
原子的性质
原子是构成物质的一种微观粒子
①金属(金、铜等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
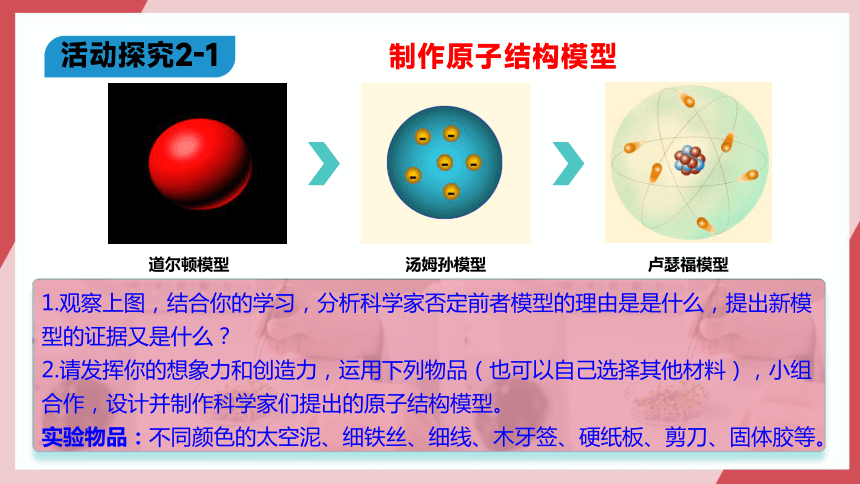
制作原子结构模型
活动探究2-1
1.观察上图,结合你的学习,分析科学家否定前者模型的理由是是什么,提出新模型的证据又是什么?
2.请发挥你的想象力和创造力,运用下列物品(也可以自己选择其他材料),小组合作,设计并制作科学家们提出的原子结构模型。
实验物品:不同颜色的太空泥、细铁丝、细线、木牙签、硬纸板、剪刀、固体胶等。
道尔顿模型
汤姆孙模型
卢瑟福模型
二、
虽然所有原子都非常微小,但是它们的质量仍存在差异。例如,1个氧原子的质量为2.657×10-26kg。这么小的数字,书写和运算都很不方便,为此国际上统一采用相对原子质量来计量原子的质量。
计量原子的质量
以一个碳12原子的实际质量(约1.993×10-26kg)的1/12作为标准, 其他原子的质量跟它的比值, 就是这种原子的相对原子质量。
相对原子质量
相对原子质量 = ------------------------
原子的实际质量
碳12原子质量的1/12
相对原子质量与原子的质量区别
(1)原子的质量是原子的实际存在的物质的多少,是实际质量;
(2)相对原子质量是以C-12原子质量的1/12为标准来表示物质质量多少的相对质量。原子质量的单位是kg,相对原子质量的单位是1(一般不写),原子的质量主要集中在原子核上;
(3)构成原子的三种粒子中,1个质子和1个中子的质量跟相对原子质量的标准(即一个碳12原子质量的1/12)相比,均约等于1,电子的质量很小,可以忽略不计,故原子的质量主要集中在质子和中子(即原子核)上。相对原子质量≈质子数+中子数。
原子与离子、分子
三、
分子是由原子构成的,原子得到或失去电子后转变为离子。
在原子中,电子是体积最小、质量最轻的一种粒子。不同的原子含有的电子数目不同。核外电子的能量是不同的,依据能量电子分层排布
核外电子的分层排布
电子层数:1、2、3、4、5、6、7
电子能量:
离核远近:
能量越低,离核越近;能量越高,离核越远。
低 高
近 远
用原子结构示意图可以方便简明地表示原子核外电子的排布。
原子结构的表示
多识一点
原子核
质子数
第二层电子数
第一层
第二层最外层
部分原子的原子结构示意图
同一列的原子最外层电子数相同,
从上到下电子层数逐渐增加
同一行的原子核外电子层数相同,从左到右最外层由1逐渐递增到8
核外电子与原子性质的关系
原子最外层电子数与结构、性质的关系
原 子 最外层 电子数 原 子 结 构 变 化 趋 势 化 学
性 质
稀 有 气 体
金 属
非 金属
8个
(氦为2个 )
稳定结构
稳 定
稳 定
一般<4 个
不稳定结构
易失去电子
活 泼
一般≥4个
不稳定结构
易获得电子
活 泼
电子不仅决定原子的体积,也决定原子在化学反应中的表现
在化学反应中,原子核是不变的,发生改变的只是核外电子。
离子
1.离子的形成
原子失去电子后变成
带正电荷的阳离子,
原子得到电子后变成
带负电荷的阴离子。
2.离子的表示方法
离子符号右上角的数字表示离子所带的电荷数,正负号表示离子所带电荷的电性。
Mg2+
Cl-
Na+
O2-
镁离子
氯离子
钠离子
氧离子
每个镁离子带2个单位的正电荷
表示2个镁离子
Mg2+
2
有些原子之间不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。
同种原子可以结合成分子,不同种原子也可以结合成分子。
H2O
H2
O2
原子、分子离子都是构成物质的微观粒子
质子和中子还可以在分吗?
多识一点
原子可以再分为质子、中子和电子,那么质子、中子和电子能否再分
1964年,科学家首次提出了夸克模型(图2-6),认为质子、中子由更小的夸克构成。这一模型的提出,成功地解释了许多事实。随着科学技术的进步,人们不仅利用大型粒子对撞机证明了夸克的存在,更发现与所有已知的质子、中子、电子等亚原子粒子不同,夸克带有分数电荷且都是两两成对或三三成群。
夸克的发现不仅刷新了人类对微观世界的认知,也再次激发了人类探索微观世界的热情。随着众多亚原子粒子不断被发现,人类逼近微观世界本质的步伐也越来越快。
图2-6 夸克模型
1.如图是卢瑟福将带正电的a粒子流轰击金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
B.绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
C.绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
D.绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
课堂达标
2.对“原子的构成”同学们有以下认识,其中错误的是( )
A.原子核中质子数一定等于中子数
B.核外电子在离核远近不同的区域中运动
C.原子由居于中心的原子核和核外电子构成
D.原子核的体积与整个原子的体积相比要小很多
A
课堂达标
3.下列叙述中,错误的是( )
①原子是化学变化中的最小微粒;
②原子是不能再分的微粒;
③一切物质都是由原子直接构成的;
④一切原子核都是由质子和中子构成的;
⑤ 原子不显电性;⑥原子之间有空隙
A.①② B.②③④ C.③⑤ D.③④⑥
B
课堂达标
4.科学家通过测定古生物遗骸中的碳14含量来推断古城年代。碳14原子的结构示意图为 ,下列关于碳14原子说法中,不正确的是( )
A.核外电子数是6
B.核电荷数等于核外电子数
C.质子数是6
D.核外有两个电子层,第一层上有4个电子
D
课堂达标
5.关于相对原子质量,下列叙述正确的是( )
A.原子的质量就是相对原子质量
B.化学上采用相对原子质量,更便于比较和运算
C.碳原子的相对原子质量是 12g
D.两种原子的相对原子质量之比不等于它们的质量之比
B
课堂达标
6.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为( )
A.12m/n g B.12n/m g
C.12m/n D.12n/m
D
课堂达标
7.已知碘原子的核电荷数为53,相对原子质量为125,下列关于这种原子的说法中,错误的是( )
A.中子数是72 B.质子数是72
C.电子数是53 D.质子数和中子数之和是125
B
课堂达标
8.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
课堂达标
9.通过探究物质构成的奥秘,我们了解了物质的组成与结构。
(1)物质的组成和构成关系如图所示,
图中①表示 ______,②表示 _______。
(2)电子的质量很小,可以忽略不计,
所以原子的质量主要集中在 _____上,相
对原子质量近似等于 _____与中子数之和。
(3)金属铜是由 ________(选填“原子”、“分子”或“离子”)构成的。
质子
课堂达标
离子
原子核
质子数
原子
10.如下图所示,分别是钾元素、氢元素、氧元素、钠元素的原子结构示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
(4)根据上图信息分析,1 个氢氧根离子中含有的电子数是_______。
19
课堂达标
最外层电子数相同
H+
10
知识总结
不良反应
1.原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(每个电子带一个单位负电荷)
在原子里,核电荷数=核内质子数=核外电子数
(不带电)
中子
3.分子是由原子构成的,原子得到或失去电子后转变为离子。原子、分子、离子都是构成物质的微观粒子
相对原子质量=
某种原子的质量
碳12原子质量×1/12
相对原子质量≈质子数+中子数
2.相对原子质量:以碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比
谢谢您的观看
感受化学魅力
探寻化学之美
感受化学魅力
探寻化学之美
认识物质的构成
第二单元
第一节 原子
目
录
CONTENTS
1
知道原子由原子核和核外电子构成,记住核电荷数、质子数和核外电子数的关系
2
知道原子、离子、分子是构成物质的一种基本微粒,知道原子的性质
3
知道什么是相对原子质量,能根据相对原子质量的概念进行简单计算
感受化学魅力
探寻化学之美
4
知道原子与离子和分子之间可以相互转化,初步认识核外电子在化学反应中的作用
重点:原子等微观粒子概念的形成及原子构成
难点:微观粒子概念的形成及相对原子质量的理解
水分子很小,那构成水分子的氢原子和氧原子岂不更小?这么小的原子还能不能再分呢?
课堂导入
H2O
H
O
H2
O2
人们揭示原子结构的奥妙,经历了漫长的探究过程。
道尔顿,1808年提出原子是一个不可再分的实心球,是构成物质的最小的粒子。
汤姆孙,1897年发现电子,证明原子是可分的,提出新的原子模型“葡萄干布丁”。
原子的结构
一、
原子里究竟有什么呢?若只有原子,怎样保证原子为电中性呢?
探究新知
汤姆孙原子模型
1911年卢瑟福和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。根据实验,提出新的原子模型,即“有核原子模型”。
α粒子轰击金箔
实验现象:
大多数α粒子穿过金箔未发生偏转;
少数α粒子穿过金箔方向发生偏转;
极少数α粒子被反弹回来。
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
原子的结构
原子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
原子核
核外电子
(带正电)
(不显电性)
注:(1)质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍;
(2)原子核体积只占原子体积的几千亿分之一,却集中了99.96%以上原子的质量。
探寻原子构成的规律
观察思考2-1
名称 符号 质子数 中子数 核外电子数
氢 H 1 0 1
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 12C 6 6 6
碳-13 13C 6 7 6
碳-14 14C 6 8 6
(1)在原子里,核电荷数=核内质子数=核外电子数;
(2)质子数不一定等于中子数;
(3)原子中不一定含有中子;
(4)不同的原子其核内质子数(核电荷数)不同。
原子具有微观粒子的一般性质:
(1)原子体积和质量很小;
(2)原子总在不断运动;
(3)原子之间有间隔。
原子的性质
原子是构成物质的一种微观粒子
①金属(金、铜等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
制作原子结构模型
活动探究2-1
1.观察上图,结合你的学习,分析科学家否定前者模型的理由是是什么,提出新模型的证据又是什么?
2.请发挥你的想象力和创造力,运用下列物品(也可以自己选择其他材料),小组合作,设计并制作科学家们提出的原子结构模型。
实验物品:不同颜色的太空泥、细铁丝、细线、木牙签、硬纸板、剪刀、固体胶等。
道尔顿模型
汤姆孙模型
卢瑟福模型
二、
虽然所有原子都非常微小,但是它们的质量仍存在差异。例如,1个氧原子的质量为2.657×10-26kg。这么小的数字,书写和运算都很不方便,为此国际上统一采用相对原子质量来计量原子的质量。
计量原子的质量
以一个碳12原子的实际质量(约1.993×10-26kg)的1/12作为标准, 其他原子的质量跟它的比值, 就是这种原子的相对原子质量。
相对原子质量
相对原子质量 = ------------------------
原子的实际质量
碳12原子质量的1/12
相对原子质量与原子的质量区别
(1)原子的质量是原子的实际存在的物质的多少,是实际质量;
(2)相对原子质量是以C-12原子质量的1/12为标准来表示物质质量多少的相对质量。原子质量的单位是kg,相对原子质量的单位是1(一般不写),原子的质量主要集中在原子核上;
(3)构成原子的三种粒子中,1个质子和1个中子的质量跟相对原子质量的标准(即一个碳12原子质量的1/12)相比,均约等于1,电子的质量很小,可以忽略不计,故原子的质量主要集中在质子和中子(即原子核)上。相对原子质量≈质子数+中子数。
原子与离子、分子
三、
分子是由原子构成的,原子得到或失去电子后转变为离子。
在原子中,电子是体积最小、质量最轻的一种粒子。不同的原子含有的电子数目不同。核外电子的能量是不同的,依据能量电子分层排布
核外电子的分层排布
电子层数:1、2、3、4、5、6、7
电子能量:
离核远近:
能量越低,离核越近;能量越高,离核越远。
低 高
近 远
用原子结构示意图可以方便简明地表示原子核外电子的排布。
原子结构的表示
多识一点
原子核
质子数
第二层电子数
第一层
第二层最外层
部分原子的原子结构示意图
同一列的原子最外层电子数相同,
从上到下电子层数逐渐增加
同一行的原子核外电子层数相同,从左到右最外层由1逐渐递增到8
核外电子与原子性质的关系
原子最外层电子数与结构、性质的关系
原 子 最外层 电子数 原 子 结 构 变 化 趋 势 化 学
性 质
稀 有 气 体
金 属
非 金属
8个
(氦为2个 )
稳定结构
稳 定
稳 定
一般<4 个
不稳定结构
易失去电子
活 泼
一般≥4个
不稳定结构
易获得电子
活 泼
电子不仅决定原子的体积,也决定原子在化学反应中的表现
在化学反应中,原子核是不变的,发生改变的只是核外电子。
离子
1.离子的形成
原子失去电子后变成
带正电荷的阳离子,
原子得到电子后变成
带负电荷的阴离子。
2.离子的表示方法
离子符号右上角的数字表示离子所带的电荷数,正负号表示离子所带电荷的电性。
Mg2+
Cl-
Na+
O2-
镁离子
氯离子
钠离子
氧离子
每个镁离子带2个单位的正电荷
表示2个镁离子
Mg2+
2
有些原子之间不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。
同种原子可以结合成分子,不同种原子也可以结合成分子。
H2O
H2
O2
原子、分子离子都是构成物质的微观粒子
质子和中子还可以在分吗?
多识一点
原子可以再分为质子、中子和电子,那么质子、中子和电子能否再分
1964年,科学家首次提出了夸克模型(图2-6),认为质子、中子由更小的夸克构成。这一模型的提出,成功地解释了许多事实。随着科学技术的进步,人们不仅利用大型粒子对撞机证明了夸克的存在,更发现与所有已知的质子、中子、电子等亚原子粒子不同,夸克带有分数电荷且都是两两成对或三三成群。
夸克的发现不仅刷新了人类对微观世界的认知,也再次激发了人类探索微观世界的热情。随着众多亚原子粒子不断被发现,人类逼近微观世界本质的步伐也越来越快。
图2-6 夸克模型
1.如图是卢瑟福将带正电的a粒子流轰击金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
B.绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
C.绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
D.绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
课堂达标
2.对“原子的构成”同学们有以下认识,其中错误的是( )
A.原子核中质子数一定等于中子数
B.核外电子在离核远近不同的区域中运动
C.原子由居于中心的原子核和核外电子构成
D.原子核的体积与整个原子的体积相比要小很多
A
课堂达标
3.下列叙述中,错误的是( )
①原子是化学变化中的最小微粒;
②原子是不能再分的微粒;
③一切物质都是由原子直接构成的;
④一切原子核都是由质子和中子构成的;
⑤ 原子不显电性;⑥原子之间有空隙
A.①② B.②③④ C.③⑤ D.③④⑥
B
课堂达标
4.科学家通过测定古生物遗骸中的碳14含量来推断古城年代。碳14原子的结构示意图为 ,下列关于碳14原子说法中,不正确的是( )
A.核外电子数是6
B.核电荷数等于核外电子数
C.质子数是6
D.核外有两个电子层,第一层上有4个电子
D
课堂达标
5.关于相对原子质量,下列叙述正确的是( )
A.原子的质量就是相对原子质量
B.化学上采用相对原子质量,更便于比较和运算
C.碳原子的相对原子质量是 12g
D.两种原子的相对原子质量之比不等于它们的质量之比
B
课堂达标
6.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为( )
A.12m/n g B.12n/m g
C.12m/n D.12n/m
D
课堂达标
7.已知碘原子的核电荷数为53,相对原子质量为125,下列关于这种原子的说法中,错误的是( )
A.中子数是72 B.质子数是72
C.电子数是53 D.质子数和中子数之和是125
B
课堂达标
8.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
课堂达标
9.通过探究物质构成的奥秘,我们了解了物质的组成与结构。
(1)物质的组成和构成关系如图所示,
图中①表示 ______,②表示 _______。
(2)电子的质量很小,可以忽略不计,
所以原子的质量主要集中在 _____上,相
对原子质量近似等于 _____与中子数之和。
(3)金属铜是由 ________(选填“原子”、“分子”或“离子”)构成的。
质子
课堂达标
离子
原子核
质子数
原子
10.如下图所示,分别是钾元素、氢元素、氧元素、钠元素的原子结构示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
(4)根据上图信息分析,1 个氢氧根离子中含有的电子数是_______。
19
课堂达标
最外层电子数相同
H+
10
知识总结
不良反应
1.原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(每个电子带一个单位负电荷)
在原子里,核电荷数=核内质子数=核外电子数
(不带电)
中子
3.分子是由原子构成的,原子得到或失去电子后转变为离子。原子、分子、离子都是构成物质的微观粒子
相对原子质量=
某种原子的质量
碳12原子质量×1/12
相对原子质量≈质子数+中子数
2.相对原子质量:以碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比
谢谢您的观看
感受化学魅力
探寻化学之美
同课章节目录
