【高中化学人教版(2019)选择性必修1同步练习】第三章 水溶液中的离子反应与平衡综合检测题(含解析)
文档属性
| 名称 | 【高中化学人教版(2019)选择性必修1同步练习】第三章 水溶液中的离子反应与平衡综合检测题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 447.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-04 18:14:04 | ||
图片预览




文档简介
第三章 水溶液中的离子反应与平衡
【高中化学人教版(2019)选择性必修1同步练习】
第三章 水溶液中的离子反应与平衡综合检测题
一、单选题
1.下列物质中,既是强电解质又属于离子化合物的是( )
A.醋酸 B.碘化氢
C.硫酸 D.苛性钠
2.0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确是( )
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
3.下列事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可以使酚酞试液变红
②0.1mol/L的氯化铵溶液的pH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱
④铵盐受热易分解.
A.①② B.②③ C.③④ D.②④
4.下列物质中,属于弱电解质的是( )
A.CH3COOH B.KOH C.BaSO4 D.CH3COONa
5.室温下,用0.1000mol·L-1CH3COOH标准溶液滴定20.00mL未知浓度的NaOH溶液,pH随CH3COOH溶液体积的变化如图所示。下列说法不正确的是( )
A.滴定时应选择酚酞作指示剂
B.反应终点时,c2(H+)+c(H+)·c(CH3COOH)=10-14
C.选择甲基红作指示剂,会导致所测c(NaOH)偏小
D.标准溶液改用等浓度的盐酸,突变范围会变大
6.根据实验操作及现象,能得出相应结论的是
实验操作及现象 结论
A 向氯水中加入一定量铁粉,充分振荡后滴加几滴KSCN溶液,溶液呈浅绿色 该氯水为久置氯水
B 向少量FeS悬浊液中加入足量饱和溶液,沉淀颜色变为浅红色(MnS)
C 取少量待测液于试管中,加几滴盐酸酸化溶液,产生白色沉淀 溶液中含有
D 向某无色溶液中先加入少量氯水,再加入,振荡,下层溶液呈紫红色 原溶液中一定存在
A.A B.B C.C D.D
二、多选题
7.室温下,向两份浓度均为0.1 mol/L的HX溶液中分别滴加0.1 mol/L的盐酸和NaOH溶液,向两份0.1 mol/L的HY溶液中也进行同样操作,测得x[,其中A=X或Y]与溶液pH的关系如图所示。
已知:Ka(HX)>Ka(HY)。下列说法正确的是( )
A.溶液中水的电离程度:a>b>c
B.d点溶液中:c(HA)+c(A-)<0.10 mol/L
C.b点到c点之间,c(Na+)始终大于c(A-)
D.NaY溶液中的Kh=1.0×10-9.25
8.已知某温度时CH3COOH 的电离平衡常数为K,该温度下向 20mL 0.1mol·L-1 CH3COOH 溶液中逐滴加入0.1mol·L-1NaOH 溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
A.a 点表示溶液中c(CH3COO-)=10-3 mol·L-1
B.b 点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d 点表示的溶液中 均等于K
三、填空题
9.下列物质:①水 ② 稀硫酸 ③盐酸 ④烧碱 ⑤硝酸钾 ⑥酒精 ⑦碘酒 ⑧蔗糖 ⑨NH3
(用编号回答)其中属于
电解质的是: 。
非电解质的是: 。
强电解质的是 。
弱电解质的是 。
10.氯化铝水溶液呈 性,原因是(用离子方程式表示): .把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
11.下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
12.在K2CO3的溶液中,各离子的物质的量浓度由大到小的顺序是 .
13.高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为 (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成释放到烟气中,该反应的化学方程式为 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将、NO、转化为。烟气中含有的会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为 (填化学式)。
②研究发现砷中毒机理主要是分子破坏了催化剂的Lewis酸位点,使数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构 。
③不易使催化剂中毒。但与相比,更不利于脱硝反应的进行,其原因是 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(或铵盐)会影响水泥的性能。
①取50.00 g粉煤灰加入NaOH蒸出,用20 mL 0.1000 mol L的溶液吸收,用0.2000mol L NaOH溶液滴定过量的至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以计的氨含量 (用mg g表示,写出计算过程)。
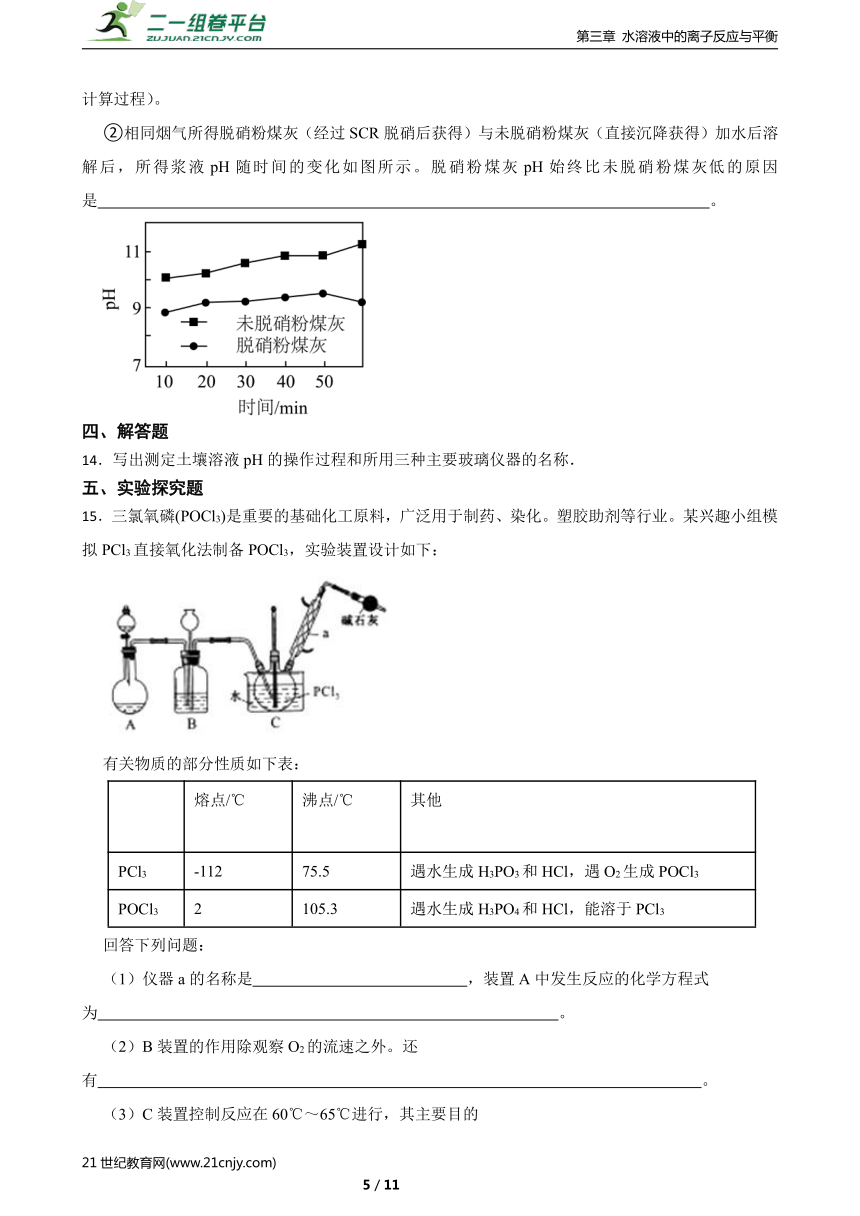
②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是 。
四、解答题
14.写出测定土壤溶液pH的操作过程和所用三种主要玻璃仪器的名称.
五、实验探究题
15.三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
有关物质的部分性质如下表:
熔点/℃ 沸点/℃ 其他
PCl3 -112 75.5 遇水生成H3PO3和HCl,遇O2生成POCl3
POCl3 2 105.3 遇水生成H3PO4和HCl,能溶于PCl3
回答下列问题:
(1)仪器a的名称是 ,装置A中发生反应的化学方程式为 。
(2)B装置的作用除观察O2的流速之外。还有 。
(3)C装置控制反应在60℃~65℃进行,其主要目的是 。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (填标号),滴定终点的现象为 。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式) 。
③步骤III加入硝基苯的目的是 ,如无此操作,所测Cl元素含量将会 (填“偏大”“偏小”或“不变”)。
六、综合题
16.完成下列填空
(1)下列两组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO
B.NaOH、Na2CO3、KOH、Cu(OH)2
这两种物质依次是(填化学式):A ;B .
(2)①NaCl(S) ②HCl(l) ③Cu ④酒精 ⑤液态醋酸⑥KNO3溶液填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;属于弱电解质的是 .
17.在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为 moL,MgCl2的物质的量为 moL,Cl﹣的物质的量为 moL.
(2)该混合溶液中含溶质的总质量为 g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 moL L﹣1.
七、推断题
18.
(1)I.回答下列问题
现有以下物质:①晶体②③液态醋酸④铜⑤固体⑥纯蔗糖()⑦酒精()⑧熔化的⑨氨水⑩液氨。
请回答下列问题。(填相应序号)
以上物质能导电的是 ;
(2)以上物质属于非电解质的是 ;
(3)以上物质属于强电解质的是 ;
(4)Ⅱ.有一无色溶液,其中可能含有等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下:
(ⅰ)用洁净的铂丝蘸取少量溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色。
(ⅱ)取少量原溶液,滴加足量溶液,有白色沉淀产生,再滴加足量的稀硝酸,无气泡产生且沉淀不溶解,过滤得到滤液a。
(ⅲ)另取少量原溶液,逐滴滴加过量的溶液,白色沉淀先增多后减少,但不完全溶解。
原溶液中一定存在的离子有 ;一定不存在的离子有 。
(5)补齐检验溶液中不能确定离子的操作:取少量滤液a, 。
(6)写出第(ⅲ)个实验中白色沉淀减少过程中发生的离子反应方程式: 。
(7)结合实验(ⅲ),你认为实验室制备,用可溶性铝盐和 反应更佳(填化学式)。
答案解析部分
1.【答案】D
【知识点】离子化合物的结构特征与性质;强电解质和弱电解质
2.【答案】C
【知识点】盐类水解的原理;中和滴定
3.【答案】B
【知识点】弱电解质在水溶液中的电离平衡
4.【答案】A
【知识点】强电解质和弱电解质
5.【答案】C
【知识点】中和滴定
6.【答案】D
【知识点】难溶电解质的溶解平衡及沉淀转化的本质;硫酸根离子的检验;氯水、氯气的漂白作用
7.【答案】B,D
【知识点】弱电解质在水溶液中的电离平衡;水的电离;电离平衡常数
8.【答案】A,C
【知识点】弱电解质在水溶液中的电离平衡;中和滴定;电离平衡常数
9.【答案】①④⑤;⑥⑧⑨;④⑤;①
【知识点】电解质与非电解质;强电解质和弱电解质
10.【答案】酸;Al3++3H2O Al(OH)3+3H+;Al2O3
【知识点】溶液酸碱性的判断及相关计算;离子方程式的书写
11.【答案】K2CO3 :CO32- + H2O HCO3- + OH-,HCO3-+H2O H2CO3+OH-;碱;K2SO4 :不发生水解;中;CuCl2 :Cu2++2H2O Cu(OH)2+2H+;酸
【知识点】盐类水解的原理
12.【答案】c(K+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
【知识点】盐类水解的应用
13.【答案】(1);
(2);;将氧化,与反应的的量减少,产生的会使催化剂中毒
(3)粉煤灰中的氨含量;部分被氧化为,与、反应生成溶于水呈酸性
【知识点】氧化还原反应;氧化还原反应方程式的配平;化学反应速率的影响因素;中和滴定
14.【答案】测定土壤溶液pH的操作过程为:①采取土样;②将土样溶解;③待溶液澄清后,进行pH测定;
所用三种主要玻璃仪器为:烧杯、玻璃棒、点滴板
【知识点】测定溶液pH的方法
15.【答案】(1)冷凝管(或球形冷凝管);2Na2O2+2H2O=4NaOH+O2↑(或2H2O2 2H2O+O2↑)
(2)平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质)
(3)加快反应速率,同时防止PCl3气化,逸出损失
(4)b;溶液刚好变为红色,且半分钟内不褪色; ×100%[或 % ];防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN溶液;偏小
【知识点】探究沉淀溶解;钠的氧化物
16.【答案】(1)CO2;Na2CO3
(2)③⑥;①②⑤;④;⑤
【知识点】电解质与非电解质;强电解质和弱电解质;物质的简单分类
17.【答案】(1)0.2;0.3;0.8
(2)40.2
(3)0.8
【知识点】电解质在水溶液中的电离;物质的量浓度
18.【答案】(1)④⑧⑨
(2)②⑥⑦⑩
(3)①⑤⑧
(4)K+、、Al3+、Mg2+;Fe2+、Cu2+、Ba2+、
(5)(滴加稀硝酸酸化),滴加几滴硝酸银溶液,若有白色沉淀,则含;若无白色沉淀产生,则不含
(6)
(7)
【知识点】电解质与非电解质;强电解质和弱电解质;离子共存
21世纪教育网(www.21cnjy.com)
1 / 11
【高中化学人教版(2019)选择性必修1同步练习】
第三章 水溶液中的离子反应与平衡综合检测题
一、单选题
1.下列物质中,既是强电解质又属于离子化合物的是( )
A.醋酸 B.碘化氢
C.硫酸 D.苛性钠
2.0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确是( )
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
3.下列事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可以使酚酞试液变红
②0.1mol/L的氯化铵溶液的pH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱
④铵盐受热易分解.
A.①② B.②③ C.③④ D.②④
4.下列物质中,属于弱电解质的是( )
A.CH3COOH B.KOH C.BaSO4 D.CH3COONa
5.室温下,用0.1000mol·L-1CH3COOH标准溶液滴定20.00mL未知浓度的NaOH溶液,pH随CH3COOH溶液体积的变化如图所示。下列说法不正确的是( )
A.滴定时应选择酚酞作指示剂
B.反应终点时,c2(H+)+c(H+)·c(CH3COOH)=10-14
C.选择甲基红作指示剂,会导致所测c(NaOH)偏小
D.标准溶液改用等浓度的盐酸,突变范围会变大
6.根据实验操作及现象,能得出相应结论的是
实验操作及现象 结论
A 向氯水中加入一定量铁粉,充分振荡后滴加几滴KSCN溶液,溶液呈浅绿色 该氯水为久置氯水
B 向少量FeS悬浊液中加入足量饱和溶液,沉淀颜色变为浅红色(MnS)
C 取少量待测液于试管中,加几滴盐酸酸化溶液,产生白色沉淀 溶液中含有
D 向某无色溶液中先加入少量氯水,再加入,振荡,下层溶液呈紫红色 原溶液中一定存在
A.A B.B C.C D.D
二、多选题
7.室温下,向两份浓度均为0.1 mol/L的HX溶液中分别滴加0.1 mol/L的盐酸和NaOH溶液,向两份0.1 mol/L的HY溶液中也进行同样操作,测得x[,其中A=X或Y]与溶液pH的关系如图所示。
已知:Ka(HX)>Ka(HY)。下列说法正确的是( )
A.溶液中水的电离程度:a>b>c
B.d点溶液中:c(HA)+c(A-)<0.10 mol/L
C.b点到c点之间,c(Na+)始终大于c(A-)
D.NaY溶液中的Kh=1.0×10-9.25
8.已知某温度时CH3COOH 的电离平衡常数为K,该温度下向 20mL 0.1mol·L-1 CH3COOH 溶液中逐滴加入0.1mol·L-1NaOH 溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
A.a 点表示溶液中c(CH3COO-)=10-3 mol·L-1
B.b 点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d 点表示的溶液中 均等于K
三、填空题
9.下列物质:①水 ② 稀硫酸 ③盐酸 ④烧碱 ⑤硝酸钾 ⑥酒精 ⑦碘酒 ⑧蔗糖 ⑨NH3
(用编号回答)其中属于
电解质的是: 。
非电解质的是: 。
强电解质的是 。
弱电解质的是 。
10.氯化铝水溶液呈 性,原因是(用离子方程式表示): .把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
11.下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
12.在K2CO3的溶液中,各离子的物质的量浓度由大到小的顺序是 .
13.高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为 (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成释放到烟气中,该反应的化学方程式为 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将、NO、转化为。烟气中含有的会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为 (填化学式)。
②研究发现砷中毒机理主要是分子破坏了催化剂的Lewis酸位点,使数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构 。
③不易使催化剂中毒。但与相比,更不利于脱硝反应的进行,其原因是 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(或铵盐)会影响水泥的性能。
①取50.00 g粉煤灰加入NaOH蒸出,用20 mL 0.1000 mol L的溶液吸收,用0.2000mol L NaOH溶液滴定过量的至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以计的氨含量 (用mg g表示,写出计算过程)。
②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是 。
四、解答题
14.写出测定土壤溶液pH的操作过程和所用三种主要玻璃仪器的名称.
五、实验探究题
15.三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
有关物质的部分性质如下表:
熔点/℃ 沸点/℃ 其他
PCl3 -112 75.5 遇水生成H3PO3和HCl,遇O2生成POCl3
POCl3 2 105.3 遇水生成H3PO4和HCl,能溶于PCl3
回答下列问题:
(1)仪器a的名称是 ,装置A中发生反应的化学方程式为 。
(2)B装置的作用除观察O2的流速之外。还有 。
(3)C装置控制反应在60℃~65℃进行,其主要目的是 。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (填标号),滴定终点的现象为 。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式) 。
③步骤III加入硝基苯的目的是 ,如无此操作,所测Cl元素含量将会 (填“偏大”“偏小”或“不变”)。
六、综合题
16.完成下列填空
(1)下列两组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO
B.NaOH、Na2CO3、KOH、Cu(OH)2
这两种物质依次是(填化学式):A ;B .
(2)①NaCl(S) ②HCl(l) ③Cu ④酒精 ⑤液态醋酸⑥KNO3溶液填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;属于弱电解质的是 .
17.在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为 moL,MgCl2的物质的量为 moL,Cl﹣的物质的量为 moL.
(2)该混合溶液中含溶质的总质量为 g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 moL L﹣1.
七、推断题
18.
(1)I.回答下列问题
现有以下物质:①晶体②③液态醋酸④铜⑤固体⑥纯蔗糖()⑦酒精()⑧熔化的⑨氨水⑩液氨。
请回答下列问题。(填相应序号)
以上物质能导电的是 ;
(2)以上物质属于非电解质的是 ;
(3)以上物质属于强电解质的是 ;
(4)Ⅱ.有一无色溶液,其中可能含有等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下:
(ⅰ)用洁净的铂丝蘸取少量溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色。
(ⅱ)取少量原溶液,滴加足量溶液,有白色沉淀产生,再滴加足量的稀硝酸,无气泡产生且沉淀不溶解,过滤得到滤液a。
(ⅲ)另取少量原溶液,逐滴滴加过量的溶液,白色沉淀先增多后减少,但不完全溶解。
原溶液中一定存在的离子有 ;一定不存在的离子有 。
(5)补齐检验溶液中不能确定离子的操作:取少量滤液a, 。
(6)写出第(ⅲ)个实验中白色沉淀减少过程中发生的离子反应方程式: 。
(7)结合实验(ⅲ),你认为实验室制备,用可溶性铝盐和 反应更佳(填化学式)。
答案解析部分
1.【答案】D
【知识点】离子化合物的结构特征与性质;强电解质和弱电解质
2.【答案】C
【知识点】盐类水解的原理;中和滴定
3.【答案】B
【知识点】弱电解质在水溶液中的电离平衡
4.【答案】A
【知识点】强电解质和弱电解质
5.【答案】C
【知识点】中和滴定
6.【答案】D
【知识点】难溶电解质的溶解平衡及沉淀转化的本质;硫酸根离子的检验;氯水、氯气的漂白作用
7.【答案】B,D
【知识点】弱电解质在水溶液中的电离平衡;水的电离;电离平衡常数
8.【答案】A,C
【知识点】弱电解质在水溶液中的电离平衡;中和滴定;电离平衡常数
9.【答案】①④⑤;⑥⑧⑨;④⑤;①
【知识点】电解质与非电解质;强电解质和弱电解质
10.【答案】酸;Al3++3H2O Al(OH)3+3H+;Al2O3
【知识点】溶液酸碱性的判断及相关计算;离子方程式的书写
11.【答案】K2CO3 :CO32- + H2O HCO3- + OH-,HCO3-+H2O H2CO3+OH-;碱;K2SO4 :不发生水解;中;CuCl2 :Cu2++2H2O Cu(OH)2+2H+;酸
【知识点】盐类水解的原理
12.【答案】c(K+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
【知识点】盐类水解的应用
13.【答案】(1);
(2);;将氧化,与反应的的量减少,产生的会使催化剂中毒
(3)粉煤灰中的氨含量;部分被氧化为,与、反应生成溶于水呈酸性
【知识点】氧化还原反应;氧化还原反应方程式的配平;化学反应速率的影响因素;中和滴定
14.【答案】测定土壤溶液pH的操作过程为:①采取土样;②将土样溶解;③待溶液澄清后,进行pH测定;
所用三种主要玻璃仪器为:烧杯、玻璃棒、点滴板
【知识点】测定溶液pH的方法
15.【答案】(1)冷凝管(或球形冷凝管);2Na2O2+2H2O=4NaOH+O2↑(或2H2O2 2H2O+O2↑)
(2)平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质)
(3)加快反应速率,同时防止PCl3气化,逸出损失
(4)b;溶液刚好变为红色,且半分钟内不褪色; ×100%[或 % ];防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN溶液;偏小
【知识点】探究沉淀溶解;钠的氧化物
16.【答案】(1)CO2;Na2CO3
(2)③⑥;①②⑤;④;⑤
【知识点】电解质与非电解质;强电解质和弱电解质;物质的简单分类
17.【答案】(1)0.2;0.3;0.8
(2)40.2
(3)0.8
【知识点】电解质在水溶液中的电离;物质的量浓度
18.【答案】(1)④⑧⑨
(2)②⑥⑦⑩
(3)①⑤⑧
(4)K+、、Al3+、Mg2+;Fe2+、Cu2+、Ba2+、
(5)(滴加稀硝酸酸化),滴加几滴硝酸银溶液,若有白色沉淀,则含;若无白色沉淀产生,则不含
(6)
(7)
【知识点】电解质与非电解质;强电解质和弱电解质;离子共存
21世纪教育网(www.21cnjy.com)
1 / 11
