考点7 化学反应速率与化学平衡—高考化学一轮复习考点创新题训练(含解析)
文档属性
| 名称 | 考点7 化学反应速率与化学平衡—高考化学一轮复习考点创新题训练(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-05 14:12:35 | ||
图片预览



文档简介
考点7 化学反应速率与化学平衡—高考化学一轮复习考点创新题训练
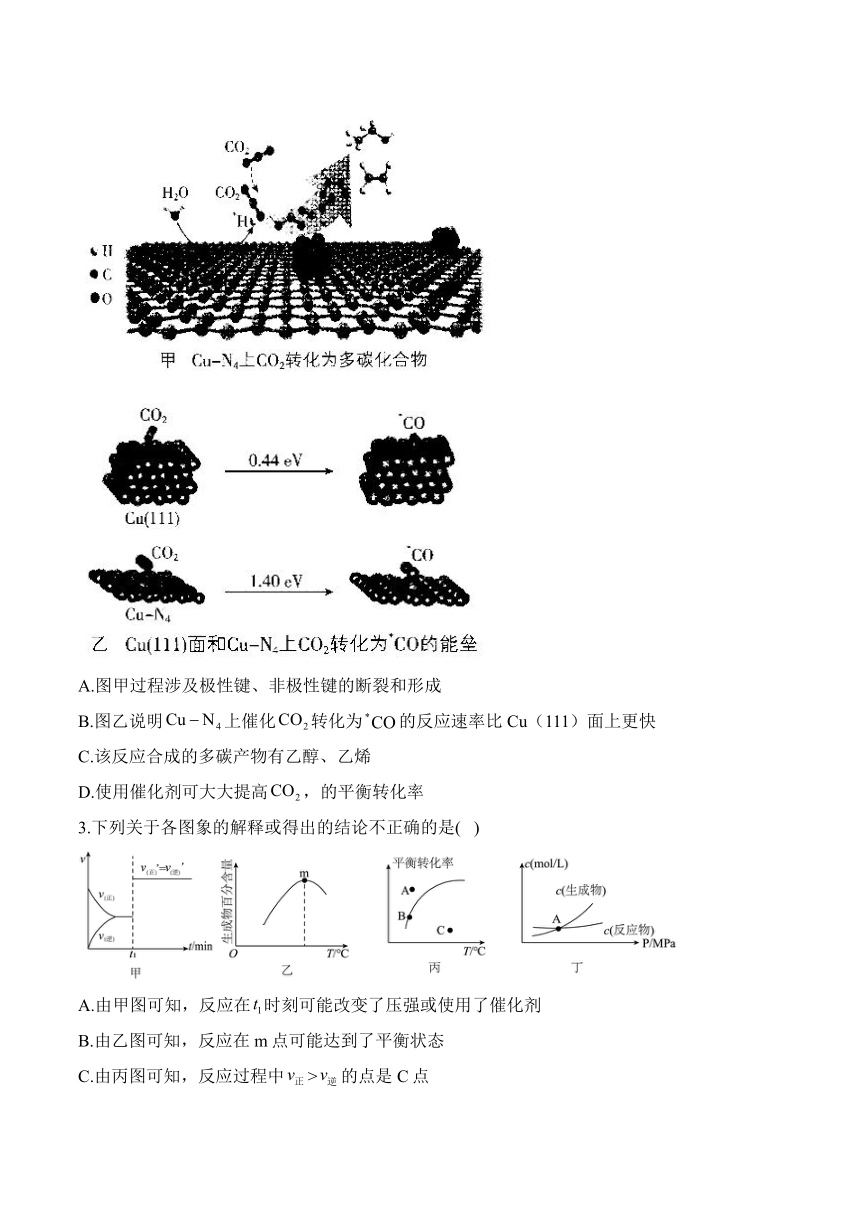
1.苯乙烯是合成橡胶的重要单体,工业上利用如下反应制备:
压强恒为1 atm条件下,采用三种不同投料方式:Ⅰ.(乙苯):=1:10、Ⅱ. (乙苯):=1:10、Ⅲ.仅乙苯,分别反应达到平衡时,乙苯的转化率与温度的关系如图所示,已知K,为用平衡分压代替平衡浓度得到的平衡常数。
下列说法不正确的是( )
A.其他条件不变时,升高温度平衡正向移动
B.相同条件下投料方式为(乙苯): =1:10时的a最高的原因可能是与发生反应
C.计算720 K时投料方式为(乙苯): =1:10的
D.生产时为了防止积碳并保持催化剂活性,可用水蒸气代替
2.电催化还原是一种典型的涉及两种反应物(和)的反应。某科研团队构建了一种双活性位点催化剂,实现了多碳产物的高效电合成,催化反应过程如图所示,下列说法正确的是( )
A.图甲过程涉及极性键、非极性键的断裂和形成
B.图乙说明上催化转化为的反应速率比Cu(111)面上更快
C.该反应合成的多碳产物有乙醇、乙烯
D.使用催化剂可大大提高,的平衡转化率
3.下列关于各图象的解释或得出的结论不正确的是( )
A.由甲图可知,反应在时刻可能改变了压强或使用了催化剂
B.由乙图可知,反应在m点可能达到了平衡状态
C.由丙图可知,反应过程中>的点是C点
D.由丁图可知,交点A表示反应一定处于平衡状态,此时=
4.在-30℃时,阳离子和分子耦合生成阳离子,反应中自由能变化示意图如下。
下列说法正确的是( )
A.该过程可以自发进行 B.三种微粒互为同素异形体
C.有两种化学环境的磷原子 D.单电子氧化可制备分子
5.25℃时,PbR(为或)的沉淀溶解平衡关系如下图所示。已知。下列说法错误的是( )
A.线α表示
B.Y点溶液是的不饱和溶液
C.的平衡常数为
D.向X点对应的悬浊液中加少量水,可转化为Y点
6.一定压强下,向密闭容器中充入和,发生反应。与的消耗速率与温度的关系如图,下列说法正确的是( )
A.四点中只有A点达到平衡状态
B.正反应的活化能小于逆反应的活化能
C.
D.,反应达平衡后缩小容器体积,各物质浓度不变
7.向一恒容密闭容器中,加入1mol和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法正确的是( )
A.投料比:
B.正反应速率:
C.压强:
D.投料比为时d点浓度商Q大于c点平衡常数K
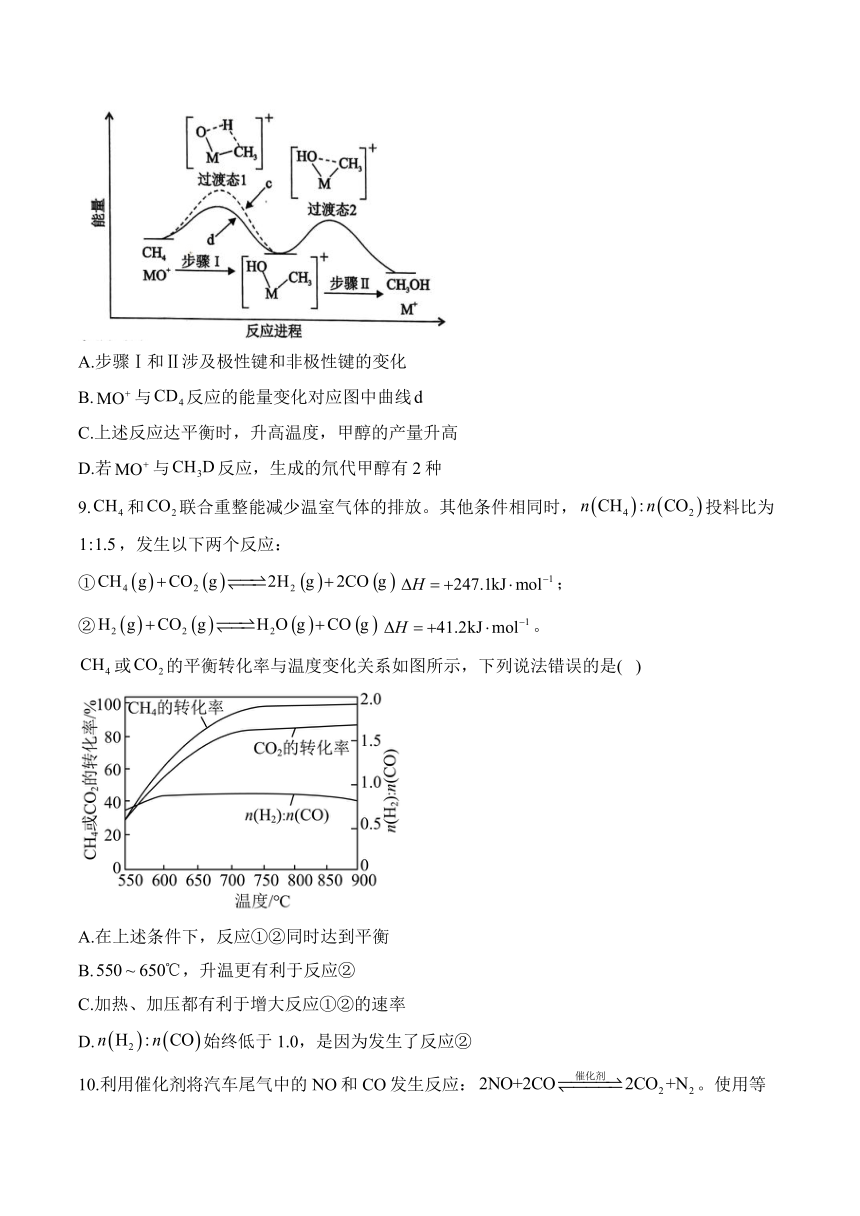
8.分别与、反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是( )
A.步骤Ⅰ和Ⅱ涉及极性键和非极性键的变化
B.与反应的能量变化对应图中曲线
C.上述反应达平衡时,升高温度,甲醇的产量升高
D.若与反应,生成的氘代甲醇有2种
9.和联合重整能减少温室气体的排放。其他条件相同时,投料比为,发生以下两个反应:
①;
②。
或的平衡转化率与温度变化关系如图所示,下列说法错误的是( )
A.在上述条件下,反应①②同时达到平衡
B.,升温更有利于反应②
C.加热、加压都有利于增大反应①②的速率
D.始终低于1.0,是因为发生了反应②
10.利用催化剂将汽车尾气中的NO和CO发生反应:。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如下表。已知:x>y>z,下列分析错误的是( )
实验编号 温度(℃) NO起始浓度() CO起始浓度() 催化剂比表面积() CO平衡浓度() 平衡时间(min)
1 280 6.5×10-3 4.0×10-3 80 a x
2 280 6.5×10-3 4.0×10-3 120 1.0×10-3 y
3 360 6.5×10-3 4.0×10-3 80 2.0×10-3 z
A.对比实验1、2可知,
B.实验2中,CO平衡转化率为75%
C.对比实验1、2可知,增大催化剂比表面积可加快反应速率
D.对比实验1、3可知,该反应的
11.冠醚能与碱金属离子结合(如图所示),是有机反应很好的催化剂,能加快与环己烯的反应速率。
用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大两者结合能力越强。
碱金属离子 结合常数 冠醚 (直径:204pm) (直径:276pm)
冠醚A(空腔直径:260~320pm) 199 1183
冠醚B(空腔直径:170~220pm) 371 312
下列说法不正确的是( )
A.推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关
B.实验 中:①>②>③
C.冠醚通过与结合将携带进入有机相,从而加快反应速率
D.为加快与环己烯的反应速率,选择冠醚A比冠醚B更合适
12.已知是一种有机二元弱碱。常温下,某溶液中的物质的量浓度之和为,测得溶液中含微粒的分布系数随变化如图所示。下列说法正确的是( )
A.曲线①表示
B.常温下,时溶液中
C.等体积、等物质的量浓度的溶液与盐酸混合后,溶液中:
D.的平衡常数
13.氨氧化法是工业制硝酸的常见方法。
第一步:合成氨。
(1)传统方法:在恒温恒容的密闭容器中,进行如下化学反应:,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。
A.通过更换不同种类的催化剂,可以调节平衡时原料的转化率
B.反应装置保持在相对较低的温度下,将有利于该反应的自发进行
C.在反应过程中任意时刻移除部分产物,都可以使反应正向进行,但该反应的平衡常数保持不变
D.当检测到装置内的保持不变时,不一定能说明反应已经达到平衡状态
(2)铁基循环制氨:如图所示,工作时,使用熔融的电解质通过两步循环实现氨的合成,该工艺合成氨的化学方程式为_______。
(3)电解法在常温常压下实现合成氨:工作时,电极生成的微观示意图如图所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成的电极反应式为_______。
第二步:氮氧化物的制备。
(4)氨催化氧化生成后,氧化生成的总反应为,可分两步进行,其反应过程中的能量变化示意图如图所示:
.
.
决定氧化反应速率的步骤是_______(填“”或“”)。
(5)已知:,将一定物质的量的充入某恒容密闭容器中,测得不同温度下和的平衡体积分数如图所示:
①代表的曲线是_______(填“”或“”)。
②假设平衡时体系的总压为,则A点温度下的平衡常数_______(用含的表达式表示),的平衡转化率_______(保留3位有效数字)。
第三步;硝酸的制备。
(6)已知:,则_______。
14.用下列反应处理航天员呼吸产生的,可实现空间站中的循环利用。
Sabatier反应:
光解水反应:
(1)Sabatier反应的能量变化如图,该反应是_________(填“放热”或“吸热”)反应。已知、、的键能分别为、、,则的键能为_________。
(2)在恒温、恒容的密闭体系中,仅发生Sabatier反应,下列描述能说明该反应已经达到最大限度的是___________(填字母)。
A.的体积分数不再改变
B.、、、的物质的量之比为1:4:1:2
C.单位时间内,消耗同时生成
D.单位时间内,断裂键的同时断裂键
(3)120℃时将和通入的恒容密闭容器中发生Sabatier反应,测得部分物质的物质的量随时间的变化如图。
①在0 4min内,_________。
②4min末,消耗的速率_________生成的速率(填“>”“<”或“=”)。
(4)光解水反应是采用新型复合光催化剂(),使水在太阳光下高效分解,原理如图。
该反应的能量转化形式为_________。反应Ⅰ的化学方程式为_________。
15.甲基叔戊基醚(TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇(简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(B为2-甲基-1-丁烯的简写,不考虑其他副反应):
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)磷钼酸()可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似。基态钼原子的价层电子排布式为_____。
(2)比较_____(填“>”、“<”或“=”)。
(3)我国学者团队对制备TAME反应的催化剂进行了研究。研究表明:用不同浓度(1~3%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。用浓度分别为1%、2%、3%的磷钼酸浸渍催化剂进行了三组实验,得到随时间的变化曲线如图所示。
①用3%的磷钼酸浸渍时,在4~6h内,T的平均生成速率为_____。
②下列说法正确的有_____。
A.三组实验中,反应速率都随反应进程一直增大
B.平衡后加入惰性溶剂四氢呋喃稀释,减小
C.催化剂可加快化学反应速率,提高甲醇的平衡转化率
D.降低温度,反应ⅰ和ⅱ的正、逆反应速率都减小
E.达到平衡后,加入M,不变
(4)研究团队继续研究其他条件不变时,不同醇烯比(甲醇M与烯烃A的起始物质的量浓度之比)对平衡的影响,当A起始浓度时,测得平衡时B和T的随的变化曲线如图。
当时,计算反应i的平衡常数_____(保留小数点后两位)。
答案以及解析
1.答案:C
解析:由题图可知,三种投料方式下,随温度升高,乙苯的转化率均逐渐增大,因此该反应为吸热反应,其他条件不变时,升高温度平衡正问移动,A正确;投料方式为时的α最高,可能的原因是与反应生成的发生反应:,使减小,促使平衡向问正反应方向移动,使乙苯的转化率增大,B正确;。只与温度有关,因此同温度下三种不同投料方式下反应的。相同,因此可以由题图中α点数据求720K时反应的。由于压强恒为1 atm,则由α点时乙苯转化率为10%可知,平衡时,,则代入可得,C错误;生产时用水蒸气代替,水蒸气与积碳发生反应:,可防止积碳并保持催化剂活性,D正确。
2.答案:C
解析:题图甲过程涉及O—H键等极性键的断裂,C—H键等极性键、C—C键等非极性键的形成,无非极性键的断裂,A错误;由题图乙知上转化为的能垒比Cu(111)面上高,说明上催化转化为的反应速率较慢,B错误;题图甲中产物有乙醇、乙烯,C正确;催化剂只能改变反应速率,不能改变平衡转化率,D错误。
3.答案:D
解析:A.改变条件后,正逆反应速率增大且相等,可能是加了催化剂;对前后气体分子数相等的化学反应,也可能是加压,A正确;
B.已知生成物的百分含量随温度的升高而增大,m为曲线的最高点,生成物的百分含量达到最大值,即建立了相应温度下的平衡状态,B正确;
C.曲线上B点表示在此温度下反应达到平衡时所能达到的最大转化率,A位于曲线以上,表示超过该温度下的最大转化率,此时平衡会向逆反应方向移动,>;C点位于曲线以下,表示未达到该温度下的最大转化率,此时平衡会向正反应方向移动,>,C正确;
D.A点时c(反应物)=c(生成物),不一定达到平衡状态,D错误;
答案选D。
4.答案:A
解析:A.由图可知,产物总自由能小于反应物总自由能,即,反应可自发进行,A正确;
B.同素异形体是指由同种元素组成而性质不同的单质,和是离子,不是单质,则三种微粒不互为同素异形体,B错误;
C.中所有磷原子均为sp3杂化,只有一种化学环境的磷原子,C错误;
D.制备需要得到一个电子,发生还原反应,D错误;
故选A。
5.答案:D
解析:略
6.答案:B
解析:A.A点,未达到平衡,故A错误;
B.随着温度升高,的消耗速率大于的消耗速率的二倍,则逆反应速率大于正反应速率,说明温度升高,平衡逆向移动,是放热反应,则正反应的活化能小于逆反应的活化能,故B正确;
C.该反应为放热反应,温度升高,K减小,由图可知,C点温度最低,则K最大,故,故C错误;
D.300℃时,反应达平衡后缩小容器体积,平衡不移动,但是体积缩小,各组分浓度均增加,故D错误。
故选B。
7.答案:C
解析:略
8.答案:D
解析:A.步骤I涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,不涉及非极性键的变化,A错误;
B.已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢,活化能变大,则与反反应的能量变化应为图中曲线c,反应的活化能更大,B错误;
C.由图可知,生成物能量低于反应物的能量,则反应为放热反应,升高温度,平衡逆向移动,甲醇产量减小,C错误;
D.根据反应机理可知,若与反应,生成的氘代甲醇可能为或,共两种,D正确;
故选D。
9.答案:B
解析:A.反应①②同时发生,反应②会破坏反应①的平衡,所以两个反应应该同时达到平衡,故A正确;
B.由图可知,550~600℃条件下,甲烷的转化率大于二氧化碳的转化率,说明升温更有利于反应①,故B错误;
C.升高温度和增大压强,化学反应速率均增大,则加热、加压时,反应①②的反应速率均会增大,故C正确;
D.由方程式可知,反应①中氢气与一氧化碳的物质的量比始终为1.0,则氢气与一氧化碳的物质的量比始终低于1.0说明发生了反应②,故D正确;
故选B。
10.答案:D
解析:A.结合实验目的可知,实验1、2是验证催化剂比表面积对化学反应速率的影响,催化剂只影响反应速率不影响化学平衡,故达到平衡时,CO平衡浓度相同,即,故A正确;
B.由表格数据可知,实验2中,CO转化浓度为,平衡转化率为,故B正确;
C.对比实验1、2可知,实验2到达平衡的时间比实验1到达平衡的时间短,说明反应速率大,实验2的催化剂比表面积比实验1的大,可知,增大催化剂比表面积可加快反应速率,故C正确;
D.结合实验目的可知,实验1、3是验证温度对化学反应速率的影响,实验3的温度比实验1的温度高,平衡时,实验3中CO平衡浓度比实验1中CO平衡浓度大,即平衡逆向移动,温度升高平衡向吸热方向移动,说明升高温度,该反应正向移动,该反应为放热反应,即该反应的,故D错误;
故选D。
11.答案:B
解析:A.从表中数据可以看出,冠醚的空腔直径与或直径接近时,结合常数大,由此可推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关,A正确;
B.冠醚A结合的能力弱于结合的能力,所以可将冠醚A中的部分替代出来,由实验 中,可得出:①>③>②,B不正确;
C.冠醚与结合,从而将携带进入有机相,催化与环己烯的反应,从而加快反应速率,C正确;
D.由表中数据可推出,冠醚A结合的能力比冠醚B强,为加快与环己烯的反应速率,选择冠醚A比冠醚B更合适,D正确;
故选B。
12.答案:B
解析:B.当pH=11时,,根据,则,故B正确。
13.答案:(1)BCD
(2)
(3)
(4)
(5)b;;
(6)-447.3
解析:(1)A.催化剂不能使平衡移动,通过更换不同种类的催化剂,不能改变平衡时原料的转化率,故A错误;
B.该反应焓变小于0、熵变小于0,反应装置保持在相对较低的温度下,将有利于该反应的自发进行,故B正确;
C.平衡常数只与温度有关,在反应过程中任意时刻移除部分产物,都可以使反应正向进行,但该反应的平衡常数保持不变,故C正确;
D.若投料比等于系数比,是恒量,当检测到装置内的保持不变时,不一定能说明反应已经达到平衡状态,故D正确;
选BCD。
(2)根据图示,氮气、水反应生成氨气和氧气,该工艺合成氨的化学方程式为。
(3)根据图示,氮气得电子生成氨气,电极上生成的电极反应式为。
(4)活化能越大,反应速率越慢,慢反应决定总反应速率,决定氧化反应速率的步骤是II。
(5)①正反应放热,升高温度、平衡逆向移动,含量增大,代表的曲线是。
②假设平衡时体系的总压为,由图可知,A点温度下,和的体积分数相等,则和的分压均为,则A点温度下的平衡常数,设初始通入amol,转化的的物质的量为xmol,a-x=0.5x,x=,的平衡转化率。
(6)①
②,则根据盖斯定律,将①×3+②×2得。
14.答案:(1)放热;462
(2)AD
(3);=
(4)光能转化为化学能(或太阳能转化为化学能);
解析:(1)该反应反应物总能量高于生成物总能量,为放热反应;由图可知,Sabatier反应的反应热=-260kJ/mol=反应物总键能-生成物总键能,设O-H键的键能为xkJ/mol,故,解得x=462,故的键能为:462kJ/mol;
(2)A.的体积分数不再改变时,该反应达到最大限度,A正确;
B.、、、的物质的量之比为1:4:1:2,不能判断达到最大限度,B错误;
C.单位时间内,消耗同时生成,均为正反应方向,不能判断达到最大限度,C错误;
D.单位时间内,断裂(消耗1molH2)键的同时断裂键(消耗0.5molH2O),正逆反应速率相等,能判断达到最大限度,D正确;
故选AD;
(3)①在0 4min内,;
②4min末,消耗氢气4mol,生成甲烷1mol,10min时甲烷的物质的量仍为1mol,故4min已经达到平衡,正逆反应速率相等,故消耗的速率=生成的速率;
(4)由图可知:反应I为,反应II为:。
水在太阳光下高效分解,能量转化形式为:光能转化为化学能(或太阳能转化为化学能);反应Ⅰ的化学方程式为:。
15.答案:(1)
(2)>
(3);BDE
(4)6.25
解析:(1)已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似,Cr价电子排布式为,则基态钼原子的价层电子排布式为;故答案为:。
(2)根据第一个方程式是第三个方程式减去第二个方程式得到,则>;故答案为:>。
(3)①根据用不同浓度(1~3%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。则曲线是代表为3%的磷钼酸浸渍时,在4~6h内,T的平均生成速率为;故答案为:。
②A.三组实验中,磷钼酸的浓度逐渐减少,反应速率都随反应进行一直减小,故A错误;
B.平衡后加入惰性溶剂四氢呋喃稀释,c(A)减小,反应ⅰ的平衡常数不变,减小,故B正确;C.催化剂可加快化学反应速率,但不能提高甲醇的平衡转化率,故C错误;D.降低温度,速率都减小即反应ⅰ和ⅱ的正、逆反应速率都减小,故D正确;E.达到平衡后,c(T)不变,反应ⅱ平衡逆向移动,c(B)减小,但反应ⅲ平衡常数只与温度有关,故E正确;综上所述,答案为:BDE。
(4)根据题中A起始浓度时,则,
,则,,则反应ⅰ的平衡常数;故答案为:6.25。
1.苯乙烯是合成橡胶的重要单体,工业上利用如下反应制备:
压强恒为1 atm条件下,采用三种不同投料方式:Ⅰ.(乙苯):=1:10、Ⅱ. (乙苯):=1:10、Ⅲ.仅乙苯,分别反应达到平衡时,乙苯的转化率与温度的关系如图所示,已知K,为用平衡分压代替平衡浓度得到的平衡常数。
下列说法不正确的是( )
A.其他条件不变时,升高温度平衡正向移动
B.相同条件下投料方式为(乙苯): =1:10时的a最高的原因可能是与发生反应
C.计算720 K时投料方式为(乙苯): =1:10的
D.生产时为了防止积碳并保持催化剂活性,可用水蒸气代替
2.电催化还原是一种典型的涉及两种反应物(和)的反应。某科研团队构建了一种双活性位点催化剂,实现了多碳产物的高效电合成,催化反应过程如图所示,下列说法正确的是( )
A.图甲过程涉及极性键、非极性键的断裂和形成
B.图乙说明上催化转化为的反应速率比Cu(111)面上更快
C.该反应合成的多碳产物有乙醇、乙烯
D.使用催化剂可大大提高,的平衡转化率
3.下列关于各图象的解释或得出的结论不正确的是( )
A.由甲图可知,反应在时刻可能改变了压强或使用了催化剂
B.由乙图可知,反应在m点可能达到了平衡状态
C.由丙图可知,反应过程中>的点是C点
D.由丁图可知,交点A表示反应一定处于平衡状态,此时=
4.在-30℃时,阳离子和分子耦合生成阳离子,反应中自由能变化示意图如下。
下列说法正确的是( )
A.该过程可以自发进行 B.三种微粒互为同素异形体
C.有两种化学环境的磷原子 D.单电子氧化可制备分子
5.25℃时,PbR(为或)的沉淀溶解平衡关系如下图所示。已知。下列说法错误的是( )
A.线α表示
B.Y点溶液是的不饱和溶液
C.的平衡常数为
D.向X点对应的悬浊液中加少量水,可转化为Y点
6.一定压强下,向密闭容器中充入和,发生反应。与的消耗速率与温度的关系如图,下列说法正确的是( )
A.四点中只有A点达到平衡状态
B.正反应的活化能小于逆反应的活化能
C.
D.,反应达平衡后缩小容器体积,各物质浓度不变
7.向一恒容密闭容器中,加入1mol和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法正确的是( )
A.投料比:
B.正反应速率:
C.压强:
D.投料比为时d点浓度商Q大于c点平衡常数K
8.分别与、反应生成甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是( )
A.步骤Ⅰ和Ⅱ涉及极性键和非极性键的变化
B.与反应的能量变化对应图中曲线
C.上述反应达平衡时,升高温度,甲醇的产量升高
D.若与反应,生成的氘代甲醇有2种
9.和联合重整能减少温室气体的排放。其他条件相同时,投料比为,发生以下两个反应:
①;
②。
或的平衡转化率与温度变化关系如图所示,下列说法错误的是( )
A.在上述条件下,反应①②同时达到平衡
B.,升温更有利于反应②
C.加热、加压都有利于增大反应①②的速率
D.始终低于1.0,是因为发生了反应②
10.利用催化剂将汽车尾气中的NO和CO发生反应:。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如下表。已知:x>y>z,下列分析错误的是( )
实验编号 温度(℃) NO起始浓度() CO起始浓度() 催化剂比表面积() CO平衡浓度() 平衡时间(min)
1 280 6.5×10-3 4.0×10-3 80 a x
2 280 6.5×10-3 4.0×10-3 120 1.0×10-3 y
3 360 6.5×10-3 4.0×10-3 80 2.0×10-3 z
A.对比实验1、2可知,
B.实验2中,CO平衡转化率为75%
C.对比实验1、2可知,增大催化剂比表面积可加快反应速率
D.对比实验1、3可知,该反应的
11.冠醚能与碱金属离子结合(如图所示),是有机反应很好的催化剂,能加快与环己烯的反应速率。
用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大两者结合能力越强。
碱金属离子 结合常数 冠醚 (直径:204pm) (直径:276pm)
冠醚A(空腔直径:260~320pm) 199 1183
冠醚B(空腔直径:170~220pm) 371 312
下列说法不正确的是( )
A.推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关
B.实验 中:①>②>③
C.冠醚通过与结合将携带进入有机相,从而加快反应速率
D.为加快与环己烯的反应速率,选择冠醚A比冠醚B更合适
12.已知是一种有机二元弱碱。常温下,某溶液中的物质的量浓度之和为,测得溶液中含微粒的分布系数随变化如图所示。下列说法正确的是( )
A.曲线①表示
B.常温下,时溶液中
C.等体积、等物质的量浓度的溶液与盐酸混合后,溶液中:
D.的平衡常数
13.氨氧化法是工业制硝酸的常见方法。
第一步:合成氨。
(1)传统方法:在恒温恒容的密闭容器中,进行如下化学反应:,对该反应的条件进行探究,下列实验措施与结论正确对应的是___________(填字母)。
A.通过更换不同种类的催化剂,可以调节平衡时原料的转化率
B.反应装置保持在相对较低的温度下,将有利于该反应的自发进行
C.在反应过程中任意时刻移除部分产物,都可以使反应正向进行,但该反应的平衡常数保持不变
D.当检测到装置内的保持不变时,不一定能说明反应已经达到平衡状态
(2)铁基循环制氨:如图所示,工作时,使用熔融的电解质通过两步循环实现氨的合成,该工艺合成氨的化学方程式为_______。
(3)电解法在常温常压下实现合成氨:工作时,电极生成的微观示意图如图所示,其中电解液为溶有三氟甲硝酸锂和乙醇的惰性有机溶剂。电极上生成的电极反应式为_______。
第二步:氮氧化物的制备。
(4)氨催化氧化生成后,氧化生成的总反应为,可分两步进行,其反应过程中的能量变化示意图如图所示:
.
.
决定氧化反应速率的步骤是_______(填“”或“”)。
(5)已知:,将一定物质的量的充入某恒容密闭容器中,测得不同温度下和的平衡体积分数如图所示:
①代表的曲线是_______(填“”或“”)。
②假设平衡时体系的总压为,则A点温度下的平衡常数_______(用含的表达式表示),的平衡转化率_______(保留3位有效数字)。
第三步;硝酸的制备。
(6)已知:,则_______。
14.用下列反应处理航天员呼吸产生的,可实现空间站中的循环利用。
Sabatier反应:
光解水反应:
(1)Sabatier反应的能量变化如图,该反应是_________(填“放热”或“吸热”)反应。已知、、的键能分别为、、,则的键能为_________。
(2)在恒温、恒容的密闭体系中,仅发生Sabatier反应,下列描述能说明该反应已经达到最大限度的是___________(填字母)。
A.的体积分数不再改变
B.、、、的物质的量之比为1:4:1:2
C.单位时间内,消耗同时生成
D.单位时间内,断裂键的同时断裂键
(3)120℃时将和通入的恒容密闭容器中发生Sabatier反应,测得部分物质的物质的量随时间的变化如图。
①在0 4min内,_________。
②4min末,消耗的速率_________生成的速率(填“>”“<”或“=”)。
(4)光解水反应是采用新型复合光催化剂(),使水在太阳光下高效分解,原理如图。
该反应的能量转化形式为_________。反应Ⅰ的化学方程式为_________。
15.甲基叔戊基醚(TAME,简写为T)常用作汽油添加剂。在催化剂作用下,通过甲醇(简写为M)与2-甲基-2-丁烯(简写为A)的液相反应制得。通过控制条件,体系中主要发生如下反应(B为2-甲基-1-丁烯的简写,不考虑其他副反应):
反应ⅰ:
反应ⅱ:
反应ⅲ:
(1)磷钼酸()可作为制备TAME反应催化剂的浸渍试剂。已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似。基态钼原子的价层电子排布式为_____。
(2)比较_____(填“>”、“<”或“=”)。
(3)我国学者团队对制备TAME反应的催化剂进行了研究。研究表明:用不同浓度(1~3%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。用浓度分别为1%、2%、3%的磷钼酸浸渍催化剂进行了三组实验,得到随时间的变化曲线如图所示。
①用3%的磷钼酸浸渍时,在4~6h内,T的平均生成速率为_____。
②下列说法正确的有_____。
A.三组实验中,反应速率都随反应进程一直增大
B.平衡后加入惰性溶剂四氢呋喃稀释,减小
C.催化剂可加快化学反应速率,提高甲醇的平衡转化率
D.降低温度,反应ⅰ和ⅱ的正、逆反应速率都减小
E.达到平衡后,加入M,不变
(4)研究团队继续研究其他条件不变时,不同醇烯比(甲醇M与烯烃A的起始物质的量浓度之比)对平衡的影响,当A起始浓度时,测得平衡时B和T的随的变化曲线如图。
当时,计算反应i的平衡常数_____(保留小数点后两位)。
答案以及解析
1.答案:C
解析:由题图可知,三种投料方式下,随温度升高,乙苯的转化率均逐渐增大,因此该反应为吸热反应,其他条件不变时,升高温度平衡正问移动,A正确;投料方式为时的α最高,可能的原因是与反应生成的发生反应:,使减小,促使平衡向问正反应方向移动,使乙苯的转化率增大,B正确;。只与温度有关,因此同温度下三种不同投料方式下反应的。相同,因此可以由题图中α点数据求720K时反应的。由于压强恒为1 atm,则由α点时乙苯转化率为10%可知,平衡时,,则代入可得,C错误;生产时用水蒸气代替,水蒸气与积碳发生反应:,可防止积碳并保持催化剂活性,D正确。
2.答案:C
解析:题图甲过程涉及O—H键等极性键的断裂,C—H键等极性键、C—C键等非极性键的形成,无非极性键的断裂,A错误;由题图乙知上转化为的能垒比Cu(111)面上高,说明上催化转化为的反应速率较慢,B错误;题图甲中产物有乙醇、乙烯,C正确;催化剂只能改变反应速率,不能改变平衡转化率,D错误。
3.答案:D
解析:A.改变条件后,正逆反应速率增大且相等,可能是加了催化剂;对前后气体分子数相等的化学反应,也可能是加压,A正确;
B.已知生成物的百分含量随温度的升高而增大,m为曲线的最高点,生成物的百分含量达到最大值,即建立了相应温度下的平衡状态,B正确;
C.曲线上B点表示在此温度下反应达到平衡时所能达到的最大转化率,A位于曲线以上,表示超过该温度下的最大转化率,此时平衡会向逆反应方向移动,>;C点位于曲线以下,表示未达到该温度下的最大转化率,此时平衡会向正反应方向移动,>,C正确;
D.A点时c(反应物)=c(生成物),不一定达到平衡状态,D错误;
答案选D。
4.答案:A
解析:A.由图可知,产物总自由能小于反应物总自由能,即,反应可自发进行,A正确;
B.同素异形体是指由同种元素组成而性质不同的单质,和是离子,不是单质,则三种微粒不互为同素异形体,B错误;
C.中所有磷原子均为sp3杂化,只有一种化学环境的磷原子,C错误;
D.制备需要得到一个电子,发生还原反应,D错误;
故选A。
5.答案:D
解析:略
6.答案:B
解析:A.A点,未达到平衡,故A错误;
B.随着温度升高,的消耗速率大于的消耗速率的二倍,则逆反应速率大于正反应速率,说明温度升高,平衡逆向移动,是放热反应,则正反应的活化能小于逆反应的活化能,故B正确;
C.该反应为放热反应,温度升高,K减小,由图可知,C点温度最低,则K最大,故,故C错误;
D.300℃时,反应达平衡后缩小容器体积,平衡不移动,但是体积缩小,各组分浓度均增加,故D错误。
故选B。
7.答案:C
解析:略
8.答案:D
解析:A.步骤I涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,不涉及非极性键的变化,A错误;
B.已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢,活化能变大,则与反反应的能量变化应为图中曲线c,反应的活化能更大,B错误;
C.由图可知,生成物能量低于反应物的能量,则反应为放热反应,升高温度,平衡逆向移动,甲醇产量减小,C错误;
D.根据反应机理可知,若与反应,生成的氘代甲醇可能为或,共两种,D正确;
故选D。
9.答案:B
解析:A.反应①②同时发生,反应②会破坏反应①的平衡,所以两个反应应该同时达到平衡,故A正确;
B.由图可知,550~600℃条件下,甲烷的转化率大于二氧化碳的转化率,说明升温更有利于反应①,故B错误;
C.升高温度和增大压强,化学反应速率均增大,则加热、加压时,反应①②的反应速率均会增大,故C正确;
D.由方程式可知,反应①中氢气与一氧化碳的物质的量比始终为1.0,则氢气与一氧化碳的物质的量比始终低于1.0说明发生了反应②,故D正确;
故选B。
10.答案:D
解析:A.结合实验目的可知,实验1、2是验证催化剂比表面积对化学反应速率的影响,催化剂只影响反应速率不影响化学平衡,故达到平衡时,CO平衡浓度相同,即,故A正确;
B.由表格数据可知,实验2中,CO转化浓度为,平衡转化率为,故B正确;
C.对比实验1、2可知,实验2到达平衡的时间比实验1到达平衡的时间短,说明反应速率大,实验2的催化剂比表面积比实验1的大,可知,增大催化剂比表面积可加快反应速率,故C正确;
D.结合实验目的可知,实验1、3是验证温度对化学反应速率的影响,实验3的温度比实验1的温度高,平衡时,实验3中CO平衡浓度比实验1中CO平衡浓度大,即平衡逆向移动,温度升高平衡向吸热方向移动,说明升高温度,该反应正向移动,该反应为放热反应,即该反应的,故D错误;
故选D。
11.答案:B
解析:A.从表中数据可以看出,冠醚的空腔直径与或直径接近时,结合常数大,由此可推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关,A正确;
B.冠醚A结合的能力弱于结合的能力,所以可将冠醚A中的部分替代出来,由实验 中,可得出:①>③>②,B不正确;
C.冠醚与结合,从而将携带进入有机相,催化与环己烯的反应,从而加快反应速率,C正确;
D.由表中数据可推出,冠醚A结合的能力比冠醚B强,为加快与环己烯的反应速率,选择冠醚A比冠醚B更合适,D正确;
故选B。
12.答案:B
解析:B.当pH=11时,,根据,则,故B正确。
13.答案:(1)BCD
(2)
(3)
(4)
(5)b;;
(6)-447.3
解析:(1)A.催化剂不能使平衡移动,通过更换不同种类的催化剂,不能改变平衡时原料的转化率,故A错误;
B.该反应焓变小于0、熵变小于0,反应装置保持在相对较低的温度下,将有利于该反应的自发进行,故B正确;
C.平衡常数只与温度有关,在反应过程中任意时刻移除部分产物,都可以使反应正向进行,但该反应的平衡常数保持不变,故C正确;
D.若投料比等于系数比,是恒量,当检测到装置内的保持不变时,不一定能说明反应已经达到平衡状态,故D正确;
选BCD。
(2)根据图示,氮气、水反应生成氨气和氧气,该工艺合成氨的化学方程式为。
(3)根据图示,氮气得电子生成氨气,电极上生成的电极反应式为。
(4)活化能越大,反应速率越慢,慢反应决定总反应速率,决定氧化反应速率的步骤是II。
(5)①正反应放热,升高温度、平衡逆向移动,含量增大,代表的曲线是。
②假设平衡时体系的总压为,由图可知,A点温度下,和的体积分数相等,则和的分压均为,则A点温度下的平衡常数,设初始通入amol,转化的的物质的量为xmol,a-x=0.5x,x=,的平衡转化率。
(6)①
②,则根据盖斯定律,将①×3+②×2得。
14.答案:(1)放热;462
(2)AD
(3);=
(4)光能转化为化学能(或太阳能转化为化学能);
解析:(1)该反应反应物总能量高于生成物总能量,为放热反应;由图可知,Sabatier反应的反应热=-260kJ/mol=反应物总键能-生成物总键能,设O-H键的键能为xkJ/mol,故,解得x=462,故的键能为:462kJ/mol;
(2)A.的体积分数不再改变时,该反应达到最大限度,A正确;
B.、、、的物质的量之比为1:4:1:2,不能判断达到最大限度,B错误;
C.单位时间内,消耗同时生成,均为正反应方向,不能判断达到最大限度,C错误;
D.单位时间内,断裂(消耗1molH2)键的同时断裂键(消耗0.5molH2O),正逆反应速率相等,能判断达到最大限度,D正确;
故选AD;
(3)①在0 4min内,;
②4min末,消耗氢气4mol,生成甲烷1mol,10min时甲烷的物质的量仍为1mol,故4min已经达到平衡,正逆反应速率相等,故消耗的速率=生成的速率;
(4)由图可知:反应I为,反应II为:。
水在太阳光下高效分解,能量转化形式为:光能转化为化学能(或太阳能转化为化学能);反应Ⅰ的化学方程式为:。
15.答案:(1)
(2)>
(3);BDE
(4)6.25
解析:(1)已知钼元素位于第五周期第ⅥB族,核外电子排布与Cr相似,Cr价电子排布式为,则基态钼原子的价层电子排布式为;故答案为:。
(2)根据第一个方程式是第三个方程式减去第二个方程式得到,则>;故答案为:>。
(3)①根据用不同浓度(1~3%)的磷钼酸浸渍催化剂,浓度越大催化剂催化活性越好。则曲线是代表为3%的磷钼酸浸渍时,在4~6h内,T的平均生成速率为;故答案为:。
②A.三组实验中,磷钼酸的浓度逐渐减少,反应速率都随反应进行一直减小,故A错误;
B.平衡后加入惰性溶剂四氢呋喃稀释,c(A)减小,反应ⅰ的平衡常数不变,减小,故B正确;C.催化剂可加快化学反应速率,但不能提高甲醇的平衡转化率,故C错误;D.降低温度,速率都减小即反应ⅰ和ⅱ的正、逆反应速率都减小,故D正确;E.达到平衡后,c(T)不变,反应ⅱ平衡逆向移动,c(B)减小,但反应ⅲ平衡常数只与温度有关,故E正确;综上所述,答案为:BDE。
(4)根据题中A起始浓度时,则,
,则,,则反应ⅰ的平衡常数;故答案为:6.25。
同课章节目录
