考点8 水溶液中的离子反应与平衡—高考化学一轮复习考点创新题训练(含解析)
文档属性
| 名称 | 考点8 水溶液中的离子反应与平衡—高考化学一轮复习考点创新题训练(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 971.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-05 14:10:02 | ||
图片预览


文档简介
考点8 水溶液中的离子反应与平衡—高考化学一轮复习考点创新题训练
1.某温度下,用的硝酸银标准溶液对25.00 mL含KCl和KCN的混合溶液进行电位滴定,获得电动势()和硝酸银标准溶液体积()的电位滴定曲线如图所示。
已知:Ⅰ.在滴定过程中,随着滴定剂的不断加入,不断发生变化,发生突跃时,说明滴定到达终点。
Ⅱ.与反应过程为①;
②。
Ⅲ.该温度下,,。
Ⅳ.与的反应可以忽略。
下列说法正确的是( )
A.段有AgCN
B.原混合液中
C.
D.点时,溶液中
2.溶洞水体中的与空气中的保持平衡。现测得溶洞水体中lg c(X)(X为、或)与pH的关系如图所示,。下列说法错误的是( )
A.曲线Ⅲ代表与pH的关系
B.的
C.当时,水体的pH=6.3
D.存在关系式:2pH(b)=pH(a)+pH(c)
二、非选择题:本题包括4小题,共58分。
3.常温下向0.1 mol·的二元酸溶液中滴加等浓度的NaOH溶液,溶液的pH随lg变化关系如图所示:
下列有关说法错误的是( )
A. 的二级电离常数的数量级为
B.NaHR溶液对水的电离起抑制作用
C.电离方程式:
D.pH=7时,
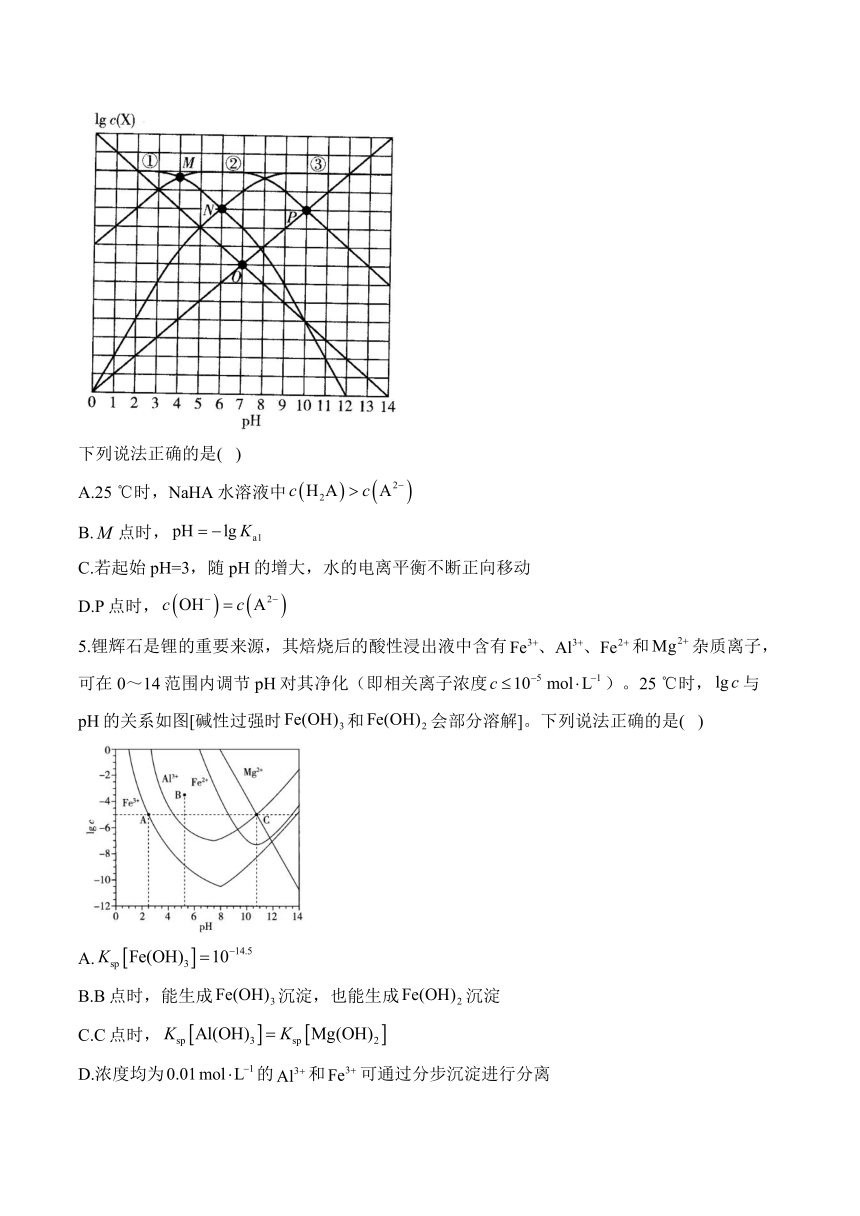
4.25 ℃时,某混合溶液中,、、和随pH变化的关系如图所示(为的电离常数)。
下列说法正确的是( )
A.25 ℃时,NaHA水溶液中
B.点时,
C.若起始pH=3,随pH的增大,水的电离平衡不断正向移动
D.P点时,
5.锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度)。25 ℃时,与pH的关系如图[碱性过强时和会部分溶解]。下列说法正确的是( )
A.
B.B点时,能生成沉淀,也能生成沉淀
C.C点时,
D.浓度均为的和可通过分步沉淀进行分离
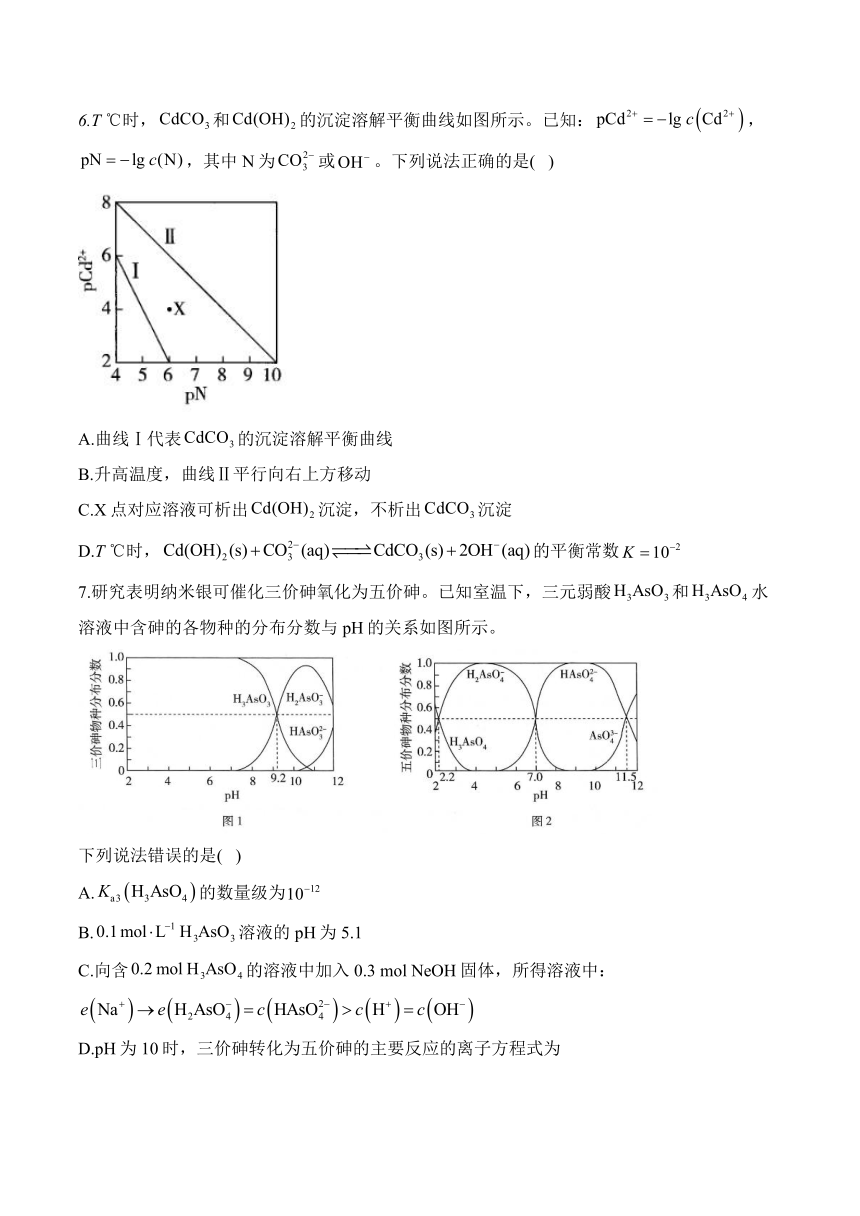
6.T ℃时,和的沉淀溶解平衡曲线如图所示。已知:,,其中N为或。下列说法正确的是( )
A.曲线Ⅰ代表的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ平行向右上方移动
C.X点对应溶液可析出沉淀,不析出沉淀
D.T ℃时,的平衡常数
7.研究表明纳米银可催化三价砷氧化为五价砷。已知室温下,三元弱酸和水溶液中含砷的各物种的分布分数与pH的关系如图所示。
下列说法错误的是( )
A.的数量级为
B.溶液的pH为5.1
C.向含的溶液中加入0.3 mol NeOH固体,所得溶液中:
D.pH为10时,三价砷转化为五价砷的主要反应的离子方程式为
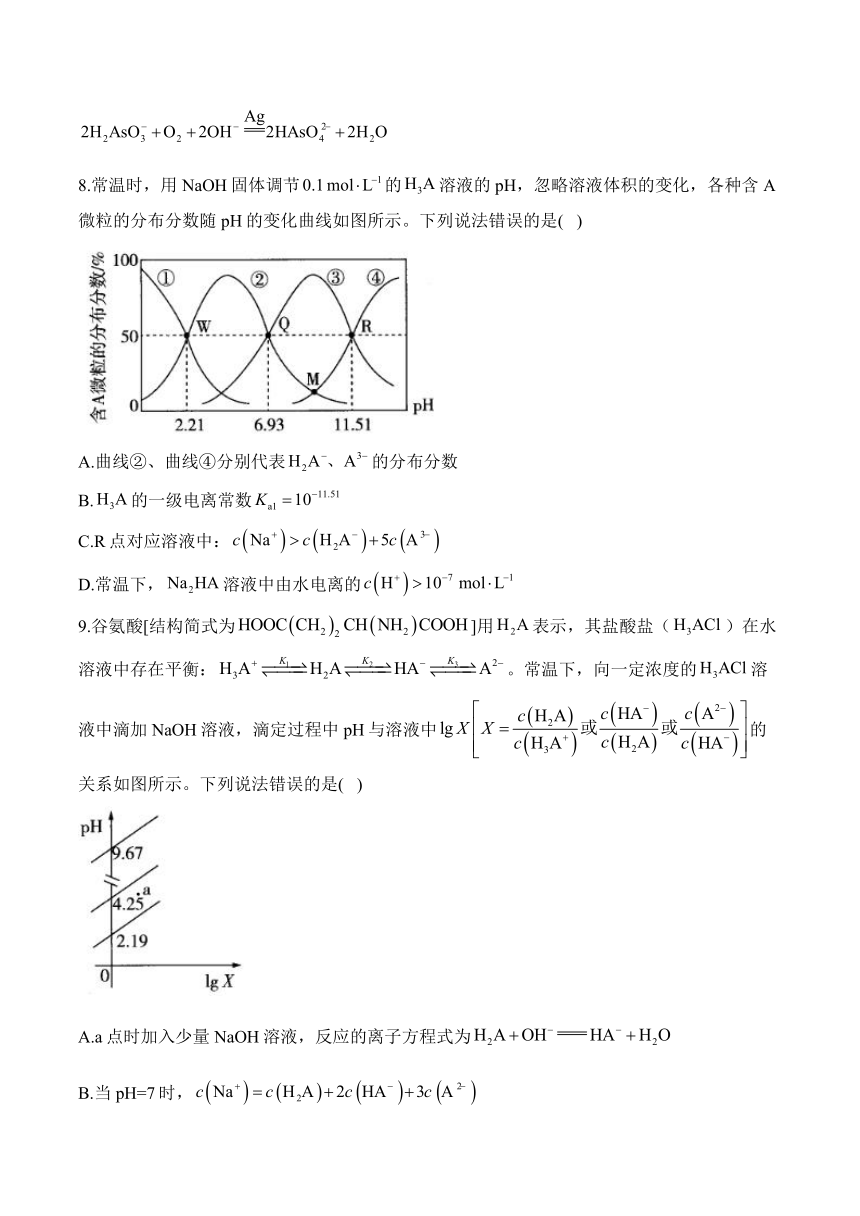
8.常温时,用NaOH固体调节的溶液的pH,忽略溶液体积的变化,各种含A微粒的分布分数随pH的变化曲线如图所示。下列说法错误的是( )
A.曲线②、曲线④分别代表的分布分数
B.的一级电离常数
C.R点对应溶液中:
D.常温下,溶液中由水电离的
9.谷氨酸[结构简式为]用表示,其盐酸盐()在水溶液中存在平衡:。常温下,向一定浓度的溶液中滴加NaOH溶液,滴定过程中pH与溶液中的关系如图所示。下列说法错误的是( )
A.a点时加入少量NaOH溶液,反应的离子方程式为
B.当pH=7时,
C.反应的
D.溶液中,
10.25 ℃时,向的3-甲基苯胺(用BOH表示)溶液中逐滴滴加等浓度的HCl溶液,测得溶液中随的变化曲线如图所示。下列叙述正确的是( )
A.25 ℃时,BOH的电离平衡常数约为
B.溶液中水的电离程度:c>b>a
C.的溶液中:
D.b点对应的横坐标为1.0
11.常温下,向含有的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示或或]。已知:常温下,;当离子浓度时,可认为该离子沉淀完全。下列说法错误的是( )
A.曲线②表示与pH的关系
B.pH=6时,溶液中
C.pH=7时,可认为沉淀完全
D.pH=8时,
12.25 ℃时,用NaOH溶液分别滴定两种溶液,pM[pM=-lgM,M表示]随pH的变化曲线如图所示。已知:溶液中离子浓度时,认为该离子沉淀完全。下列有关说法错误的是( )
A.Ⅱ表示随pH变化的曲线
B.25 ℃时,的沉淀溶解平衡常数的数量级为
C.NaOH溶液滴定溶液至a点时,沉淀完全
D.NaOH溶液滴定HX溶液至a点时,
13.砷与氮、磷同主族,亚砷酸()可用于治疗白血病。T℃下,向100mL0.12mol/L亚砷酸溶液滴加等物质的量浓度NaOH溶液,所得溶液中含砷微粒(、、、)的物质的量分数与溶液pH关系如图所示,回答下列问题:
(1)人体血液的pH为7.35~7.45,使用亚砷酸注射液后,血液中含砷微粒主要是______(写化学式)。
(2)该温度下亚砷酸的=______,已知25℃下亚砷酸的,据此推测温度T_____25(填“>”、“=”或“<”)。
(3)pH从10增大到12,溶液中发生的主要离子方程式为_____________。
(4)a、b、c三点对应水的电离程度由大到小的顺序为_____________。
(5)当滴加200mLNaOH溶液时,_______ (忽略溶液混合后体积变化)
(6)已知同种元素的含氧酸,元素化合价越高,酸性越强。往亚砷酸溶液中滴加几滴双氧水,溶液pH减小,写出发生反应的化学方程式_____________________。
14.磷酸铁是锂离子动力电池正极材料——磷酸铁锂的原材料,以下是以磷铁(主要成分为FeP,含少量、杂质)为原料制备磷酸铁的化工流程。
回答以下问题:
(1)“高温焙烧”中将磷铁磨成粉末的目的是_________。
(2)溶液中含有杂质为和_______。
(3)“还原”时,淀粉高温灼烧成碳,将还原为二价铁后,浸取率显著增大。写出“酸浸”中反应的离子方程式___________。
(4)“铁磷混合”向浸出的溶液中加入,再加入,调节pH=0.8,再将浸出的加入。此时溶液中磷元素主要以形式____(填“”、“”、“”或“”)存在。(已知常温下磷酸的电离常数:=、、)
(5)“沉淀”先加双氧水,再调节pH为2。
①加双氧水目的为__________。
②调节pH为2,=_____mol·L-1
(已知常温下溶度积常数: )
③溶液pH不能过高的原因是________。
④“沉淀”后过滤,滤液的主要成分为_______。
15.高锰酸钾和硫酸锰两种重要的含锰盐在化工生产和环境保护等领域应用广泛。以软锰矿(主要成分,含有和等杂质)和黄铁矿(主要成分,杂质不参与反应)为原料,制备高纯度高锰酸钾和硫酸锰的流程如图所示:
回答下列问题:
(1)基态锰原子中未成对电子数为___________,的价电子排布式为___________。
(2)提高“反应III”速率可采取的措施是___________、___________(任写两种)。
(3)“反应I”为焙烧,有锰酸钾生成,该步骤主要反应的化学方程式为___________。
(4)“反应II”为酸性歧化反应,且“反应III”过程中有S单质产生,则“反应III”离子方程式为___________。
(5)“反应IV”中的软锰矿的作用为___________。
(6)“一系列操作”目的是获得高纯度的高锰酸钾晶体,请从下列选项中选出合理的操作并排序___________(填序号)。
①抽滤②冷却③乙醇洗涤④冷水洗涤⑤加热蒸发至溶液中出现大量晶体,停止加热⑥加热蒸发至溶液出现晶膜,停止加热
(7)为得到纯度高的晶体,调节pH应不低于___________。(当离子浓度低于时,离子沉淀完全,已知:;;)
答案以及解析
1.答案:D
解析: 由的相对大小可知,应先生成AgCN沉淀,段发生反应①,点时恰好完全转化为,点时恰好完全转化为AgCN,A错误;段发生反应①,段发生反应②,所以=5.00,原溶液中,,段发生的反应为, 段消耗的标准溶液的体积为12.50 mL-5.00 mL=7.50 mL,则原溶液中,,B错误;,,则,C错误:C点时已经生成了AsC1沉淀,此时体系中AgC1和AgCN均达到沉淀溶解平衡,溶液中,D正确。
2.答案:C
解析:不变,随着pH增大,溶液碱性增强,则的浓度均增大,pH较小时,故曲线Ⅰ、Ⅱ分别表示与pH的关系,曲线Ⅲ表示与pH的关系,A正确;,点,则,B正确;由B项可知,同理根据点可得,,因,则,、、,将数据代入可得,,pH=8.3,C错误;点,结合C项公式可知,,由此可得,则pH()=8.3,由点的数据可知pH()=6.3、pH()=10.3,由此可知2pH()=pH()+pH(),D正确。
3.答案:A
解析:电离常数,由题图可知,时,,,的数量级为,A错误;的水解常数,说明NaHR溶液中的电离程度大于水解程度,溶液显酸性,对水的电离起抑制作用,B正确;二元弱酸分步电离,以第一步为主,C正确;由B项分析知,NaHR溶液显酸性,则溶液pH为7时,等浓度的溶液和NaOH溶液反应得到NaHR和的混合溶液,加入NaOH溶液体积大于溶液体积,由物料守恒可知溶液中,由溶液pH为7结合电荷守恒可得,则,D正确。
4.答案:B
解析:根据要点图解,由M点数据可得,由pH=8时,可得,25 ℃时,则,可知的电离程度大于水解程度,故NaHA溶液中,A错误;根据要点图解知,M点时,则,B正确;pH=3时,含A粒子中浓度最大,此时水的电离被抑制,随pH的增大,水的电离平衡先正移,当不再增大后,继续增大pH,水的电离平衡逆向移动,C错误;根据要点图解知,p点时,,D错误。
5.答案:D
解析:A点pH=2.5,,则,A错误;B点对于来说为过饱和溶液,会生成沉淀,而对于来说为不饱和溶液,不会生成沉淀,B错误;C点时,,且pIH相同,但和的溶度积表达式不相同,故二者的不相同,C错误;由图可知,时的pH小于时的pH,故可通过调pH分步沉淀浓度均为的和,D正确。
6.答案:D
解析:,,对应曲线斜率为-2,,,对应曲线斜率为-1,对比曲线Ⅰ、Ⅱ的斜率可知,曲线Ⅰ代表的沉淀溶解平衡曲线,曲线Ⅱ代表的沉淀溶解平衡曲线,A错误;升高温度,沉淀溶解平衡向沉淀溶解的方向移动,和浓度增大,曲线Ⅱ平行向左下方移动,B错误;X点对应溶液是的不饱和溶液,的过饱和溶液,故可析出沉淀,不析出沉淀,C错误;T ℃时,的平衡常数,D正确。
7.答案:B
解析:的三级电离常数,根据图2可知,当时,pH为11.5,所以,其数量级为,A正确;根据图1可知,的一级电离常数,则溶液一级电离产生的,则,还有二级电离及三级电离,故溶液中,pH<5.1,B错误;与0.3 mol NaOH完全反应生成和,由图2可推出,,故的水解常数,则有,此时溶液显中性,有,C正确;pH=10时,三价砷主要存在形式为,五价砷主要存在形式为,Ag为催化剂,故其转化的离子方程式为,D正确。
8.答案:B
解析:根据图像分析可知,曲线②、曲线④分别代表的分布分数,A正确;的一级电离常数,B错误;根据电荷守恒可知,,R点对应溶液中,且溶液显碱性,即,则R点对应溶液中:,C正确;的电离常数为,的水解常数为的水解程度大于电离程度,则促进水的电离,故溶液中由水电离的,D正确。
9.答案:C
解析:由图可知a点在pH与关系曲线和pH与关系曲线之间,则a点对应的溶液中主要存在的粒子为,a点时加入少量NaOH溶液,反应的离子方程式为,A正确;溶液中电荷守恒式为,pH=7时,,则,物料守恒式为,将该等式代入上述等式中可得,B正确;反应的平衡常数,C错误;溶液中存在的水解,由水解理论可知,不水解的离子的浓度大于水解的离子的浓度,水解的离子的浓度大于水解产生的离子的浓度,所以,D正确。
10.答案:C
解析:由图可知,a点为的BOH溶液,此时溶液中,则BOH的电离平衡常数,A错误;随着盐酸的滴加,水的电离程度逐渐增大,恰好中和时水的电离程度最大,随后又逐渐减小,B错误;的溶液中,溶质是等物质的量的BCl和BOH,根据可知,的水解程度大于BOH的电离程度,故,C正确;b点时,溶液呈中性,此时溶质为BCl和过量的BOH,故横坐标数值小于1.0,D错误。
11.答案:D
解析:曲线②表示与pH的关系,A正确;pH=6时,,则,B正确;pH=7时,可认为沉淀完全,C正确;pH=8时,,D错误。
12.答案:C
解析:由图像分析可知,A正确。根据图中pH=6.7时,pM=0可知,,则的沉淀溶解平衡常数的数量级为,B正确。根据图中pH=5.0时,pM=0可知,HX的电离常数;由图可知,a点时与相等,则,,,a点时,说明+沉淀不完全,C错误。由C项分析可知,a点时,,又溶液中存在电荷守恒,则,D正确。
13.答案:(1);
(2);>
(3)
(4)c、b、a
(5)0.04
(6)(产物写也对)
解析:本题主要考查化学反应平衡、离子浓度和化学方程式的书写。
(1)根据题目,人体血液的pH为5,根据图像,此时血液中含砷微粒主要是。
(2)根据图像,当溶液中时,溶液的pH为9.2,此时亚砷酸的,于,所以温度。
(3)根据图像,pH从10增大到12,溶液中浓度减小,浓度增大,所以发生的主要离子方程式为。
(4)根据图像,a、b、c三点对应的溶液中含砷微粒主要分别为、抑制水的电离,促进水的电离,且
的促进作用大于,所以水的电离程度由大到小的顺序为。
(5)略
(6)根据题目,同种元素的含氧酸,元素化合价越高,酸性越强,所以往亚砷酸溶液中滴加几滴双氧水,亚砷酸被氧化为磷酸,溶液pH减小,化学方程式为
14.答案:(1)增大接触面积,加快反应速率(答出其中一点即可)
(2)
(3)
(4)
(5)将氧化为;0.5;防止生成沉淀;
解析:(1)将磷铁磨成粉末的目的是为了增大反应物的接触面积,加快反应速率,使反应更充分;
(2)溶液中含有杂质为和,这是因为高温焙烧时,与纯碱反应生成;
(3)"酸浸"中反应的离子方程式为;
(4)此时溶液中磷元素主要以形式存在,这是因为磷酸的电离常数,所以在的条件下,主要存在的是;
(5)①加双氧水目的为将氧化为,这是因为容易被氧化为;
②调节pH为2,此时,根据,可以计算出,再根据,可以计算出;
③溶液pH不能过高的原因是防止生成沉淀,降低的产率;
④"沉淀"后过滤,滤液的主要成分为,这是因为在整个过程中,和没有参与反应。
15.答案:(1)①.②.
(2)①.搅拌②.加热
(3)
(4)
(5)将氧化为,便于除去
(6)⑥②①④③
(7)3.3
解析:(1)基态为25号元素,价电子排布式为,锰原子中未成对电子数为5,基态为26号元素,的价电子排布式为;
(2)提高"反应III"速率可采取的措施是搅拌,加热,或者适当提高酸的浓度;
(3)"反应I"为焙烧,有锰酸钾生成,该步骤主要反应的化学方程式为:
(4)"反应II"为酸性歧化反应,根据分析可知"反应III"过程中和在酸性条件下反应生成S单质和,则"反应III"离子方程式为:
(5)根据分析可知"反应IV"中的软锰矿的作用为加入软锰矿将氧化为,便于除去;
(6)根据分析可知"一系列操作"滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥获得高纯度的高锰酸钾晶体,操作排序为(6)加热蒸发至溶液出现晶膜,停止加热、(2)冷却、(1)抽滤、(4)冷水洗涤、(3)乙醇洗涤,故答案为(6)(2)(1)(4)(3);
(7)为得到纯度高的晶体,调节pH保证完全沉淀,但是不沉淀,当完全沉淀时,。
1.某温度下,用的硝酸银标准溶液对25.00 mL含KCl和KCN的混合溶液进行电位滴定,获得电动势()和硝酸银标准溶液体积()的电位滴定曲线如图所示。
已知:Ⅰ.在滴定过程中,随着滴定剂的不断加入,不断发生变化,发生突跃时,说明滴定到达终点。
Ⅱ.与反应过程为①;
②。
Ⅲ.该温度下,,。
Ⅳ.与的反应可以忽略。
下列说法正确的是( )
A.段有AgCN
B.原混合液中
C.
D.点时,溶液中
2.溶洞水体中的与空气中的保持平衡。现测得溶洞水体中lg c(X)(X为、或)与pH的关系如图所示,。下列说法错误的是( )
A.曲线Ⅲ代表与pH的关系
B.的
C.当时,水体的pH=6.3
D.存在关系式:2pH(b)=pH(a)+pH(c)
二、非选择题:本题包括4小题,共58分。
3.常温下向0.1 mol·的二元酸溶液中滴加等浓度的NaOH溶液,溶液的pH随lg变化关系如图所示:
下列有关说法错误的是( )
A. 的二级电离常数的数量级为
B.NaHR溶液对水的电离起抑制作用
C.电离方程式:
D.pH=7时,
4.25 ℃时,某混合溶液中,、、和随pH变化的关系如图所示(为的电离常数)。
下列说法正确的是( )
A.25 ℃时,NaHA水溶液中
B.点时,
C.若起始pH=3,随pH的增大,水的电离平衡不断正向移动
D.P点时,
5.锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度)。25 ℃时,与pH的关系如图[碱性过强时和会部分溶解]。下列说法正确的是( )
A.
B.B点时,能生成沉淀,也能生成沉淀
C.C点时,
D.浓度均为的和可通过分步沉淀进行分离
6.T ℃时,和的沉淀溶解平衡曲线如图所示。已知:,,其中N为或。下列说法正确的是( )
A.曲线Ⅰ代表的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ平行向右上方移动
C.X点对应溶液可析出沉淀,不析出沉淀
D.T ℃时,的平衡常数
7.研究表明纳米银可催化三价砷氧化为五价砷。已知室温下,三元弱酸和水溶液中含砷的各物种的分布分数与pH的关系如图所示。
下列说法错误的是( )
A.的数量级为
B.溶液的pH为5.1
C.向含的溶液中加入0.3 mol NeOH固体,所得溶液中:
D.pH为10时,三价砷转化为五价砷的主要反应的离子方程式为
8.常温时,用NaOH固体调节的溶液的pH,忽略溶液体积的变化,各种含A微粒的分布分数随pH的变化曲线如图所示。下列说法错误的是( )
A.曲线②、曲线④分别代表的分布分数
B.的一级电离常数
C.R点对应溶液中:
D.常温下,溶液中由水电离的
9.谷氨酸[结构简式为]用表示,其盐酸盐()在水溶液中存在平衡:。常温下,向一定浓度的溶液中滴加NaOH溶液,滴定过程中pH与溶液中的关系如图所示。下列说法错误的是( )
A.a点时加入少量NaOH溶液,反应的离子方程式为
B.当pH=7时,
C.反应的
D.溶液中,
10.25 ℃时,向的3-甲基苯胺(用BOH表示)溶液中逐滴滴加等浓度的HCl溶液,测得溶液中随的变化曲线如图所示。下列叙述正确的是( )
A.25 ℃时,BOH的电离平衡常数约为
B.溶液中水的电离程度:c>b>a
C.的溶液中:
D.b点对应的横坐标为1.0
11.常温下,向含有的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示或或]。已知:常温下,;当离子浓度时,可认为该离子沉淀完全。下列说法错误的是( )
A.曲线②表示与pH的关系
B.pH=6时,溶液中
C.pH=7时,可认为沉淀完全
D.pH=8时,
12.25 ℃时,用NaOH溶液分别滴定两种溶液,pM[pM=-lgM,M表示]随pH的变化曲线如图所示。已知:溶液中离子浓度时,认为该离子沉淀完全。下列有关说法错误的是( )
A.Ⅱ表示随pH变化的曲线
B.25 ℃时,的沉淀溶解平衡常数的数量级为
C.NaOH溶液滴定溶液至a点时,沉淀完全
D.NaOH溶液滴定HX溶液至a点时,
13.砷与氮、磷同主族,亚砷酸()可用于治疗白血病。T℃下,向100mL0.12mol/L亚砷酸溶液滴加等物质的量浓度NaOH溶液,所得溶液中含砷微粒(、、、)的物质的量分数与溶液pH关系如图所示,回答下列问题:
(1)人体血液的pH为7.35~7.45,使用亚砷酸注射液后,血液中含砷微粒主要是______(写化学式)。
(2)该温度下亚砷酸的=______,已知25℃下亚砷酸的,据此推测温度T_____25(填“>”、“=”或“<”)。
(3)pH从10增大到12,溶液中发生的主要离子方程式为_____________。
(4)a、b、c三点对应水的电离程度由大到小的顺序为_____________。
(5)当滴加200mLNaOH溶液时,_______ (忽略溶液混合后体积变化)
(6)已知同种元素的含氧酸,元素化合价越高,酸性越强。往亚砷酸溶液中滴加几滴双氧水,溶液pH减小,写出发生反应的化学方程式_____________________。
14.磷酸铁是锂离子动力电池正极材料——磷酸铁锂的原材料,以下是以磷铁(主要成分为FeP,含少量、杂质)为原料制备磷酸铁的化工流程。
回答以下问题:
(1)“高温焙烧”中将磷铁磨成粉末的目的是_________。
(2)溶液中含有杂质为和_______。
(3)“还原”时,淀粉高温灼烧成碳,将还原为二价铁后,浸取率显著增大。写出“酸浸”中反应的离子方程式___________。
(4)“铁磷混合”向浸出的溶液中加入,再加入,调节pH=0.8,再将浸出的加入。此时溶液中磷元素主要以形式____(填“”、“”、“”或“”)存在。(已知常温下磷酸的电离常数:=、、)
(5)“沉淀”先加双氧水,再调节pH为2。
①加双氧水目的为__________。
②调节pH为2,=_____mol·L-1
(已知常温下溶度积常数: )
③溶液pH不能过高的原因是________。
④“沉淀”后过滤,滤液的主要成分为_______。
15.高锰酸钾和硫酸锰两种重要的含锰盐在化工生产和环境保护等领域应用广泛。以软锰矿(主要成分,含有和等杂质)和黄铁矿(主要成分,杂质不参与反应)为原料,制备高纯度高锰酸钾和硫酸锰的流程如图所示:
回答下列问题:
(1)基态锰原子中未成对电子数为___________,的价电子排布式为___________。
(2)提高“反应III”速率可采取的措施是___________、___________(任写两种)。
(3)“反应I”为焙烧,有锰酸钾生成,该步骤主要反应的化学方程式为___________。
(4)“反应II”为酸性歧化反应,且“反应III”过程中有S单质产生,则“反应III”离子方程式为___________。
(5)“反应IV”中的软锰矿的作用为___________。
(6)“一系列操作”目的是获得高纯度的高锰酸钾晶体,请从下列选项中选出合理的操作并排序___________(填序号)。
①抽滤②冷却③乙醇洗涤④冷水洗涤⑤加热蒸发至溶液中出现大量晶体,停止加热⑥加热蒸发至溶液出现晶膜,停止加热
(7)为得到纯度高的晶体,调节pH应不低于___________。(当离子浓度低于时,离子沉淀完全,已知:;;)
答案以及解析
1.答案:D
解析: 由的相对大小可知,应先生成AgCN沉淀,段发生反应①,点时恰好完全转化为,点时恰好完全转化为AgCN,A错误;段发生反应①,段发生反应②,所以=5.00,原溶液中,,段发生的反应为, 段消耗的标准溶液的体积为12.50 mL-5.00 mL=7.50 mL,则原溶液中,,B错误;,,则,C错误:C点时已经生成了AsC1沉淀,此时体系中AgC1和AgCN均达到沉淀溶解平衡,溶液中,D正确。
2.答案:C
解析:不变,随着pH增大,溶液碱性增强,则的浓度均增大,pH较小时,故曲线Ⅰ、Ⅱ分别表示与pH的关系,曲线Ⅲ表示与pH的关系,A正确;,点,则,B正确;由B项可知,同理根据点可得,,因,则,、、,将数据代入可得,,pH=8.3,C错误;点,结合C项公式可知,,由此可得,则pH()=8.3,由点的数据可知pH()=6.3、pH()=10.3,由此可知2pH()=pH()+pH(),D正确。
3.答案:A
解析:电离常数,由题图可知,时,,,的数量级为,A错误;的水解常数,说明NaHR溶液中的电离程度大于水解程度,溶液显酸性,对水的电离起抑制作用,B正确;二元弱酸分步电离,以第一步为主,C正确;由B项分析知,NaHR溶液显酸性,则溶液pH为7时,等浓度的溶液和NaOH溶液反应得到NaHR和的混合溶液,加入NaOH溶液体积大于溶液体积,由物料守恒可知溶液中,由溶液pH为7结合电荷守恒可得,则,D正确。
4.答案:B
解析:根据要点图解,由M点数据可得,由pH=8时,可得,25 ℃时,则,可知的电离程度大于水解程度,故NaHA溶液中,A错误;根据要点图解知,M点时,则,B正确;pH=3时,含A粒子中浓度最大,此时水的电离被抑制,随pH的增大,水的电离平衡先正移,当不再增大后,继续增大pH,水的电离平衡逆向移动,C错误;根据要点图解知,p点时,,D错误。
5.答案:D
解析:A点pH=2.5,,则,A错误;B点对于来说为过饱和溶液,会生成沉淀,而对于来说为不饱和溶液,不会生成沉淀,B错误;C点时,,且pIH相同,但和的溶度积表达式不相同,故二者的不相同,C错误;由图可知,时的pH小于时的pH,故可通过调pH分步沉淀浓度均为的和,D正确。
6.答案:D
解析:,,对应曲线斜率为-2,,,对应曲线斜率为-1,对比曲线Ⅰ、Ⅱ的斜率可知,曲线Ⅰ代表的沉淀溶解平衡曲线,曲线Ⅱ代表的沉淀溶解平衡曲线,A错误;升高温度,沉淀溶解平衡向沉淀溶解的方向移动,和浓度增大,曲线Ⅱ平行向左下方移动,B错误;X点对应溶液是的不饱和溶液,的过饱和溶液,故可析出沉淀,不析出沉淀,C错误;T ℃时,的平衡常数,D正确。
7.答案:B
解析:的三级电离常数,根据图2可知,当时,pH为11.5,所以,其数量级为,A正确;根据图1可知,的一级电离常数,则溶液一级电离产生的,则,还有二级电离及三级电离,故溶液中,pH<5.1,B错误;与0.3 mol NaOH完全反应生成和,由图2可推出,,故的水解常数,则有,此时溶液显中性,有,C正确;pH=10时,三价砷主要存在形式为,五价砷主要存在形式为,Ag为催化剂,故其转化的离子方程式为,D正确。
8.答案:B
解析:根据图像分析可知,曲线②、曲线④分别代表的分布分数,A正确;的一级电离常数,B错误;根据电荷守恒可知,,R点对应溶液中,且溶液显碱性,即,则R点对应溶液中:,C正确;的电离常数为,的水解常数为的水解程度大于电离程度,则促进水的电离,故溶液中由水电离的,D正确。
9.答案:C
解析:由图可知a点在pH与关系曲线和pH与关系曲线之间,则a点对应的溶液中主要存在的粒子为,a点时加入少量NaOH溶液,反应的离子方程式为,A正确;溶液中电荷守恒式为,pH=7时,,则,物料守恒式为,将该等式代入上述等式中可得,B正确;反应的平衡常数,C错误;溶液中存在的水解,由水解理论可知,不水解的离子的浓度大于水解的离子的浓度,水解的离子的浓度大于水解产生的离子的浓度,所以,D正确。
10.答案:C
解析:由图可知,a点为的BOH溶液,此时溶液中,则BOH的电离平衡常数,A错误;随着盐酸的滴加,水的电离程度逐渐增大,恰好中和时水的电离程度最大,随后又逐渐减小,B错误;的溶液中,溶质是等物质的量的BCl和BOH,根据可知,的水解程度大于BOH的电离程度,故,C正确;b点时,溶液呈中性,此时溶质为BCl和过量的BOH,故横坐标数值小于1.0,D错误。
11.答案:D
解析:曲线②表示与pH的关系,A正确;pH=6时,,则,B正确;pH=7时,可认为沉淀完全,C正确;pH=8时,,D错误。
12.答案:C
解析:由图像分析可知,A正确。根据图中pH=6.7时,pM=0可知,,则的沉淀溶解平衡常数的数量级为,B正确。根据图中pH=5.0时,pM=0可知,HX的电离常数;由图可知,a点时与相等,则,,,a点时,说明+沉淀不完全,C错误。由C项分析可知,a点时,,又溶液中存在电荷守恒,则,D正确。
13.答案:(1);
(2);>
(3)
(4)c、b、a
(5)0.04
(6)(产物写也对)
解析:本题主要考查化学反应平衡、离子浓度和化学方程式的书写。
(1)根据题目,人体血液的pH为5,根据图像,此时血液中含砷微粒主要是。
(2)根据图像,当溶液中时,溶液的pH为9.2,此时亚砷酸的,于,所以温度。
(3)根据图像,pH从10增大到12,溶液中浓度减小,浓度增大,所以发生的主要离子方程式为。
(4)根据图像,a、b、c三点对应的溶液中含砷微粒主要分别为、抑制水的电离,促进水的电离,且
的促进作用大于,所以水的电离程度由大到小的顺序为。
(5)略
(6)根据题目,同种元素的含氧酸,元素化合价越高,酸性越强,所以往亚砷酸溶液中滴加几滴双氧水,亚砷酸被氧化为磷酸,溶液pH减小,化学方程式为
14.答案:(1)增大接触面积,加快反应速率(答出其中一点即可)
(2)
(3)
(4)
(5)将氧化为;0.5;防止生成沉淀;
解析:(1)将磷铁磨成粉末的目的是为了增大反应物的接触面积,加快反应速率,使反应更充分;
(2)溶液中含有杂质为和,这是因为高温焙烧时,与纯碱反应生成;
(3)"酸浸"中反应的离子方程式为;
(4)此时溶液中磷元素主要以形式存在,这是因为磷酸的电离常数,所以在的条件下,主要存在的是;
(5)①加双氧水目的为将氧化为,这是因为容易被氧化为;
②调节pH为2,此时,根据,可以计算出,再根据,可以计算出;
③溶液pH不能过高的原因是防止生成沉淀,降低的产率;
④"沉淀"后过滤,滤液的主要成分为,这是因为在整个过程中,和没有参与反应。
15.答案:(1)①.②.
(2)①.搅拌②.加热
(3)
(4)
(5)将氧化为,便于除去
(6)⑥②①④③
(7)3.3
解析:(1)基态为25号元素,价电子排布式为,锰原子中未成对电子数为5,基态为26号元素,的价电子排布式为;
(2)提高"反应III"速率可采取的措施是搅拌,加热,或者适当提高酸的浓度;
(3)"反应I"为焙烧,有锰酸钾生成,该步骤主要反应的化学方程式为:
(4)"反应II"为酸性歧化反应,根据分析可知"反应III"过程中和在酸性条件下反应生成S单质和,则"反应III"离子方程式为:
(5)根据分析可知"反应IV"中的软锰矿的作用为加入软锰矿将氧化为,便于除去;
(6)根据分析可知"一系列操作"滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥获得高纯度的高锰酸钾晶体,操作排序为(6)加热蒸发至溶液出现晶膜,停止加热、(2)冷却、(1)抽滤、(4)冷水洗涤、(3)乙醇洗涤,故答案为(6)(2)(1)(4)(3);
(7)为得到纯度高的晶体,调节pH保证完全沉淀,但是不沉淀,当完全沉淀时,。
同课章节目录
