2024-2025学年人教版必修第一册 1.3.1氧化还原反应 学案(含答案)
文档属性
| 名称 | 2024-2025学年人教版必修第一册 1.3.1氧化还原反应 学案(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 00:00:00 | ||
图片预览



文档简介
第1课时 氧化还原反应
素养要求
1.从化合价变化和电子转移的角度认识并判断氧化还原反应。
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系。
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
分点突破一 认识氧化还原反应的三个角度
1.从得氧、失氧的角度认识氧化还原反应
(1)得氧、失氧的分析
(2)从得氧、失氧的角度分析氧化反应和还原反应
(3)结论:氧化还原反应是反应过程中有氧得失的化学反应。
得氧失氧同时进行
2.从化合价变化的角度认识氧化还原反应
(1)化合价变化的分析
(2)从化合价变化的角度分析氧化反应和还原反应
(3)结论:氧化还原反应是反应过程中有元素化合价升降的化学反应。
化合价升降同时进行,升降总数相等
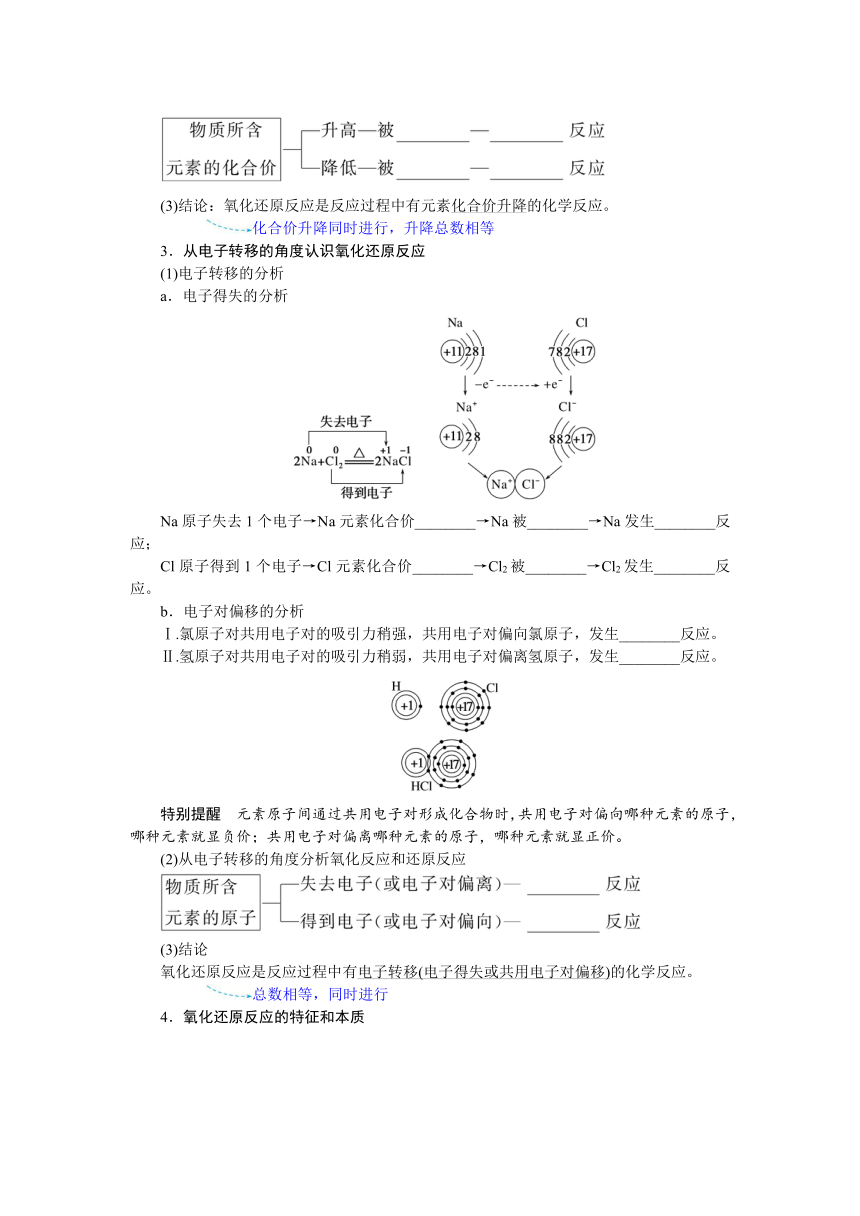
3.从电子转移的角度认识氧化还原反应
(1)电子转移的分析
a.电子得失的分析
Na原子失去1个电子→Na元素化合价________→Na被________→Na发生________反应;
Cl原子得到1个电子→Cl元素化合价________→Cl2被________→Cl2发生________反应。
b.电子对偏移的分析
Ⅰ.氯原子对共用电子对的吸引力稍强,共用电子对偏向氯原子,发生________反应。
Ⅱ.氢原子对共用电子对的吸引力稍弱,共用电子对偏离氢原子,发生________反应。
特别提醒 元素原子间通过共用电子对形成化合物时,共用电子对偏向哪种元素的原子,哪种元素就显负价;共用电子对偏离哪种元素的原子,哪种元素就显正价。
(2)从电子转移的角度分析氧化反应和还原反应
(3)结论
氧化还原反应是反应过程中有电子转移(电子得失或共用电子对偏移)的化学反应。
总数相等,同时进行
4.氧化还原反应的特征和本质
特别提醒 (1)在氧化还原反应中,并不是所有元素的化合价都发生改变。
(2)凡是有元素化合价升降的化学反应都是氧化还原反应。化合价变化是氧化还原反应的外在特征,是判断氧化还原反应的依据。
(3)任何氧化还原反应中,元素化合价升高与元素化合价降低一定同时发生,且化合价升高总数=化合价降低总数。
有部分氧化还原反应不属于四种基本类型
5.氧化还原反应与四种基本反应类型的关系
反应类型 氧化还原反应的实例 非氧化还原反应的实例 结论
化合反应A+B ===AB ________________________________________________________________________ ________________________________________________________________________ 有单质参加的化合反应属于氧化还原反应
分解反应AB===A+B ________________________________________________________________________ ________________________________________________________________________ 有单质生成的分解反应属于氧化还原反应
置换反应A+BC ===AC+B ________________________________________________________________________ — 置换反应全部属于氧化还原反应
复分解反应AB+CD===AD+CB — ________________________________________________________________________ 复分解反应全部属于非氧化还原反应
氧化还原反应与四种基本反应类型之间的关系图示
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)氧化还原反应中一定有氧元素参加。( )
(2)有单质参与的反应一定是氧化还原反应。( )
(3)有单质生成的反应一定是氧化还原反应。( )
(4)在氧化还原反应中可能只有元素化合价的升高,而无元素化合价的降低。( )
(5)当反应中有一种元素被氧化时,一定有另一种元素被还原。( )
(6)某元素从游离态变为化合态,该元素一定被氧化。( )
(7)氧化还原反应的本质是元素化合价的升降。( )
(8)发生氧化反应的物质也可能同时发生还原反应。( )
2.下列古代技术的应用中,不涉及氧化还原反应的是( )
A.古法炼铁 B.化丹(Pb3O4) 为铅 C.煅烧贝壳 D.火药爆炸
3.下列反应属于氧化还原反应但不属于四种基本类型的反应的是( )
A.CO+CuOCu+CO2
B.2KClO32KCl+3O2↑
C.Fe2O3+6HCl===2FeCl3+3H2O
D.CaO+H2O===Ca(OH)2
4.下列变化没有发生电子转移的是( )
5.下列反应中,划线的物质发生氧化反应的是( )
6.判断下列反应是否属于氧化还原反应。(填“是”或“否”)
(1)2Na+Cl2 2NaCl( )
(2)Fe+CuSO4===FeSO4+Cu( )
(3)2HgO2Hg+O2↑( )
(4)NH4NO3N2O↑+2H2O( )
(5)CaO+H2O===Ca(OH)2( )
(6)3Fe+2O2Fe3O4( )
(7)BaCl2+H2SO4===BaSO4↓+2HCl( )
(8)CaCO3CaO+CO2↑( )
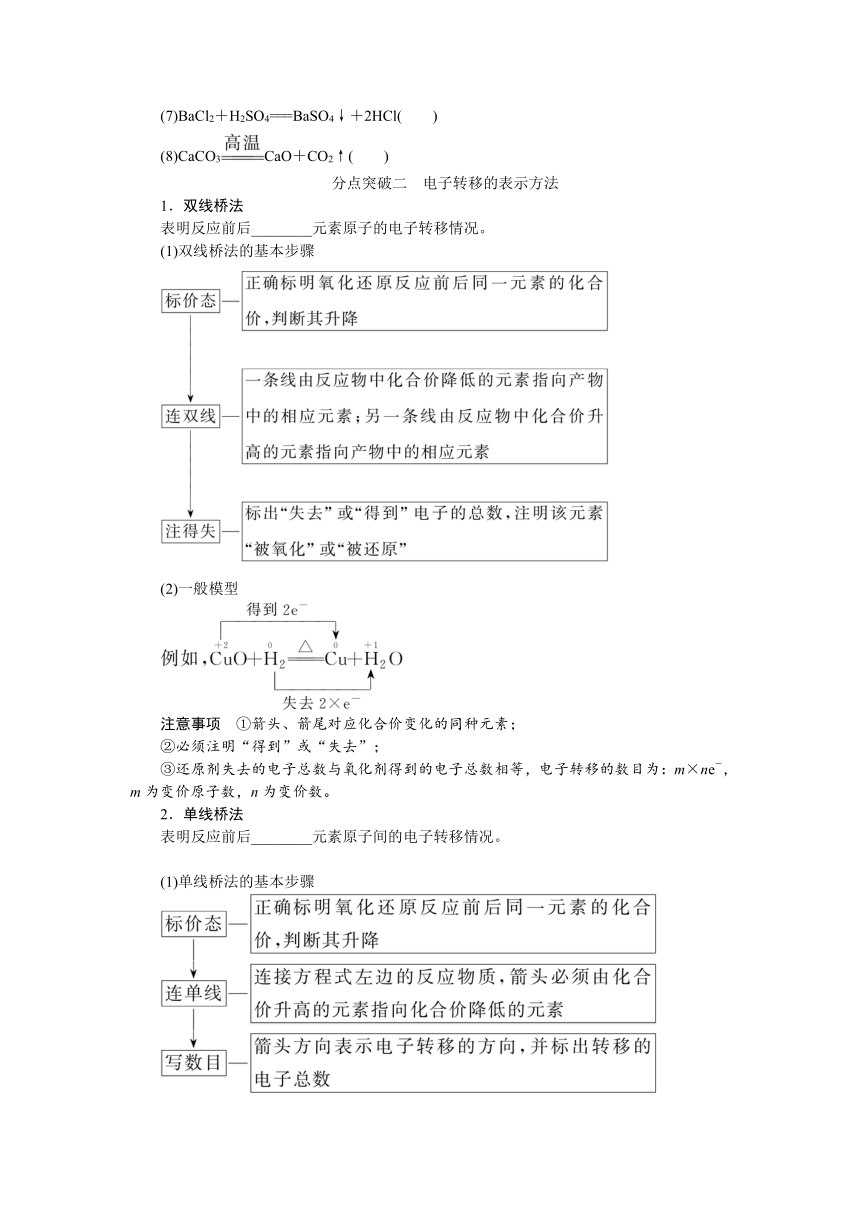
分点突破二 电子转移的表示方法
1.双线桥法
表明反应前后________元素原子的电子转移情况。
(1)双线桥法的基本步骤
(2)一般模型
注意事项 ①箭头、箭尾对应化合价变化的同种元素;
②必须注明“得到”或“失去”;
③还原剂失去的电子总数与氧化剂得到的电子总数相等,电子转移的数目为:m×ne-,m为变价原子数,n为变价数。
2.单线桥法
表明反应前后________元素原子间的电子转移情况。
(1)单线桥法的基本步骤
(2)一般模型
箭头已标明电子转移的方向,不需再标明“得到”或“失去”,只需标明电子转移的数目。
[即学即练]
1.下列反应中,电子转移方向和数目均正确的是( )
2.下列氧化还原反应中电子转移数目及方向都正确的是( )
3.分别用双线桥法和单线桥法表示下列反应中电子转移的方向和数目。
(1)2Al2O34Al+3O2↑
________________________________________________________________________、
________________________________________________________________________;
(2)H2O2+H2S===2H2O+S↓
________________________________________________________________________、
________________________________________________________________________。
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理。下列成语中涉及氧化还原反应的是( )
A.木已成舟 B.蜡炬成灰
C.铁杵成针 D.滴水成冰
2.下列化学反应中,不属于氧化还原反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.2NO+O2===2NO2
C.CuO+H2Cu+H2O
D.CaCl2+Na2CO3===CaCO3↓+2NaCl
3.判断一个化学反应是否属于氧化还原反应的方法是( )
A.分析是否发生了化合反应
B.分析是否有氧气参加反应
C.分析是否有单质参加反应
D.分析反应前后是否有元素的化合价发生变化
4.下列类型的反应,一定发生了电子转移的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
5.下列化学反应中电子转移的表示方法正确的是( )
6.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是________,被还原的元素是________。
②发生氧化反应的物质是________,发生还原反应的物质是________。
③用单线桥法表示反应电子得失的方向和数目:________________________________________________________________________。
(2)S+2KNO3+3CK2S+N2↑+3CO2↑
①碳元素被________,硫元素被________,氮元素被________,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是________,发生还原反应的物质是________。
第1课时 氧化还原反应
分点突破一 认识氧化还原反应的三个角度
1.(2)氧化 氧化 还原 还原
2.(2)氧化 氧化 还原 还原
3.(1)a.升高 氧化 氧化 降低 还原 还原;b.还原 氧化 (2)氧化 还原
5.C+O2CO2 SO3+H2O===H2SO4 2H2O2H2↑+O2↑ NH4HCO3NH3↑+H2O+CO2↑ Cl2+2NaI===2NaCl+I2 CuCl2+2NaOH===Cu(OH)2↓+2NaCl
即学即练
1.答案:(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)√
2.答案:C
3.答案:A
4.答案:D
5.解析:A项中FeCl3中的Fe,B项中CO2中的C化合价都是降低的,所以FeCl3和CO2都发生还原反应;C项中的Al化合价升高,发生氧化反应;D项不是氧化还原反应。
答案:C
6.解析:有元素化合价变化的反应属于氧化还原反应。(1)Na元素化合价从0价变为+1价,Cl元素化合价从0价变为-1价,属于氧化还原反应;(2)Fe元素化合价从0价变为+2价,Cu元素化合价从+2价变为0价,属于氧化还原反应;(3)Hg元素化合价从+2价变为0价,O元素化合价从-2价变为0价,属于氧化还原反应;、中N元素化合价分别为-3价、+5价,N2O中N元素化合价为+1价,属于氧化还原反应;(6)Fe元素化合价升高,O元素化合价从0价变为-2价,属于氧化还原反应。而(5)(7)(8)反应中元素化合价均没有发生改变,属于非氧化还原反应。
答案:(1)是 (2)是 (3)是 (4)是 (5)否 (6)是 (7)否 (8)否
分点突破二 电子转移的表示方法
1.同一
2.不同
即学即练
1.解析:A中应转移2个电子;B中应是Fe失去电子,Cl得到电子;C中应是C失去电子,O得到电子。
答案:D
2.解析:Cl得到电子,O失去电子,该反应转移12e-,图中转移电子数目不合理,故A错误;Fe得到电子,I失去电子,该反应转移2e-,故B正确;F得到电子,O失去电子,该反应转移4e-,图中箭头的方向不合理,故C错误;Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向不合理,故D错误。
答案:B
3.解析:(1)在反应2Al2O34Al+3O2↑中,Al元素化合价由反应前Al2O3中的+3价变为反应后Al单质中的0价,化合价降低,得到4×3e-,被还原;O元素化合价由反应前Al2O3中的-2价变为反应后O2中的0价,化合价升高,失去6×2e-,被氧化。(2)在反应H2O2+H2S===2H2O+S↓中,O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,化合价降低,得到2e-,被还原;S元素化合价由反应前H2S中的-2价变为反应后S单质中的0价,化合价升高,失去2e-,被氧化。
答案:(1)
(2)
随堂演练全通关
1.解析:木已成舟、铁杵成针和滴水成冰都是形状的改变,没有新物质生成,不属于化学变化,更不涉及氧化还原反应;蜡炬成灰涉及“燃烧”,是氧气参与的氧化还原反应。
答案:B
2.解析:A中镁元素的化合价由0价升高到+2价,氢元素的化合价由+1价降低到0价;B中氮元素的化合价由+2价升高到+4价,氧元素的化合价由0价降低到-2价;C中氢元素的化合价由0价升高到+1价,铜元素的化合价由+2价降低到0价;故A、B、C中反应均属于氧化还原反应。D中不存在元素化合价的变化,所以D中反应不属于氧化还原反应。
答案:D
3.答案:D
4.解析:置换反应一定属于氧化还原反应,即一定有电子转移。
答案:C
5.解析:A错,SiO2中Si元素化合价降低,得电子;C元素化合价升高,失电子。C错,Zn元素化合价升高,失电子;H2SO4中H元素化合价降低,得电子。D错,电子转移方向错误,应是Cu失电子,H2SO4中S元素得电子。
答案:B
6.答案:(1)①Cu N ②Cu HNO3
③
(2)①氧化 还原 还原 ②C S和KNO3
素养要求
1.从化合价变化和电子转移的角度认识并判断氧化还原反应。
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系。
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
分点突破一 认识氧化还原反应的三个角度
1.从得氧、失氧的角度认识氧化还原反应
(1)得氧、失氧的分析
(2)从得氧、失氧的角度分析氧化反应和还原反应
(3)结论:氧化还原反应是反应过程中有氧得失的化学反应。
得氧失氧同时进行
2.从化合价变化的角度认识氧化还原反应
(1)化合价变化的分析
(2)从化合价变化的角度分析氧化反应和还原反应
(3)结论:氧化还原反应是反应过程中有元素化合价升降的化学反应。
化合价升降同时进行,升降总数相等
3.从电子转移的角度认识氧化还原反应
(1)电子转移的分析
a.电子得失的分析
Na原子失去1个电子→Na元素化合价________→Na被________→Na发生________反应;
Cl原子得到1个电子→Cl元素化合价________→Cl2被________→Cl2发生________反应。
b.电子对偏移的分析
Ⅰ.氯原子对共用电子对的吸引力稍强,共用电子对偏向氯原子,发生________反应。
Ⅱ.氢原子对共用电子对的吸引力稍弱,共用电子对偏离氢原子,发生________反应。
特别提醒 元素原子间通过共用电子对形成化合物时,共用电子对偏向哪种元素的原子,哪种元素就显负价;共用电子对偏离哪种元素的原子,哪种元素就显正价。
(2)从电子转移的角度分析氧化反应和还原反应
(3)结论
氧化还原反应是反应过程中有电子转移(电子得失或共用电子对偏移)的化学反应。
总数相等,同时进行
4.氧化还原反应的特征和本质
特别提醒 (1)在氧化还原反应中,并不是所有元素的化合价都发生改变。
(2)凡是有元素化合价升降的化学反应都是氧化还原反应。化合价变化是氧化还原反应的外在特征,是判断氧化还原反应的依据。
(3)任何氧化还原反应中,元素化合价升高与元素化合价降低一定同时发生,且化合价升高总数=化合价降低总数。
有部分氧化还原反应不属于四种基本类型
5.氧化还原反应与四种基本反应类型的关系
反应类型 氧化还原反应的实例 非氧化还原反应的实例 结论
化合反应A+B ===AB ________________________________________________________________________ ________________________________________________________________________ 有单质参加的化合反应属于氧化还原反应
分解反应AB===A+B ________________________________________________________________________ ________________________________________________________________________ 有单质生成的分解反应属于氧化还原反应
置换反应A+BC ===AC+B ________________________________________________________________________ — 置换反应全部属于氧化还原反应
复分解反应AB+CD===AD+CB — ________________________________________________________________________ 复分解反应全部属于非氧化还原反应
氧化还原反应与四种基本反应类型之间的关系图示
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)氧化还原反应中一定有氧元素参加。( )
(2)有单质参与的反应一定是氧化还原反应。( )
(3)有单质生成的反应一定是氧化还原反应。( )
(4)在氧化还原反应中可能只有元素化合价的升高,而无元素化合价的降低。( )
(5)当反应中有一种元素被氧化时,一定有另一种元素被还原。( )
(6)某元素从游离态变为化合态,该元素一定被氧化。( )
(7)氧化还原反应的本质是元素化合价的升降。( )
(8)发生氧化反应的物质也可能同时发生还原反应。( )
2.下列古代技术的应用中,不涉及氧化还原反应的是( )
A.古法炼铁 B.化丹(Pb3O4) 为铅 C.煅烧贝壳 D.火药爆炸
3.下列反应属于氧化还原反应但不属于四种基本类型的反应的是( )
A.CO+CuOCu+CO2
B.2KClO32KCl+3O2↑
C.Fe2O3+6HCl===2FeCl3+3H2O
D.CaO+H2O===Ca(OH)2
4.下列变化没有发生电子转移的是( )
5.下列反应中,划线的物质发生氧化反应的是( )
6.判断下列反应是否属于氧化还原反应。(填“是”或“否”)
(1)2Na+Cl2 2NaCl( )
(2)Fe+CuSO4===FeSO4+Cu( )
(3)2HgO2Hg+O2↑( )
(4)NH4NO3N2O↑+2H2O( )
(5)CaO+H2O===Ca(OH)2( )
(6)3Fe+2O2Fe3O4( )
(7)BaCl2+H2SO4===BaSO4↓+2HCl( )
(8)CaCO3CaO+CO2↑( )
分点突破二 电子转移的表示方法
1.双线桥法
表明反应前后________元素原子的电子转移情况。
(1)双线桥法的基本步骤
(2)一般模型
注意事项 ①箭头、箭尾对应化合价变化的同种元素;
②必须注明“得到”或“失去”;
③还原剂失去的电子总数与氧化剂得到的电子总数相等,电子转移的数目为:m×ne-,m为变价原子数,n为变价数。
2.单线桥法
表明反应前后________元素原子间的电子转移情况。
(1)单线桥法的基本步骤
(2)一般模型
箭头已标明电子转移的方向,不需再标明“得到”或“失去”,只需标明电子转移的数目。
[即学即练]
1.下列反应中,电子转移方向和数目均正确的是( )
2.下列氧化还原反应中电子转移数目及方向都正确的是( )
3.分别用双线桥法和单线桥法表示下列反应中电子转移的方向和数目。
(1)2Al2O34Al+3O2↑
________________________________________________________________________、
________________________________________________________________________;
(2)H2O2+H2S===2H2O+S↓
________________________________________________________________________、
________________________________________________________________________。
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理。下列成语中涉及氧化还原反应的是( )
A.木已成舟 B.蜡炬成灰
C.铁杵成针 D.滴水成冰
2.下列化学反应中,不属于氧化还原反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.2NO+O2===2NO2
C.CuO+H2Cu+H2O
D.CaCl2+Na2CO3===CaCO3↓+2NaCl
3.判断一个化学反应是否属于氧化还原反应的方法是( )
A.分析是否发生了化合反应
B.分析是否有氧气参加反应
C.分析是否有单质参加反应
D.分析反应前后是否有元素的化合价发生变化
4.下列类型的反应,一定发生了电子转移的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
5.下列化学反应中电子转移的表示方法正确的是( )
6.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是________,被还原的元素是________。
②发生氧化反应的物质是________,发生还原反应的物质是________。
③用单线桥法表示反应电子得失的方向和数目:________________________________________________________________________。
(2)S+2KNO3+3CK2S+N2↑+3CO2↑
①碳元素被________,硫元素被________,氮元素被________,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是________,发生还原反应的物质是________。
第1课时 氧化还原反应
分点突破一 认识氧化还原反应的三个角度
1.(2)氧化 氧化 还原 还原
2.(2)氧化 氧化 还原 还原
3.(1)a.升高 氧化 氧化 降低 还原 还原;b.还原 氧化 (2)氧化 还原
5.C+O2CO2 SO3+H2O===H2SO4 2H2O2H2↑+O2↑ NH4HCO3NH3↑+H2O+CO2↑ Cl2+2NaI===2NaCl+I2 CuCl2+2NaOH===Cu(OH)2↓+2NaCl
即学即练
1.答案:(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)√
2.答案:C
3.答案:A
4.答案:D
5.解析:A项中FeCl3中的Fe,B项中CO2中的C化合价都是降低的,所以FeCl3和CO2都发生还原反应;C项中的Al化合价升高,发生氧化反应;D项不是氧化还原反应。
答案:C
6.解析:有元素化合价变化的反应属于氧化还原反应。(1)Na元素化合价从0价变为+1价,Cl元素化合价从0价变为-1价,属于氧化还原反应;(2)Fe元素化合价从0价变为+2价,Cu元素化合价从+2价变为0价,属于氧化还原反应;(3)Hg元素化合价从+2价变为0价,O元素化合价从-2价变为0价,属于氧化还原反应;、中N元素化合价分别为-3价、+5价,N2O中N元素化合价为+1价,属于氧化还原反应;(6)Fe元素化合价升高,O元素化合价从0价变为-2价,属于氧化还原反应。而(5)(7)(8)反应中元素化合价均没有发生改变,属于非氧化还原反应。
答案:(1)是 (2)是 (3)是 (4)是 (5)否 (6)是 (7)否 (8)否
分点突破二 电子转移的表示方法
1.同一
2.不同
即学即练
1.解析:A中应转移2个电子;B中应是Fe失去电子,Cl得到电子;C中应是C失去电子,O得到电子。
答案:D
2.解析:Cl得到电子,O失去电子,该反应转移12e-,图中转移电子数目不合理,故A错误;Fe得到电子,I失去电子,该反应转移2e-,故B正确;F得到电子,O失去电子,该反应转移4e-,图中箭头的方向不合理,故C错误;Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向不合理,故D错误。
答案:B
3.解析:(1)在反应2Al2O34Al+3O2↑中,Al元素化合价由反应前Al2O3中的+3价变为反应后Al单质中的0价,化合价降低,得到4×3e-,被还原;O元素化合价由反应前Al2O3中的-2价变为反应后O2中的0价,化合价升高,失去6×2e-,被氧化。(2)在反应H2O2+H2S===2H2O+S↓中,O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,化合价降低,得到2e-,被还原;S元素化合价由反应前H2S中的-2价变为反应后S单质中的0价,化合价升高,失去2e-,被氧化。
答案:(1)
(2)
随堂演练全通关
1.解析:木已成舟、铁杵成针和滴水成冰都是形状的改变,没有新物质生成,不属于化学变化,更不涉及氧化还原反应;蜡炬成灰涉及“燃烧”,是氧气参与的氧化还原反应。
答案:B
2.解析:A中镁元素的化合价由0价升高到+2价,氢元素的化合价由+1价降低到0价;B中氮元素的化合价由+2价升高到+4价,氧元素的化合价由0价降低到-2价;C中氢元素的化合价由0价升高到+1价,铜元素的化合价由+2价降低到0价;故A、B、C中反应均属于氧化还原反应。D中不存在元素化合价的变化,所以D中反应不属于氧化还原反应。
答案:D
3.答案:D
4.解析:置换反应一定属于氧化还原反应,即一定有电子转移。
答案:C
5.解析:A错,SiO2中Si元素化合价降低,得电子;C元素化合价升高,失电子。C错,Zn元素化合价升高,失电子;H2SO4中H元素化合价降低,得电子。D错,电子转移方向错误,应是Cu失电子,H2SO4中S元素得电子。
答案:B
6.答案:(1)①Cu N ②Cu HNO3
③
(2)①氧化 还原 还原 ②C S和KNO3
