2024-2025学年人教版必修第一册 2.1.3碳酸钠和碳酸氢钠 焰色试验 学案(含答案)
文档属性
| 名称 | 2024-2025学年人教版必修第一册 2.1.3碳酸钠和碳酸氢钠 焰色试验 学案(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 416.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 11:32:21 | ||
图片预览


文档简介
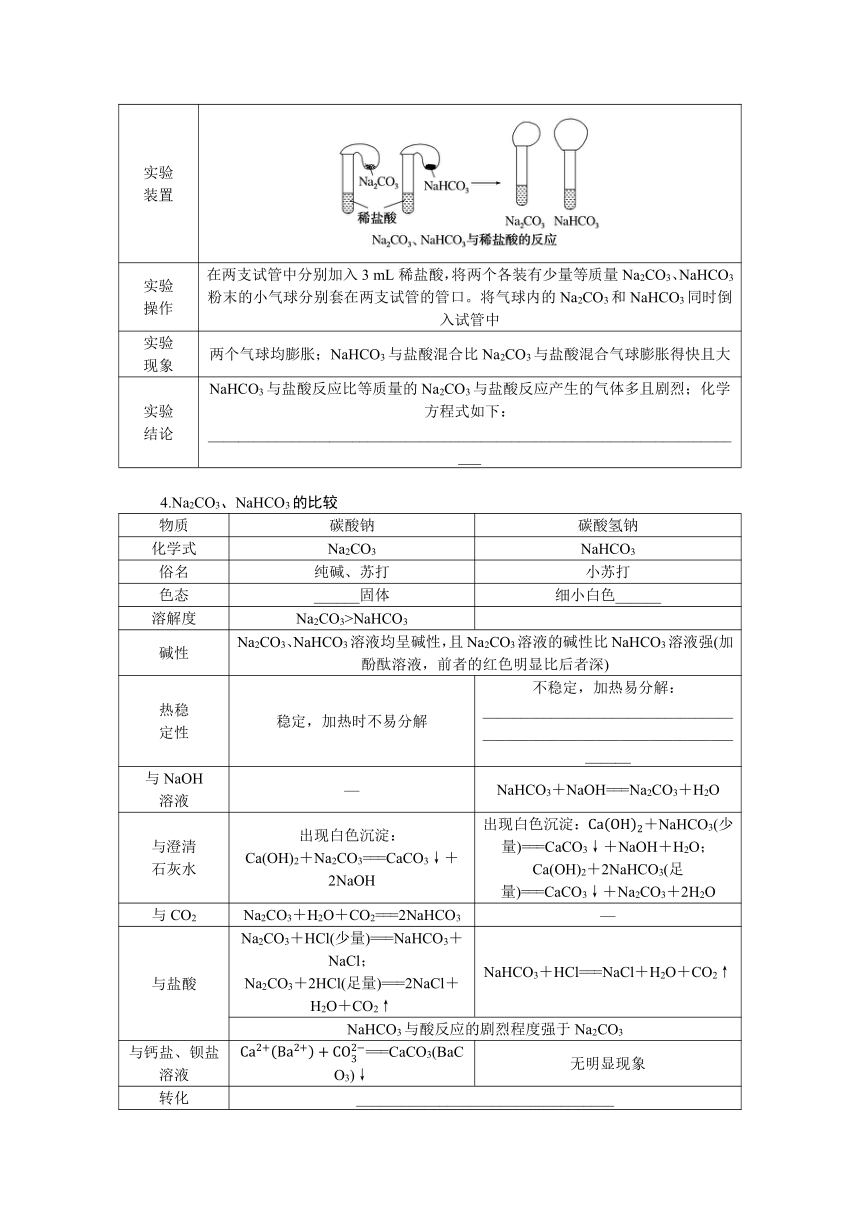
第3课时 碳酸钠和碳酸氢钠 焰色试验
素养要求
1.实验探究认识Na2CO3、NaHCO3的相关性质,理解并掌握Na2CO3、NaHCO3相互转化的途径。
2.了解焰色试验的现象及原理。
3.通过阅读科学史话《侯德榜和侯氏制碱法》,参与研究与实践“了解纯碱的生产历史”,认识化学在纯碱生产中的贡献,增强实验探究与创新意识,提升科学精神与社会责任感。
分点突破一 碳酸钠与碳酸氢钠
1.Na2CO3和NaHCO3的溶解性和水溶液酸碱性的探究
物质 Na2CO3(1 g) NaHCO3(1 g)
样品外观 白色粉末 细小的白色晶体
实验操作 ①滴入几滴水,并将温度计分别插入其中 结块变成晶体,温度计示数__________ 少部分溶解,温度计示数略有__________
②加入5 mL水 ______溶解 固体量有所______
③滴入1~2滴酚酞溶液 溶液呈________ 溶液呈________
初步结论 加水先变成含结晶水的晶体,溶于水放热,溶液碱性比强,Na2CO3的溶解度较大 加水少量溶解,溶于水吸热,溶液碱性比Na2CO3的弱,比Na2CO3的溶解度小
2.Na2CO3和NaHCO3热稳定性的探究
实验操作 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3很稳定,受热不易发生分解
澄清石灰水变浑浊 NaHCO3不稳定,受热容易分解:________________________________________________________________________
3.碳酸钠、碳酸氢钠与盐酸反应的比较
实验 装置
实验 操作 在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中
实验 现象 两个气球均膨胀;NaHCO3与盐酸混合比Na2CO3与盐酸混合气球膨胀得快且大
实验 结论 NaHCO3与盐酸反应比等质量的Na2CO3与盐酸反应产生的气体多且剧烈;化学方程式如下:________________________________________________________________________
4.Na2CO3、NaHCO3的比较
物质 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 ______固体 细小白色______
溶解度 Na2CO3>NaHCO3
碱性 Na2CO3、NaHCO3溶液均呈碱性,且Na2CO3溶液的碱性比NaHCO3溶液强(加酚酞溶液,前者的红色明显比后者深)
热稳 定性 稳定,加热时不易分解 不稳定,加热易分解:________________________________________________________________________
与NaOH 溶液 — NaHCO3+NaOH===Na2CO3+H2O
与澄清 石灰水 出现白色沉淀: Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 出现白色沉淀:+NaHCO3(少量)===CaCO3↓+NaOH+H2O; Ca(OH)2+2NaHCO3(足量)===CaCO3↓+Na2CO3+2H2O
与CO2 Na2CO3+H2O+CO2===2NaHCO3 —
与盐酸 Na2CO3+HCl(少量)===NaHCO3+NaCl; Na2CO3+2HCl(足量)===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3与酸反应的剧烈程度强于Na2CO3
与钙盐、钡盐溶液 ===CaCO3(BaCO3)↓ 无明显现象
转化 __________________________________
特别提醒 1.盐酸逐滴加入到Na2CO3溶液中:
(1)现象:开始无明显现象,后有无色气体放出。
(2)原理:(无明显现象),
+H+===CO2↑+H2O(无色气体放出)。
2.Na2CO3溶液逐滴加入到稀盐酸中:
(1)现象:有无色气体放出。
(2)原理:+2H+===CO2↑+H2O。
5.碳酸钠与碳酸氢钠的用途
(1)Na2CO3的用途有纺织、____________、造纸、________等。
(2)NaHCO3的用途有________、________等。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)Na2CO3固体中的NaHCO3可加热除去。( )
(2)Na2CO3、NaHCO3都能与NaOH溶液反应。( )
(3)Na2CO3俗称纯碱,所以Na2CO3属于碱。( )
(4)NaHCO3溶液中加入稀HCl:
+2H+===CO2↑+H2O。( )
(5)
用如图装置(夹持、加热装置已略)进行实验,由②中澄清石灰水变浑浊,可证明①中NaHCO3固体受热分解。( )
(6)分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠,两种物质均受热分解。( )
2.Na2CO3又称纯碱,苏打,是一种重要的化工原料。下列关于Na2CO3的说法,错误的是( )
A.它的俗名是纯碱
B.它是一种碱
C.它的水溶液呈碱性
D.它是一种盐
3.下列物质的溶液,能与小苏打溶液发生化学反应,既无气体生成也无沉淀生成的是( )
A.苏打 B.氯化氢
C.熟石灰 D.烧碱
4.下列关于Na2CO3和NaHCO3性质的说法,正确的是( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3>Na2CO3
C.滴加少量稀盐酸均有气泡产生
D.Na2CO3能转化成NaHCO3,NaHCO3能转化成Na2CO3
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠俗称________,其水溶液显________(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可以治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者________(填“>”“<”或“=”)后者。
分点突破二 焰色试验
1.焰色试验的探究
实验步骤
2.概念
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,这在化学上叫作__________。
3.几种常见金属元素焰色试验的颜色
金属 钠 钾 锂 钙 锶 钡 铜
颜色 ____色 紫色(透过蓝色钴玻璃) 紫红色 ______色 洋红色 ______色 绿色
4.应用
(1)检验金属元素的存在,如鉴别NaCl、KCl溶液。
(2)利用焰色试验制节日烟花。
特别提醒 焰色试验的注意点
(1)焰色试验是元素的性质,而不仅仅是单质或某种化合物的性质。
(2)若某样品焰色为黄色,可以判断其中一定有钠元素,但不能说明一定无钾元素。因为钠产生的焰色黄色能掩盖钾产生的紫色。
(3)焰色试验可用来鉴别一些金属元素,这种鉴别物质的方法属于物理方法,而不是化学方法。
(4)清洗铂丝时不能用稀硫酸代替盐酸,因为硫酸的熔、沸点较高,难挥发。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+。( )
(2)焰色试验的铂丝可用稀硫酸洗。( )
(3)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液。( )
(4)焰色试验是金属元素的化学性质。( )
2.小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
3.焰色试验操作中需要用到的仪器是( )
4.依据已有知识,下列各组物质只能用焰色试验鉴别的是( )
A.Na2CO3、NaCl B.KCl、NaCl
C.CaCl2、NaCl D.Na2CO3、CaCl2
第3课时 碳酸钠和碳酸氢钠 焰色试验
分点突破一 碳酸钠与碳酸氢钠
1.上升 下降 完全 减少 红色 浅红色
2.2NaHCO3Na2CO3+CO2↑+H2O
3.Na2CO3+2HCl===2NaCl+CO2↑+H2O、
NaHCO3+HCl===NaCl+CO2↑+H2O
4.白色 晶体 2NaHCO3Na2CO3+H2O+CO2↑
5.(1)制皂 制玻璃 (2)制药 焙制糕点
即学即练
1.答案:(1)√ (2)× (3)× (4)× (5)√ (6)×
2.解析:碳酸钠的俗名是纯碱,A正确;碳酸钠是一种盐,不是碱,B错误;碳酸钠溶于水,它的水溶液呈碱性,C正确;碳酸钠是由碳酸根离子和钠离子组成的一种盐,D正确。
答案:B
3.解析:A项,不反应,不符合题意;B项,反应为NaHCO3+HCl===NaCl+CO2↑+H2O,不符合题意;C项,反应为NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O或===CaCO3↓+Na2CO3+2H2O,不符合题意;D项,反应为NaHCO3+NaOH===Na2CO3+H2O,符合题意。
答案:D
4.解析:A项,在水中的溶解度:NaHCO3答案:D
5.答案:(1)小苏打 碱 ===H2O+CO2↑ <
分点突破二 焰色试验
1.盐酸 外焰 盐酸
2.焰色试验
3.黄 砖红 黄绿
即学即练
1.答案:(1)× (2)× (3)√ (4)×
2.解析:钠元素的焰色试验为黄色,钾元素的焰色试验为紫色,观察钾元素的焰色试验时必须透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的存在。
答案:D
3.答案:D
4.解析:Na2CO3、NaCl中的阳离子都是Na+,不能通过焰色试验进行鉴别,A项错误;KCl、NaCl中阴离子相同,无法通过化学方法鉴别,但其阳离子K+、Na+的焰色不同,故只能通过焰色试验进行鉴别,B项正确;CaCl2、NaCl中阴离子相同,可利用Ca2+、Na+的焰色不同进行鉴别,也可用Na2CO3溶液进行鉴别,C项错误;Na2CO3、CaCl2可用焰色试验进行鉴别,也可用Na2CO3溶液或盐酸进行鉴别,D项错误。
答案:B
素养要求
1.实验探究认识Na2CO3、NaHCO3的相关性质,理解并掌握Na2CO3、NaHCO3相互转化的途径。
2.了解焰色试验的现象及原理。
3.通过阅读科学史话《侯德榜和侯氏制碱法》,参与研究与实践“了解纯碱的生产历史”,认识化学在纯碱生产中的贡献,增强实验探究与创新意识,提升科学精神与社会责任感。
分点突破一 碳酸钠与碳酸氢钠
1.Na2CO3和NaHCO3的溶解性和水溶液酸碱性的探究
物质 Na2CO3(1 g) NaHCO3(1 g)
样品外观 白色粉末 细小的白色晶体
实验操作 ①滴入几滴水,并将温度计分别插入其中 结块变成晶体,温度计示数__________ 少部分溶解,温度计示数略有__________
②加入5 mL水 ______溶解 固体量有所______
③滴入1~2滴酚酞溶液 溶液呈________ 溶液呈________
初步结论 加水先变成含结晶水的晶体,溶于水放热,溶液碱性比强,Na2CO3的溶解度较大 加水少量溶解,溶于水吸热,溶液碱性比Na2CO3的弱,比Na2CO3的溶解度小
2.Na2CO3和NaHCO3热稳定性的探究
实验操作 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3很稳定,受热不易发生分解
澄清石灰水变浑浊 NaHCO3不稳定,受热容易分解:________________________________________________________________________
3.碳酸钠、碳酸氢钠与盐酸反应的比较
实验 装置
实验 操作 在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中
实验 现象 两个气球均膨胀;NaHCO3与盐酸混合比Na2CO3与盐酸混合气球膨胀得快且大
实验 结论 NaHCO3与盐酸反应比等质量的Na2CO3与盐酸反应产生的气体多且剧烈;化学方程式如下:________________________________________________________________________
4.Na2CO3、NaHCO3的比较
物质 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 ______固体 细小白色______
溶解度 Na2CO3>NaHCO3
碱性 Na2CO3、NaHCO3溶液均呈碱性,且Na2CO3溶液的碱性比NaHCO3溶液强(加酚酞溶液,前者的红色明显比后者深)
热稳 定性 稳定,加热时不易分解 不稳定,加热易分解:________________________________________________________________________
与NaOH 溶液 — NaHCO3+NaOH===Na2CO3+H2O
与澄清 石灰水 出现白色沉淀: Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 出现白色沉淀:+NaHCO3(少量)===CaCO3↓+NaOH+H2O; Ca(OH)2+2NaHCO3(足量)===CaCO3↓+Na2CO3+2H2O
与CO2 Na2CO3+H2O+CO2===2NaHCO3 —
与盐酸 Na2CO3+HCl(少量)===NaHCO3+NaCl; Na2CO3+2HCl(足量)===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3与酸反应的剧烈程度强于Na2CO3
与钙盐、钡盐溶液 ===CaCO3(BaCO3)↓ 无明显现象
转化 __________________________________
特别提醒 1.盐酸逐滴加入到Na2CO3溶液中:
(1)现象:开始无明显现象,后有无色气体放出。
(2)原理:(无明显现象),
+H+===CO2↑+H2O(无色气体放出)。
2.Na2CO3溶液逐滴加入到稀盐酸中:
(1)现象:有无色气体放出。
(2)原理:+2H+===CO2↑+H2O。
5.碳酸钠与碳酸氢钠的用途
(1)Na2CO3的用途有纺织、____________、造纸、________等。
(2)NaHCO3的用途有________、________等。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)Na2CO3固体中的NaHCO3可加热除去。( )
(2)Na2CO3、NaHCO3都能与NaOH溶液反应。( )
(3)Na2CO3俗称纯碱,所以Na2CO3属于碱。( )
(4)NaHCO3溶液中加入稀HCl:
+2H+===CO2↑+H2O。( )
(5)
用如图装置(夹持、加热装置已略)进行实验,由②中澄清石灰水变浑浊,可证明①中NaHCO3固体受热分解。( )
(6)分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠,两种物质均受热分解。( )
2.Na2CO3又称纯碱,苏打,是一种重要的化工原料。下列关于Na2CO3的说法,错误的是( )
A.它的俗名是纯碱
B.它是一种碱
C.它的水溶液呈碱性
D.它是一种盐
3.下列物质的溶液,能与小苏打溶液发生化学反应,既无气体生成也无沉淀生成的是( )
A.苏打 B.氯化氢
C.熟石灰 D.烧碱
4.下列关于Na2CO3和NaHCO3性质的说法,正确的是( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3>Na2CO3
C.滴加少量稀盐酸均有气泡产生
D.Na2CO3能转化成NaHCO3,NaHCO3能转化成Na2CO3
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠俗称________,其水溶液显________(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可以治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者________(填“>”“<”或“=”)后者。
分点突破二 焰色试验
1.焰色试验的探究
实验步骤
2.概念
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,这在化学上叫作__________。
3.几种常见金属元素焰色试验的颜色
金属 钠 钾 锂 钙 锶 钡 铜
颜色 ____色 紫色(透过蓝色钴玻璃) 紫红色 ______色 洋红色 ______色 绿色
4.应用
(1)检验金属元素的存在,如鉴别NaCl、KCl溶液。
(2)利用焰色试验制节日烟花。
特别提醒 焰色试验的注意点
(1)焰色试验是元素的性质,而不仅仅是单质或某种化合物的性质。
(2)若某样品焰色为黄色,可以判断其中一定有钠元素,但不能说明一定无钾元素。因为钠产生的焰色黄色能掩盖钾产生的紫色。
(3)焰色试验可用来鉴别一些金属元素,这种鉴别物质的方法属于物理方法,而不是化学方法。
(4)清洗铂丝时不能用稀硫酸代替盐酸,因为硫酸的熔、沸点较高,难挥发。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+。( )
(2)焰色试验的铂丝可用稀硫酸洗。( )
(3)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液。( )
(4)焰色试验是金属元素的化学性质。( )
2.小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
3.焰色试验操作中需要用到的仪器是( )
4.依据已有知识,下列各组物质只能用焰色试验鉴别的是( )
A.Na2CO3、NaCl B.KCl、NaCl
C.CaCl2、NaCl D.Na2CO3、CaCl2
第3课时 碳酸钠和碳酸氢钠 焰色试验
分点突破一 碳酸钠与碳酸氢钠
1.上升 下降 完全 减少 红色 浅红色
2.2NaHCO3Na2CO3+CO2↑+H2O
3.Na2CO3+2HCl===2NaCl+CO2↑+H2O、
NaHCO3+HCl===NaCl+CO2↑+H2O
4.白色 晶体 2NaHCO3Na2CO3+H2O+CO2↑
5.(1)制皂 制玻璃 (2)制药 焙制糕点
即学即练
1.答案:(1)√ (2)× (3)× (4)× (5)√ (6)×
2.解析:碳酸钠的俗名是纯碱,A正确;碳酸钠是一种盐,不是碱,B错误;碳酸钠溶于水,它的水溶液呈碱性,C正确;碳酸钠是由碳酸根离子和钠离子组成的一种盐,D正确。
答案:B
3.解析:A项,不反应,不符合题意;B项,反应为NaHCO3+HCl===NaCl+CO2↑+H2O,不符合题意;C项,反应为NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O或===CaCO3↓+Na2CO3+2H2O,不符合题意;D项,反应为NaHCO3+NaOH===Na2CO3+H2O,符合题意。
答案:D
4.解析:A项,在水中的溶解度:NaHCO3
5.答案:(1)小苏打 碱 ===H2O+CO2↑ <
分点突破二 焰色试验
1.盐酸 外焰 盐酸
2.焰色试验
3.黄 砖红 黄绿
即学即练
1.答案:(1)× (2)× (3)√ (4)×
2.解析:钠元素的焰色试验为黄色,钾元素的焰色试验为紫色,观察钾元素的焰色试验时必须透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的存在。
答案:D
3.答案:D
4.解析:Na2CO3、NaCl中的阳离子都是Na+,不能通过焰色试验进行鉴别,A项错误;KCl、NaCl中阴离子相同,无法通过化学方法鉴别,但其阳离子K+、Na+的焰色不同,故只能通过焰色试验进行鉴别,B项正确;CaCl2、NaCl中阴离子相同,可利用Ca2+、Na+的焰色不同进行鉴别,也可用Na2CO3溶液进行鉴别,C项错误;Na2CO3、CaCl2可用焰色试验进行鉴别,也可用Na2CO3溶液或盐酸进行鉴别,D项错误。
答案:B
