2024-2025学年人教版必修第一册 2.2.2氯气的实验室制法 氯离子的检验 学案(含答案)
文档属性
| 名称 | 2024-2025学年人教版必修第一册 2.2.2氯气的实验室制法 氯离子的检验 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 890.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 11:34:12 | ||
图片预览


文档简介
第2课时 氯气的实验室制法 氯离子的检验
素养要求
1.掌握氯气的制备原理及装置。
2.能结合实验室制取Cl2的装置特点设计制备其他气体的实验装置,培养科学探究与创新意识,提升实验能力。
3.通过对比实验掌握氯离子的检验方法,培养证据推理与科学探究能力。
分点突破一 氯气的实验室制法
1.反应原理
二氧化锰(软锰矿的主要成分)和浓盐酸反应。
MnO2+4HCl(浓)________________
表现还原性和酸性
2.实验装置
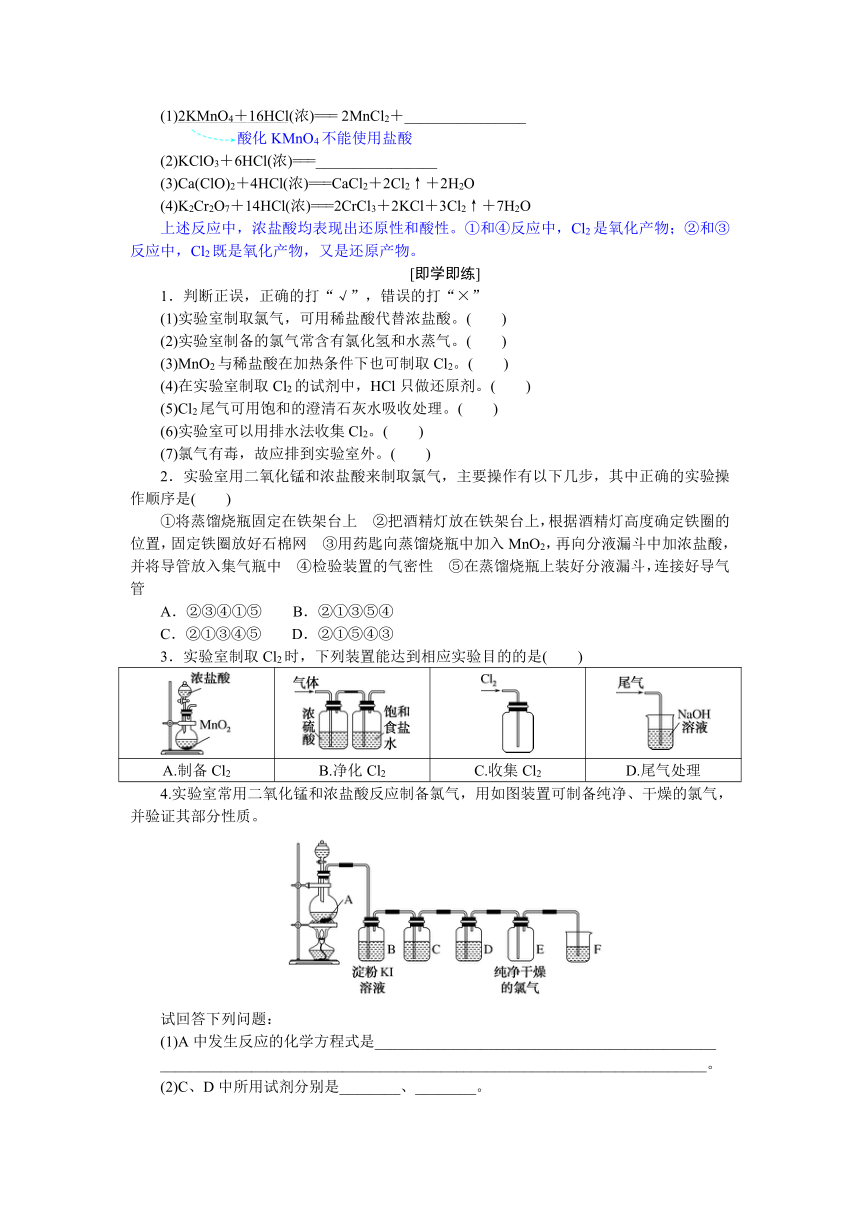
制取纯净、干燥的Cl2的实验装置如图所示。
(1)发生装置:如图中A(“固+液气”型)。
(2)净化装置:如图中B,用饱和食盐水除去Cl2中的________气体。
(3)干燥装置:如图中C,用浓H2SO4吸收Cl2中的________。
(4)收集方法:用________________收集Cl2,如图中D所示。
(5)验满方法:________________________________________________________________________
________________________________________________________________________。
(6)尾气吸收:用NaOH溶液吸收多余的Cl2(如图中E所示),发生的反应为
Cl2+2NaOH===________________
特别提醒 (1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸,稀盐酸与MnO2不反应,反应停止。
(2)不能用澄清石灰水来吸收Cl2,原因是在水中的溶解度很小,不能将Cl2吸收完全。
3.实验室制取氯气的简易方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等强氧化剂代替MnO2制取氯气,反应不需要加热且反应速率较快,如
(1)2KMnO4+16HCl(浓)=== 2MnCl2+________________
酸化KMnO4不能使用盐酸
(2)KClO3+6HCl(浓)===________________
(3)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(4)K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
上述反应中,浓盐酸均表现出还原性和酸性。①和④反应中,Cl2是氧化产物;②和③反应中,Cl2既是氧化产物,又是还原产物。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)实验室制取氯气,可用稀盐酸代替浓盐酸。( )
(2)实验室制备的氯气常含有氯化氢和水蒸气。( )
(3)MnO2与稀盐酸在加热条件下也可制取Cl2。( )
(4)在实验室制取Cl2的试剂中,HCl只做还原剂。( )
(5)Cl2尾气可用饱和的澄清石灰水吸收处理。( )
(6)实验室可以用排水法收集Cl2。( )
(7)氯气有毒,故应排到实验室外。( )
2.实验室用二氧化锰和浓盐酸来制取氯气,主要操作有以下几步,其中正确的实验操作顺序是( )
①将蒸馏烧瓶固定在铁架台上 ②把酒精灯放在铁架台上,根据酒精灯高度确定铁圈的位置,固定铁圈放好石棉网 ③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中 ④检验装置的气密性 ⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②③④①⑤ B.②①③⑤④
C.②①③④⑤ D.②①⑤④③
3.实验室制取Cl2时,下列装置能达到相应实验目的的是( )
A.制备Cl2 B.净化Cl2 C.收集Cl2 D.尾气处理
4.实验室常用二氧化锰和浓盐酸反应制备氯气,用如图装置可制备纯净、干燥的氯气,并验证其部分性质。
试回答下列问题:
(1)A中发生反应的化学方程式是_____________________________________________
________________________________________________________________________。
(2)C、D中所用试剂分别是________、________。
(3)B中出现的现象是__________________________________________________
________________________________________________________________________。
(4)请用离子方程式表示F中NaOH溶液的作用:
________________________________________________________________________。分
点突破二 Cl-的检验
1.实验探究
实验现象 离子方程式或解释
加入AgNO3 溶液 加入稀硝酸
稀盐酸 ____________ ____________ Ag++Cl-===________
NaCl 溶液 ____________ ____________ ________________________________________________________________________
Na2CO3 溶液 ____________ ________________________________________________________________________ 2Ag++===Ag2CO3↓ Ag2CO3+2H+===2Ag++CO2↑+H2O
2.氯离子的检验方法
(1)操作方法:向未知溶液中先加____________,再加____________。
(2)现象:产生________,加稀硝酸时,沉淀________。
不能加HCl和H2SO4
(3)原理:________________________。
(4)加入稀硝酸的目的:排除________等离子的干扰。
特别提醒 (1)不能用稀盐酸酸化,因为盐酸会引入Cl-。
(2)Cl-的检验步骤也可表述为在待测液中直接加入稀硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明溶液中含有Cl-。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)溶液中加入AgNO3溶液有沉淀,说明溶液中一定含Cl-。( )
(2)NaClO中含有氯元素,故向NaClO溶液中加入用硝酸酸化的AgNO3溶液,可产生白色沉淀。( )
(3)检验Cl2中是否混有HCl,可加入AgNO3溶液中,若有白色沉淀产生,说明Cl2中混有HCl。( )
(4)检验Na2CO3溶液中是否有NaCl杂质,可先加AgNO3溶液,再加过量的稀盐酸,若沉淀不溶解,则有NaCl杂质。( )
2.在某未知溶液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断该未知溶液中含有( )
A.Cl-、 B.Cl-、
C.Cl-、 D.Cl-、OH-
3.用如图所示方法,检验某固体中是否含有Cl-,下列说法正确的是( )
A.①是BaCl2溶液,②是稀盐酸
B.①是稀盐酸,②是稀BaCl2溶液
C.①是稀硝酸,②是AgNO3溶液
D.①是稀硫酸,②是AgNO3溶液
4.下列检验Cl-的方法正确的是( )
A.在某溶液中滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
B.在某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
C.在某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明该溶液中含有Cl-
D.在某溶液中先滴加稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
1.实验室制取氯气装置如图所示,主要操作步骤为
①加热制取氯气 ②收集氯气 ③检查装置气密性 ④处理尾气。
下列选项中正确的实验操作顺序是( )
A.①②③④ B.③①②④
C.②④③① D.④③①②
2.欲除去Cl2中的少量HCl气体,可选用( )
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
3.实验室制取的氯气常用排饱和食盐水的方法收集,原因是( )
A.可产生更多的氯气
B.只有饱和食盐水才能除去HCl杂质
C.既能除去HCl,又能减少Cl2的溶解
D.食盐水易得到
4.下列装置或原理能达到实验目的的是( )
5.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是________,可能含有的成分是________;
(2)请写出上述实验中有关反应的离子方程式:______________________________________。
6.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:(已知:2KI+Cl2===I2+2KCl,淀粉溶液遇I2变蓝)
请回答下列问题:
(1)整套实验装置的连接顺序是f接________,________接________,________接________。(填各接口处的字母代号)
(2)E装置中制取氯气的化学方程式是
________________________________________________________________________
________________________________________________________________________。
(3)B装置的作用是________________________;A装置中试剂X是________。
(4)C装置中可观察到的现象是
________________________________________________________________________,
D装置中可观察到的现象是
________________________________________________________________________。
第2课时 氯气的实验室制法 氯离子的检验
分点突破一 氯气的实验室制法
1.MnCl2+Cl2↑+2H2O
2.(2)HCl (3)水蒸气 (4)向上排空气法 (5)用湿润的淀粉—KI试纸(变蓝)或观察瓶口的颜色 (6)NaCl+NaClO+H2O
3.(1)2KCl+5Cl2↑+8H2O (2)KCl+3Cl2↑+3H2O
即学即练
1.答案:(1)× (2)√ (3)× (4)× (5)× (6)× (7)×
2.解析:安装仪器时遵循顺序:由下而上,由左向右;安装好仪器后先检查气密性,再加入药品。
答案:D
3.解析:A.二氧化锰与浓盐酸共热反应制备氯气,由图可知,装置中缺酒精灯,故A错误;B.净化氯气时,应先将混合气体通过盛有饱和食盐水的洗气瓶除去氯气中混有的氯化氢气体,再通过盛有浓硫酸的洗气瓶干燥氯气,由图可知,洗气瓶的顺序颠倒,得到的是含有水蒸气的氯气,故B错误;C.由图可知,收集氯气的装置只有进气管,无出气管,不能收集氯气,故C错误;D.氯气有毒,收集氯气后应将尾气通过盛有氢氧化钠溶液的烧杯中吸收氯气,防止污染空气,故D正确。
答案:D
4.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)饱和食盐水 浓硫酸 (3)溶液由无色变为蓝色
(4)Cl2+2OH-===Cl-+ClO-+H2O
分点突破二 Cl-的检验
1.产生白色沉淀 沉淀不溶解 AgCl↓ 产生白色沉淀 沉淀不溶解 Ag++Cl-===AgCl↓ 产生白色沉淀 沉淀溶解,有气泡产生
2.(1)AgNO3溶液 稀HNO3 (2)白色沉淀 不溶解
(3)Ag++Cl-===AgCl↓
即学即练
1.答案:(1)× (2)× (3)× (4)×
2.答案:C
3.答案:C
4.答案:D
随堂演练全通关
1.答案:B
2.解析:利用了HCl极易溶于水而Cl2在饱和食盐水中溶解度很小的原理。
答案:B
3.答案:C
4.解析:高锰酸钾具有强氧化性,浓盐酸与高锰酸钾在常温下发生氧化还原反应可生成氯气,能用于制取氯气,故A正确;氯气和氯化氢气体都能与氢氧化钠溶液反应,应用饱和食盐水除去氯气中的氯化氢,故B错误;氯气与饱和食盐水不反应,应用氢氧化钠溶液进行尾气处理,故C错误;氯水中含有的次氯酸具有漂白性,可漂白pH试纸,不能用pH试纸测定氯水的pH,故D错误。
答案:A
5.解析:由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K2CO3;根据沉淀不完全消失可知,一定含有KCl。
答案:(1)KCl和K2CO3 KNO3
===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑
6.解析:(1)制得的Cl2中含有HCl、H2O(g)杂质,先通过饱和食盐水、浓硫酸除去杂质,再利用向上排空气法收集,最后通过淀粉碘化钾溶液探究其性质。因此实验装置的连接顺序为f→a→b→e→d→c。(2)E装置为MnO2氧化浓盐酸制取Cl2的装置,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。(3)B装置中盛装浓硫酸,作用是吸收H2O(g),干燥Cl2;A装置中试剂X是饱和食盐水,作用是除去HCl。(4)C装置中氯气置换出单质碘,因此溶液变为蓝色;D装置中Cl2与NaOH反应,而使滴有酚酞的氢氧化钠溶液红色逐渐褪去。
答案:(1)a b e d c
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)干燥Cl2 饱和食盐水
(4)溶液变为蓝色 溶液红色逐渐褪去
素养要求
1.掌握氯气的制备原理及装置。
2.能结合实验室制取Cl2的装置特点设计制备其他气体的实验装置,培养科学探究与创新意识,提升实验能力。
3.通过对比实验掌握氯离子的检验方法,培养证据推理与科学探究能力。
分点突破一 氯气的实验室制法
1.反应原理
二氧化锰(软锰矿的主要成分)和浓盐酸反应。
MnO2+4HCl(浓)________________
表现还原性和酸性
2.实验装置
制取纯净、干燥的Cl2的实验装置如图所示。
(1)发生装置:如图中A(“固+液气”型)。
(2)净化装置:如图中B,用饱和食盐水除去Cl2中的________气体。
(3)干燥装置:如图中C,用浓H2SO4吸收Cl2中的________。
(4)收集方法:用________________收集Cl2,如图中D所示。
(5)验满方法:________________________________________________________________________
________________________________________________________________________。
(6)尾气吸收:用NaOH溶液吸收多余的Cl2(如图中E所示),发生的反应为
Cl2+2NaOH===________________
特别提醒 (1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸,稀盐酸与MnO2不反应,反应停止。
(2)不能用澄清石灰水来吸收Cl2,原因是在水中的溶解度很小,不能将Cl2吸收完全。
3.实验室制取氯气的简易方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等强氧化剂代替MnO2制取氯气,反应不需要加热且反应速率较快,如
(1)2KMnO4+16HCl(浓)=== 2MnCl2+________________
酸化KMnO4不能使用盐酸
(2)KClO3+6HCl(浓)===________________
(3)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(4)K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
上述反应中,浓盐酸均表现出还原性和酸性。①和④反应中,Cl2是氧化产物;②和③反应中,Cl2既是氧化产物,又是还原产物。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)实验室制取氯气,可用稀盐酸代替浓盐酸。( )
(2)实验室制备的氯气常含有氯化氢和水蒸气。( )
(3)MnO2与稀盐酸在加热条件下也可制取Cl2。( )
(4)在实验室制取Cl2的试剂中,HCl只做还原剂。( )
(5)Cl2尾气可用饱和的澄清石灰水吸收处理。( )
(6)实验室可以用排水法收集Cl2。( )
(7)氯气有毒,故应排到实验室外。( )
2.实验室用二氧化锰和浓盐酸来制取氯气,主要操作有以下几步,其中正确的实验操作顺序是( )
①将蒸馏烧瓶固定在铁架台上 ②把酒精灯放在铁架台上,根据酒精灯高度确定铁圈的位置,固定铁圈放好石棉网 ③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中 ④检验装置的气密性 ⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②③④①⑤ B.②①③⑤④
C.②①③④⑤ D.②①⑤④③
3.实验室制取Cl2时,下列装置能达到相应实验目的的是( )
A.制备Cl2 B.净化Cl2 C.收集Cl2 D.尾气处理
4.实验室常用二氧化锰和浓盐酸反应制备氯气,用如图装置可制备纯净、干燥的氯气,并验证其部分性质。
试回答下列问题:
(1)A中发生反应的化学方程式是_____________________________________________
________________________________________________________________________。
(2)C、D中所用试剂分别是________、________。
(3)B中出现的现象是__________________________________________________
________________________________________________________________________。
(4)请用离子方程式表示F中NaOH溶液的作用:
________________________________________________________________________。分
点突破二 Cl-的检验
1.实验探究
实验现象 离子方程式或解释
加入AgNO3 溶液 加入稀硝酸
稀盐酸 ____________ ____________ Ag++Cl-===________
NaCl 溶液 ____________ ____________ ________________________________________________________________________
Na2CO3 溶液 ____________ ________________________________________________________________________ 2Ag++===Ag2CO3↓ Ag2CO3+2H+===2Ag++CO2↑+H2O
2.氯离子的检验方法
(1)操作方法:向未知溶液中先加____________,再加____________。
(2)现象:产生________,加稀硝酸时,沉淀________。
不能加HCl和H2SO4
(3)原理:________________________。
(4)加入稀硝酸的目的:排除________等离子的干扰。
特别提醒 (1)不能用稀盐酸酸化,因为盐酸会引入Cl-。
(2)Cl-的检验步骤也可表述为在待测液中直接加入稀硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明溶液中含有Cl-。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)溶液中加入AgNO3溶液有沉淀,说明溶液中一定含Cl-。( )
(2)NaClO中含有氯元素,故向NaClO溶液中加入用硝酸酸化的AgNO3溶液,可产生白色沉淀。( )
(3)检验Cl2中是否混有HCl,可加入AgNO3溶液中,若有白色沉淀产生,说明Cl2中混有HCl。( )
(4)检验Na2CO3溶液中是否有NaCl杂质,可先加AgNO3溶液,再加过量的稀盐酸,若沉淀不溶解,则有NaCl杂质。( )
2.在某未知溶液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断该未知溶液中含有( )
A.Cl-、 B.Cl-、
C.Cl-、 D.Cl-、OH-
3.用如图所示方法,检验某固体中是否含有Cl-,下列说法正确的是( )
A.①是BaCl2溶液,②是稀盐酸
B.①是稀盐酸,②是稀BaCl2溶液
C.①是稀硝酸,②是AgNO3溶液
D.①是稀硫酸,②是AgNO3溶液
4.下列检验Cl-的方法正确的是( )
A.在某溶液中滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
B.在某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
C.在某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明该溶液中含有Cl-
D.在某溶液中先滴加稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,说明该溶液中含有Cl-
1.实验室制取氯气装置如图所示,主要操作步骤为
①加热制取氯气 ②收集氯气 ③检查装置气密性 ④处理尾气。
下列选项中正确的实验操作顺序是( )
A.①②③④ B.③①②④
C.②④③① D.④③①②
2.欲除去Cl2中的少量HCl气体,可选用( )
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
3.实验室制取的氯气常用排饱和食盐水的方法收集,原因是( )
A.可产生更多的氯气
B.只有饱和食盐水才能除去HCl杂质
C.既能除去HCl,又能减少Cl2的溶解
D.食盐水易得到
4.下列装置或原理能达到实验目的的是( )
5.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是________,可能含有的成分是________;
(2)请写出上述实验中有关反应的离子方程式:______________________________________。
6.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:(已知:2KI+Cl2===I2+2KCl,淀粉溶液遇I2变蓝)
请回答下列问题:
(1)整套实验装置的连接顺序是f接________,________接________,________接________。(填各接口处的字母代号)
(2)E装置中制取氯气的化学方程式是
________________________________________________________________________
________________________________________________________________________。
(3)B装置的作用是________________________;A装置中试剂X是________。
(4)C装置中可观察到的现象是
________________________________________________________________________,
D装置中可观察到的现象是
________________________________________________________________________。
第2课时 氯气的实验室制法 氯离子的检验
分点突破一 氯气的实验室制法
1.MnCl2+Cl2↑+2H2O
2.(2)HCl (3)水蒸气 (4)向上排空气法 (5)用湿润的淀粉—KI试纸(变蓝)或观察瓶口的颜色 (6)NaCl+NaClO+H2O
3.(1)2KCl+5Cl2↑+8H2O (2)KCl+3Cl2↑+3H2O
即学即练
1.答案:(1)× (2)√ (3)× (4)× (5)× (6)× (7)×
2.解析:安装仪器时遵循顺序:由下而上,由左向右;安装好仪器后先检查气密性,再加入药品。
答案:D
3.解析:A.二氧化锰与浓盐酸共热反应制备氯气,由图可知,装置中缺酒精灯,故A错误;B.净化氯气时,应先将混合气体通过盛有饱和食盐水的洗气瓶除去氯气中混有的氯化氢气体,再通过盛有浓硫酸的洗气瓶干燥氯气,由图可知,洗气瓶的顺序颠倒,得到的是含有水蒸气的氯气,故B错误;C.由图可知,收集氯气的装置只有进气管,无出气管,不能收集氯气,故C错误;D.氯气有毒,收集氯气后应将尾气通过盛有氢氧化钠溶液的烧杯中吸收氯气,防止污染空气,故D正确。
答案:D
4.答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)饱和食盐水 浓硫酸 (3)溶液由无色变为蓝色
(4)Cl2+2OH-===Cl-+ClO-+H2O
分点突破二 Cl-的检验
1.产生白色沉淀 沉淀不溶解 AgCl↓ 产生白色沉淀 沉淀不溶解 Ag++Cl-===AgCl↓ 产生白色沉淀 沉淀溶解,有气泡产生
2.(1)AgNO3溶液 稀HNO3 (2)白色沉淀 不溶解
(3)Ag++Cl-===AgCl↓
即学即练
1.答案:(1)× (2)× (3)× (4)×
2.答案:C
3.答案:C
4.答案:D
随堂演练全通关
1.答案:B
2.解析:利用了HCl极易溶于水而Cl2在饱和食盐水中溶解度很小的原理。
答案:B
3.答案:C
4.解析:高锰酸钾具有强氧化性,浓盐酸与高锰酸钾在常温下发生氧化还原反应可生成氯气,能用于制取氯气,故A正确;氯气和氯化氢气体都能与氢氧化钠溶液反应,应用饱和食盐水除去氯气中的氯化氢,故B错误;氯气与饱和食盐水不反应,应用氢氧化钠溶液进行尾气处理,故C错误;氯水中含有的次氯酸具有漂白性,可漂白pH试纸,不能用pH试纸测定氯水的pH,故D错误。
答案:A
5.解析:由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K2CO3;根据沉淀不完全消失可知,一定含有KCl。
答案:(1)KCl和K2CO3 KNO3
===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑
6.解析:(1)制得的Cl2中含有HCl、H2O(g)杂质,先通过饱和食盐水、浓硫酸除去杂质,再利用向上排空气法收集,最后通过淀粉碘化钾溶液探究其性质。因此实验装置的连接顺序为f→a→b→e→d→c。(2)E装置为MnO2氧化浓盐酸制取Cl2的装置,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。(3)B装置中盛装浓硫酸,作用是吸收H2O(g),干燥Cl2;A装置中试剂X是饱和食盐水,作用是除去HCl。(4)C装置中氯气置换出单质碘,因此溶液变为蓝色;D装置中Cl2与NaOH反应,而使滴有酚酞的氢氧化钠溶液红色逐渐褪去。
答案:(1)a b e d c
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)干燥Cl2 饱和食盐水
(4)溶液变为蓝色 溶液红色逐渐褪去
