2024-2025学年人教版必修第一册 2.1.1活泼的金属单质——钠 作业(含答案)
文档属性
| 名称 | 2024-2025学年人教版必修第一册 2.1.1活泼的金属单质——钠 作业(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 167.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 00:00:00 | ||
图片预览


文档简介
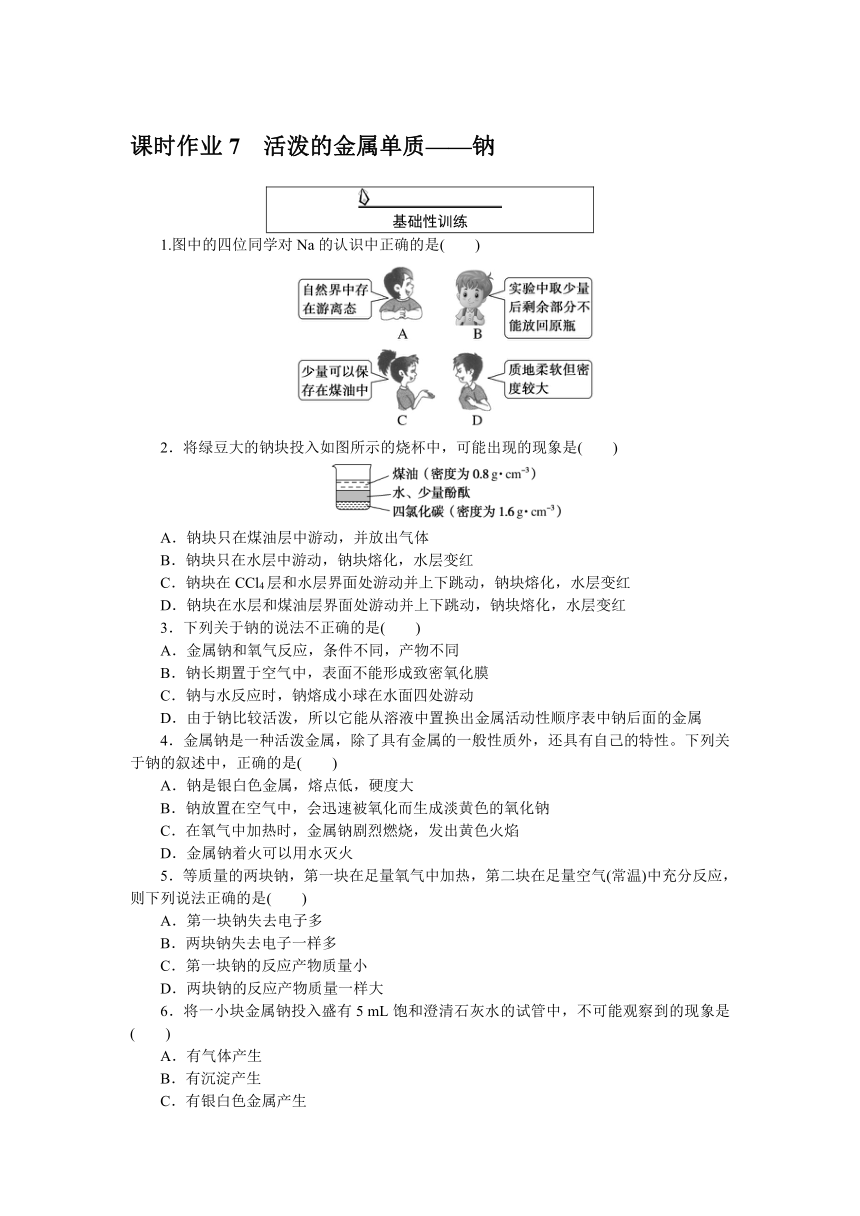
课时作业7 活泼的金属单质——钠
基础性训练
1.图中的四位同学对Na的认识中正确的是( )
2.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在CCl4层和水层界面处游动并上下跳动,钠块熔化,水层变红
D.钠块在水层和煤油层界面处游动并上下跳动,钠块熔化,水层变红
3.下列关于钠的说法不正确的是( )
A.金属钠和氧气反应,条件不同,产物不同
B.钠长期置于空气中,表面不能形成致密氧化膜
C.钠与水反应时,钠熔成小球在水面四处游动
D.由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属
4.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火可以用水灭火
5.等质量的两块钠,第一块在足量氧气中加热,第二块在足量空气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第一块钠的反应产物质量小
D.两块钠的反应产物质量一样大
6.将一小块金属钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A.有气体产生
B.有沉淀产生
C.有银白色金属产生
D.金属钠熔化成闪亮的小球在液面上游动
7.2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
8.不能正确表示下列反应的离子方程式的是( )
A.钠与水反应:
2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:
2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:
2Na+2H+===2Na++H2↑
D.钠跟氯化钾溶液反应:
2Na+2H2O===2Na++2OH-+H2↑
综合性训练
9.将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
10.把金属钠投入到下列物质的溶液中,溶液质量减轻的是( )
A.HCl B.Na2SO4
C.FeCl3 D.NaOH
11.将4.6 g金属钠投入到足量水中,得a g溶液;将4.8 g金属镁投入到足量盐酸中,得b g溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为( )
A.a=b B.a>b
C.a12.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为________,A→C反应的化学方程式为________________________________________________________。
(2)若A是一种非金属,其常见的单质为黑色固体,C是最主要的温室气体,则C的化学式为________________,B→C反应的化学方程式为___________________________________。
A和C是否能反应?________(填“能”或“不能”),若能,写出反应的化学方程式:______________________________。(若不能,此空不填)
13.在实验室里为了研究钠的性质,做了如下实验:
(1)在空气中切开一小块金属钠,可以看到断面呈________色,具有________,但断面很快变________,主要是由于______________________________________________________
________________________________________________________________________。
(2)在如图所示的装置中,先用弹簧夹夹住橡胶管,点燃钠(足量),伸入瓶口中并塞上瓶塞。发生反应的化学方程式为___________________________________________
________________________________________________________________________,
产物的颜色是________;待反应完全并冷却后,打开弹簧夹,则广口瓶内水面上升的水的体积约占瓶内空气体积的________(假设装置的气密性良好且操作正确)。
14.钠是一种非常活泼的金属,观察法和实验法是研究物质性质的基本方法。
(1)该小组同学将金属钠投入CuSO4溶液中,得到蓝色絮状沉淀,写出反应的化学方程式:
________________________________________________________________________。
(2)实验小组研究Na与CO2的反应,装置、步骤和现象如下:
实验步骤和现象:
ⅰ.通入CO2至澄清石灰水变浑浊后,点燃酒精灯。
ⅱ.一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
ⅲ.将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
①步骤ⅰ的目的是________________________________________________________________________
________________________________________________________________________;
②从氧化还原反应的角度,分析步骤ⅱ管壁上生成的黑色物质的成分________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
③写出硬质玻璃管内可能发生的反应方程式:
________________________________________________________________________
________________________________________________________________________。
课时作业7 活泼的金属单质——钠
1.答案:C
2.答案:D
3.解析:钠不能从盐溶液中置换出金属。
答案:D
4.解析:A中,钠的硬度小,可用小刀切割;B中,放置在空气中,钠被缓慢氧化生成白色Na2O;D中,钠着火时不能用水灭火,因为钠与水剧烈反应,产生H2易燃易爆。
答案:C
5.解析:钠在氧气中加热反应产物为过氧化钠、在常温下与空气中氧气反应,产物是氧化钠,反应中钠元素均从0价升高到+1价,则等质量的钠失去的电子数相同,故A错误、B正确;等质量的钠产生的过氧化钠的质量大于氧化钠的质量,故C、D错误。
答案:B
6.解析:该反应中除Na与H2O反应现象A、D外,还会产生Ca(OH)2沉淀,B项所述现象也会出现。
答案:C
7.解析:若2.3 g钠全部生成Na2O,质量为3.1 g;若2.3 g钠全部生成Na2O2,质量为3.9 g,因为3.1 g<3.5 g<3.9 g,故氧化产物应为Na2O和Na2O2的混合物。
答案:C
8.解析:B中钠与CuSO4溶液反应的实质是钠与水反应生成的氢氧化钠再与CuSO4反应,总化学方程式:2Na+2H2O+CuSO4===Cu(OH)2↓+H2↑+Na2SO4。
答案:B
9.解析:钠与水溶液反应均放出氢气;A项,发生反应为2Na+2HCl===2NaCl+H2↑,只有气体无沉淀;B项,NaOH溶液是饱和溶液,投入钠后,消耗水,析出氢氧化钠晶体;C项,钠与水反应生成的氢氧化钠还能进一步与FeCl3反应产生氢氧化铁沉淀;D项,钠与水反应生成的氢氧化钠还能进一步与CuSO4反应产生氢氧化铜沉淀。
答案:A
10.解析:金属钠投入溶液中,由于Na变为离子形式溶于溶液,会使溶液质量增加;但是钠与水、与酸(H+)反应放出H2,都使溶液质量减轻;且钠与水反应生成的碱还有可能和盐的离子生成难溶的碱导致溶液质量减轻,溶液质量是否减轻,就要看这一增一减的净结果。A中2Na+2HCl===2NaCl+H2↑,H+换成Na+,溶液质量增加;B中Na与水反应,H2O中H+换成Na+,溶液质量增加;C中6Na+6H2O+2FeCl3===2Fe(OH)3↓+6NaCl+3H2↑,显然溶液质量减轻;D中2Na+2H2O===2NaOH+H2↑,溶液质量增加。
答案:C
11.解析:溶液的质量等于金属和水或酸的质量之和减去放出H2的质量。
2Na+2H2O===2NaOH+H2↑
46 2
4.6 g 0.2 g
a g=4.6 g+m(H2O)-0.2=4.4 g+m(H2O)
Mg+2HCl===MgCl2+H2↑
24 2
4.8 g 0.4 g
b g=4.8 g+m(HCl)-0.4 g=4.4 g+m(HCl)
因为m(H2O)=m(HCl),所以a=b。
答案:A
12.解析:(1)根据C为淡黄色固体,推知C为Na2O2,则B为Na2O,A为Na,A→C的反应为2Na+O2Na2O2。(2)根据C是最主要的温室气体,推知C为CO2,则A为C,B为CO,A与C能反应,化学方程式为C+CO22CO。
答案:(1)Na2O 2Na+O2Na2O2
(2)CO2 2CO+O22CO2 能 C+CO22CO
13.解析:钠与氧气在点燃条件下生成淡黄色的过氧化钠,反应的化学方程式为2Na+O2Na2O2。因钠足量,钠燃烧耗尽广口瓶中空气中的氧气而使瓶内压强减小,进入广口瓶中的水的体积为瓶内空气中氧气的体积,即。
答案:(1)银白 金属光泽 暗 钠在空气中被氧化为氧化钠 (2)2Na+O2Na2O2 淡黄色
14.解析:(1)将金属钠投入CuSO4溶液中,钠先与水反应生成NaOH和氢气,NaOH再与CuSO4反应生成Cu(OH)2蓝色絮状沉淀,反应的化学方程式为CuSO4+2Na+2H2O===Cu(OH)2↓+Na2SO4+H2↑。(2)①因钠容易和空气中的氧气、水等反应,所以步骤ⅰ中通入CO2至澄清石灰水变浑浊后,再点燃酒精灯的目的是排除实验过程中氧气、水等的干扰;②根据氧化还原反应的原理,金属钠在反应中做还原剂,CO2做氧化剂,其还原产物是黑色固体物质且没有检测到CO,可确定黑色物质是碳;③硬质玻璃管中的固体溶于水无气泡产生,说明钠全部参加了反应,在滤液中加入过量的BaCl2溶液,产生白色沉淀,取白色沉淀加入盐酸,产生气体,说明硬质玻璃管中的固体含有Na2CO3,再次过滤后滤液呈碱性,说明硬质玻璃管中的固体含有Na2O,综上可确定硬质玻璃管中发生的反应可能为4Na+CO22Na2O+C、Na2O+CO2===Na2CO3。
答案:(1)CuSO4+2Na+2H2O===Cu(OH)2↓+Na2SO4+H2↑
(2)①排除氧气、水等的干扰 ②金属钠在反应中做还原剂,CO2做氧化剂,其还原产物是黑色固体物质且没有检测到CO,可确定黑色物质是碳 ③4Na+CO22Na2O+C、Na2O+CO2===Na2CO3
基础性训练
1.图中的四位同学对Na的认识中正确的是( )
2.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在CCl4层和水层界面处游动并上下跳动,钠块熔化,水层变红
D.钠块在水层和煤油层界面处游动并上下跳动,钠块熔化,水层变红
3.下列关于钠的说法不正确的是( )
A.金属钠和氧气反应,条件不同,产物不同
B.钠长期置于空气中,表面不能形成致密氧化膜
C.钠与水反应时,钠熔成小球在水面四处游动
D.由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属
4.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火可以用水灭火
5.等质量的两块钠,第一块在足量氧气中加热,第二块在足量空气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第一块钠的反应产物质量小
D.两块钠的反应产物质量一样大
6.将一小块金属钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A.有气体产生
B.有沉淀产生
C.有银白色金属产生
D.金属钠熔化成闪亮的小球在液面上游动
7.2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
8.不能正确表示下列反应的离子方程式的是( )
A.钠与水反应:
2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:
2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:
2Na+2H+===2Na++H2↑
D.钠跟氯化钾溶液反应:
2Na+2H2O===2Na++2OH-+H2↑
综合性训练
9.将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
10.把金属钠投入到下列物质的溶液中,溶液质量减轻的是( )
A.HCl B.Na2SO4
C.FeCl3 D.NaOH
11.将4.6 g金属钠投入到足量水中,得a g溶液;将4.8 g金属镁投入到足量盐酸中,得b g溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为( )
A.a=b B.a>b
C.a12.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为________,A→C反应的化学方程式为________________________________________________________。
(2)若A是一种非金属,其常见的单质为黑色固体,C是最主要的温室气体,则C的化学式为________________,B→C反应的化学方程式为___________________________________。
A和C是否能反应?________(填“能”或“不能”),若能,写出反应的化学方程式:______________________________。(若不能,此空不填)
13.在实验室里为了研究钠的性质,做了如下实验:
(1)在空气中切开一小块金属钠,可以看到断面呈________色,具有________,但断面很快变________,主要是由于______________________________________________________
________________________________________________________________________。
(2)在如图所示的装置中,先用弹簧夹夹住橡胶管,点燃钠(足量),伸入瓶口中并塞上瓶塞。发生反应的化学方程式为___________________________________________
________________________________________________________________________,
产物的颜色是________;待反应完全并冷却后,打开弹簧夹,则广口瓶内水面上升的水的体积约占瓶内空气体积的________(假设装置的气密性良好且操作正确)。
14.钠是一种非常活泼的金属,观察法和实验法是研究物质性质的基本方法。
(1)该小组同学将金属钠投入CuSO4溶液中,得到蓝色絮状沉淀,写出反应的化学方程式:
________________________________________________________________________。
(2)实验小组研究Na与CO2的反应,装置、步骤和现象如下:
实验步骤和现象:
ⅰ.通入CO2至澄清石灰水变浑浊后,点燃酒精灯。
ⅱ.一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
ⅲ.将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
①步骤ⅰ的目的是________________________________________________________________________
________________________________________________________________________;
②从氧化还原反应的角度,分析步骤ⅱ管壁上生成的黑色物质的成分________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
③写出硬质玻璃管内可能发生的反应方程式:
________________________________________________________________________
________________________________________________________________________。
课时作业7 活泼的金属单质——钠
1.答案:C
2.答案:D
3.解析:钠不能从盐溶液中置换出金属。
答案:D
4.解析:A中,钠的硬度小,可用小刀切割;B中,放置在空气中,钠被缓慢氧化生成白色Na2O;D中,钠着火时不能用水灭火,因为钠与水剧烈反应,产生H2易燃易爆。
答案:C
5.解析:钠在氧气中加热反应产物为过氧化钠、在常温下与空气中氧气反应,产物是氧化钠,反应中钠元素均从0价升高到+1价,则等质量的钠失去的电子数相同,故A错误、B正确;等质量的钠产生的过氧化钠的质量大于氧化钠的质量,故C、D错误。
答案:B
6.解析:该反应中除Na与H2O反应现象A、D外,还会产生Ca(OH)2沉淀,B项所述现象也会出现。
答案:C
7.解析:若2.3 g钠全部生成Na2O,质量为3.1 g;若2.3 g钠全部生成Na2O2,质量为3.9 g,因为3.1 g<3.5 g<3.9 g,故氧化产物应为Na2O和Na2O2的混合物。
答案:C
8.解析:B中钠与CuSO4溶液反应的实质是钠与水反应生成的氢氧化钠再与CuSO4反应,总化学方程式:2Na+2H2O+CuSO4===Cu(OH)2↓+H2↑+Na2SO4。
答案:B
9.解析:钠与水溶液反应均放出氢气;A项,发生反应为2Na+2HCl===2NaCl+H2↑,只有气体无沉淀;B项,NaOH溶液是饱和溶液,投入钠后,消耗水,析出氢氧化钠晶体;C项,钠与水反应生成的氢氧化钠还能进一步与FeCl3反应产生氢氧化铁沉淀;D项,钠与水反应生成的氢氧化钠还能进一步与CuSO4反应产生氢氧化铜沉淀。
答案:A
10.解析:金属钠投入溶液中,由于Na变为离子形式溶于溶液,会使溶液质量增加;但是钠与水、与酸(H+)反应放出H2,都使溶液质量减轻;且钠与水反应生成的碱还有可能和盐的离子生成难溶的碱导致溶液质量减轻,溶液质量是否减轻,就要看这一增一减的净结果。A中2Na+2HCl===2NaCl+H2↑,H+换成Na+,溶液质量增加;B中Na与水反应,H2O中H+换成Na+,溶液质量增加;C中6Na+6H2O+2FeCl3===2Fe(OH)3↓+6NaCl+3H2↑,显然溶液质量减轻;D中2Na+2H2O===2NaOH+H2↑,溶液质量增加。
答案:C
11.解析:溶液的质量等于金属和水或酸的质量之和减去放出H2的质量。
2Na+2H2O===2NaOH+H2↑
46 2
4.6 g 0.2 g
a g=4.6 g+m(H2O)-0.2=4.4 g+m(H2O)
Mg+2HCl===MgCl2+H2↑
24 2
4.8 g 0.4 g
b g=4.8 g+m(HCl)-0.4 g=4.4 g+m(HCl)
因为m(H2O)=m(HCl),所以a=b。
答案:A
12.解析:(1)根据C为淡黄色固体,推知C为Na2O2,则B为Na2O,A为Na,A→C的反应为2Na+O2Na2O2。(2)根据C是最主要的温室气体,推知C为CO2,则A为C,B为CO,A与C能反应,化学方程式为C+CO22CO。
答案:(1)Na2O 2Na+O2Na2O2
(2)CO2 2CO+O22CO2 能 C+CO22CO
13.解析:钠与氧气在点燃条件下生成淡黄色的过氧化钠,反应的化学方程式为2Na+O2Na2O2。因钠足量,钠燃烧耗尽广口瓶中空气中的氧气而使瓶内压强减小,进入广口瓶中的水的体积为瓶内空气中氧气的体积,即。
答案:(1)银白 金属光泽 暗 钠在空气中被氧化为氧化钠 (2)2Na+O2Na2O2 淡黄色
14.解析:(1)将金属钠投入CuSO4溶液中,钠先与水反应生成NaOH和氢气,NaOH再与CuSO4反应生成Cu(OH)2蓝色絮状沉淀,反应的化学方程式为CuSO4+2Na+2H2O===Cu(OH)2↓+Na2SO4+H2↑。(2)①因钠容易和空气中的氧气、水等反应,所以步骤ⅰ中通入CO2至澄清石灰水变浑浊后,再点燃酒精灯的目的是排除实验过程中氧气、水等的干扰;②根据氧化还原反应的原理,金属钠在反应中做还原剂,CO2做氧化剂,其还原产物是黑色固体物质且没有检测到CO,可确定黑色物质是碳;③硬质玻璃管中的固体溶于水无气泡产生,说明钠全部参加了反应,在滤液中加入过量的BaCl2溶液,产生白色沉淀,取白色沉淀加入盐酸,产生气体,说明硬质玻璃管中的固体含有Na2CO3,再次过滤后滤液呈碱性,说明硬质玻璃管中的固体含有Na2O,综上可确定硬质玻璃管中发生的反应可能为4Na+CO22Na2O+C、Na2O+CO2===Na2CO3。
答案:(1)CuSO4+2Na+2H2O===Cu(OH)2↓+Na2SO4+H2↑
(2)①排除氧气、水等的干扰 ②金属钠在反应中做还原剂,CO2做氧化剂,其还原产物是黑色固体物质且没有检测到CO,可确定黑色物质是碳 ③4Na+CO22Na2O+C、Na2O+CO2===Na2CO3
