2024-2025学年高中化学人教版必修第一册 2.2.2氯气的实验室制法 氯离子的检验 作业(含解析)
文档属性
| 名称 | 2024-2025学年高中化学人教版必修第一册 2.2.2氯气的实验室制法 氯离子的检验 作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 277.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 14:49:00 | ||
图片预览


文档简介
课时作业11 氯气的实验室制法 氯离子的检验
基础性训练
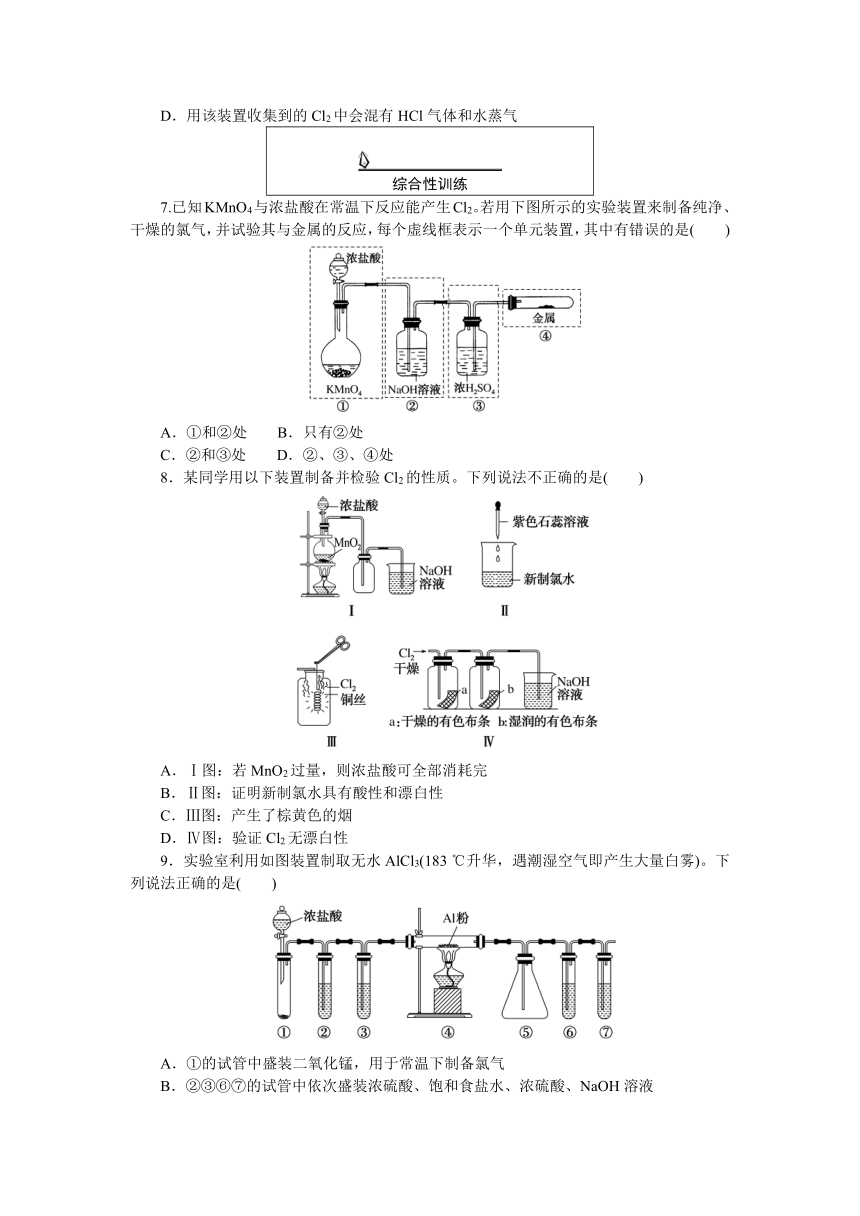
1.实验室制取氯气后,产生的尾气选用下列哪种方法处理最好( )
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
3.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸检验
B.用干燥有色布条检验
C.将气体通入硝酸银溶液检验
D.用湿润的淀粉 KI试纸检验
4.[2023·重庆云阳中学高一检测]下列关于实验室用二氧化锰和浓盐酸制取氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.HCl表现还原性和酸性
C.该反应的离子方程式为
MnO2+4H++4Cl-MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
5.[2023·三亚一中高一检测]实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,下图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸到试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
综合性训练
7.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验其与金属的反应,每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②、③、④处
8.某同学用以下装置制备并检验Cl2的性质。下列说法不正确的是( )
A.Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的烟
D.Ⅳ图:验证Cl2无漂白性
9.实验室利用如图装置制取无水AlCl3(183 ℃升华,遇潮湿空气即产生大量白雾)。下列说法正确的是( )
A.①的试管中盛装二氧化锰,用于常温下制备氯气
B.②③⑥⑦的试管中依次盛装浓硫酸、饱和食盐水、浓硫酸、NaOH溶液
C.滴加浓盐酸的同时点燃④的酒精灯
D.⑤用于收集AlCl3,⑥⑦可以用一个装有碱石灰的干燥管代替
10.某溶液中可能含有K+、Na+、CO、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:
序号 实验操作及现象
步骤① 取原溶液,进行焰色试验,显黄色,透过蓝色钴玻璃观察无紫色
步骤② 取原溶液,向溶液中加入盐酸,有气体产生
请回答下列问题:
(1)原溶液中一定存在的离子是__________(填离子符号,下同),一定不存在的离子是____________,可能存在的离子是________。
(2)为进一步确定原溶液中可能存在的离子是否存在,应进行的实验操作及判断依据是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
11.用如图所示装置可以完成一系列实验(图中夹持装置已略去)。
用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的三处棉花依次做了如下处理:①包有某固体物质,②蘸有KI溶液,③蘸有石蕊溶液。请回答下列问题:
(1)仪器P的名称是________。
(2)①处包有的某固体物质可能是(填字母)________。
a.MnO2 b.KMnO4
c.KCl d.Cu
反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:________________________。
(3)在实验过程中,在③处能观察到________________________________________________________________________
________________________________________________________________________。
(4)甲同学为了验证剩余气体的主要成分,在C中设计了如图装置,D中装有铜丝网,装置E的试管中不加任何试剂,装置F的烧杯中加入适量的AgNO3溶液。
①实验过程中,装置D的作用是________________________________________________________________________
________________________________________________________________________;
②装置F中的现象是________________________________________________________________________
________________________________________________________________________;
写出反应的离子方程式:________________________________________________________________________。
12.2022年北京冬奥会期间,常用的消毒剂有医用酒精和“84”消毒液等,使用酒精进行环境消毒时要避免明火。使用“84”消毒液时要避免与洁厕剂混用,两者混用会产生氯气,引起中毒。
某化学兴趣小组尝试利用“84”消毒液与硫酸溶液反应制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)在该实验中,制取氯气的装置是________(填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是________________________________________________________________________
________________________________________________________________________,
请提出合理的改进方法:________________________________________________________________________
________________________________________________________________________。
(3)写出氯气与NaOH溶液反应的离子方程式:
________________________________________________________________________。
为验证尾气吸收后的溶液中存在Cl-,正确的操作是________________________________________________________________________
________________________________________________________________________
________________________。
(4)Cl2通入饱和NaHCO3溶液产生无色气体,已知酸性HCl>H2CO3>HClO,该实验证明Cl2与H2O反应的产物中含有________。
课时作业11 氯气的实验室制法 氯离子的检验
1.答案:D
2.答案:C
3.解析:HClO具有漂白性,而Cl2不具有,在干燥环境下,Cl2不能转变为HClO,因而无漂白性,无法与HCl气体区分。气体通入AgNO3溶液都产生白色沉淀,因为Cl2与H2O反应也产生Cl-。Cl2与KI反应产生I2,淀粉遇I2变蓝,可以与HCl区分。
答案:D
4.解析:由MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑可知,二氧化锰是氧化剂,HCl中氯元素部分化合价升高,HCl既表现还原性,又表现酸性;氯化锰是可溶于水的强电解质,在离子方程式中应写成离子形式。
答案:C
5.解析:由化学方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O知:146 g HCl与87 g MnO2恰好反应生成71 g Cl2,但由于稀盐酸不与MnO2反应,所以①产生的Cl2小于71 g,而②能生成71 g Cl2。
答案:B
6.解析:根据导管的进出长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入①中,NaOH溶液吸收多余的Cl2,防止污染环境,①中收集到的Cl2不纯,混有HCl和水蒸气。
答案:A
7.解析:①是制备氯气的装置,②是除去氯气中氯化氢杂质的装置,③是干燥装置,④是用于氯气与金属反应的装置。除杂时不能消耗欲保留的气体,因为氯气可与NaOH溶液反应,化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O,所以②处错误;③中进气管短,出气管却插入液面下,所以无法干燥气体,也不能使气体进入④中与金属反应,所以③处错误;④是一个封闭体系,未反应的气体不断蓄积会使容器内压强过大而发生爆炸,所以④处错误。
答案:D
8.解析:二氧化锰与浓盐酸反应,随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完,A错误;图Ⅱ中溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,B正确;铜丝在氯气中燃烧,生成了棕黄色的烟,C正确;氯气没有漂白性,不能使干燥有色布条褪色,图Ⅳ中氯气遇到湿润有色布条与水反应生成HClO,HClO具有漂白性,可使有色布条褪色,D正确。
答案:A
9.答案:D
10.解析:(1)根据焰色试验显黄色、透过蓝色钴玻璃无紫色,说明含有Na+、无K+;加入盐酸有气体产生,说明存在CO,但不能确定是否有Cl-;则原溶液中一定存在Na+和CO,一定不存在K+,可能存在的是Cl-。(2)要检验是否存在Cl-选用AgNO3溶液和稀HNO3,所进行的操作和判断的依据为取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-。
答案:(1)Na+和CO K+ Cl- (2)取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-
11.解析:(1)仪器P的名称为分液漏斗。
(2)②处有棕黄色物质产生,说明有单质I2生成,说明HCl经过①处后被氧化生成Cl2,①处包有的固体物质可能是KMnO4,②处反应的离子方程式为Cl2+2I-===I2+2Cl-。
(3)Cl2通过蘸有石蕊溶液的棉花时,会使石蕊溶液先变红后褪色。
(4)甲同学实验的原理如下:用铜丝网证明剩余气体中含有Cl2(若铜网颜色变化,可以证明含有Cl2);根据Cl2易液化的性质用冰水将Cl2冷凝从而除去;再根据剩余气体与硝酸银溶液的反应情况验证是否存在HCl气体。
答案:(1)分液漏斗
(2)b Cl2+2I-===I2+2Cl-
(3)先变红后褪色
(4)①验证HCl气体中含有Cl2(或验证HCl气体中含有Cl2和除去HCl气体中的Cl2)
②有白色沉淀产生 Ag++Cl-===AgCl↓
12.解析:(1)根据题干中制备氯气的化学方程式可知,液体与液体在加热条件下制取气体,应选择c装置制取Cl2。(2)B中干燥的红色布条褪色证明Cl2中混有H2O(g),生成了HClO,所以应增加除去H2O(g)的装置。(3)Cl2与NaOH溶液反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;检验Cl-,应先用稀硝酸酸化吸收液,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-。(4)因酸性HCl>H2CO3>HClO,HCl与NaHCO3反应:HCl+NaHCO3===NaCl+H2O+CO2↑,而HClO不与NaHCO3反应,故题述实验能证明Cl2与H2O反应的产物中含有HCl。
答案:(1)c (2)Cl2中混有少量H2O(g) 在A~B之间增加装有浓硫酸的洗气瓶 (3)Cl2+2OH-===Cl-+ClO-+H2O 取少量烧杯内吸收Cl2后的溶液,加入足量的稀硝酸酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl- (4)HCl
基础性训练
1.实验室制取氯气后,产生的尾气选用下列哪种方法处理最好( )
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
3.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸检验
B.用干燥有色布条检验
C.将气体通入硝酸银溶液检验
D.用湿润的淀粉 KI试纸检验
4.[2023·重庆云阳中学高一检测]下列关于实验室用二氧化锰和浓盐酸制取氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.HCl表现还原性和酸性
C.该反应的离子方程式为
MnO2+4H++4Cl-MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
5.[2023·三亚一中高一检测]实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,下图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸到试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
综合性训练
7.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验其与金属的反应,每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②、③、④处
8.某同学用以下装置制备并检验Cl2的性质。下列说法不正确的是( )
A.Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的烟
D.Ⅳ图:验证Cl2无漂白性
9.实验室利用如图装置制取无水AlCl3(183 ℃升华,遇潮湿空气即产生大量白雾)。下列说法正确的是( )
A.①的试管中盛装二氧化锰,用于常温下制备氯气
B.②③⑥⑦的试管中依次盛装浓硫酸、饱和食盐水、浓硫酸、NaOH溶液
C.滴加浓盐酸的同时点燃④的酒精灯
D.⑤用于收集AlCl3,⑥⑦可以用一个装有碱石灰的干燥管代替
10.某溶液中可能含有K+、Na+、CO、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:
序号 实验操作及现象
步骤① 取原溶液,进行焰色试验,显黄色,透过蓝色钴玻璃观察无紫色
步骤② 取原溶液,向溶液中加入盐酸,有气体产生
请回答下列问题:
(1)原溶液中一定存在的离子是__________(填离子符号,下同),一定不存在的离子是____________,可能存在的离子是________。
(2)为进一步确定原溶液中可能存在的离子是否存在,应进行的实验操作及判断依据是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
11.用如图所示装置可以完成一系列实验(图中夹持装置已略去)。
用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的三处棉花依次做了如下处理:①包有某固体物质,②蘸有KI溶液,③蘸有石蕊溶液。请回答下列问题:
(1)仪器P的名称是________。
(2)①处包有的某固体物质可能是(填字母)________。
a.MnO2 b.KMnO4
c.KCl d.Cu
反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:________________________。
(3)在实验过程中,在③处能观察到________________________________________________________________________
________________________________________________________________________。
(4)甲同学为了验证剩余气体的主要成分,在C中设计了如图装置,D中装有铜丝网,装置E的试管中不加任何试剂,装置F的烧杯中加入适量的AgNO3溶液。
①实验过程中,装置D的作用是________________________________________________________________________
________________________________________________________________________;
②装置F中的现象是________________________________________________________________________
________________________________________________________________________;
写出反应的离子方程式:________________________________________________________________________。
12.2022年北京冬奥会期间,常用的消毒剂有医用酒精和“84”消毒液等,使用酒精进行环境消毒时要避免明火。使用“84”消毒液时要避免与洁厕剂混用,两者混用会产生氯气,引起中毒。
某化学兴趣小组尝试利用“84”消毒液与硫酸溶液反应制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)在该实验中,制取氯气的装置是________(填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是________________________________________________________________________
________________________________________________________________________,
请提出合理的改进方法:________________________________________________________________________
________________________________________________________________________。
(3)写出氯气与NaOH溶液反应的离子方程式:
________________________________________________________________________。
为验证尾气吸收后的溶液中存在Cl-,正确的操作是________________________________________________________________________
________________________________________________________________________
________________________。
(4)Cl2通入饱和NaHCO3溶液产生无色气体,已知酸性HCl>H2CO3>HClO,该实验证明Cl2与H2O反应的产物中含有________。
课时作业11 氯气的实验室制法 氯离子的检验
1.答案:D
2.答案:C
3.解析:HClO具有漂白性,而Cl2不具有,在干燥环境下,Cl2不能转变为HClO,因而无漂白性,无法与HCl气体区分。气体通入AgNO3溶液都产生白色沉淀,因为Cl2与H2O反应也产生Cl-。Cl2与KI反应产生I2,淀粉遇I2变蓝,可以与HCl区分。
答案:D
4.解析:由MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑可知,二氧化锰是氧化剂,HCl中氯元素部分化合价升高,HCl既表现还原性,又表现酸性;氯化锰是可溶于水的强电解质,在离子方程式中应写成离子形式。
答案:C
5.解析:由化学方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O知:146 g HCl与87 g MnO2恰好反应生成71 g Cl2,但由于稀盐酸不与MnO2反应,所以①产生的Cl2小于71 g,而②能生成71 g Cl2。
答案:B
6.解析:根据导管的进出长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入①中,NaOH溶液吸收多余的Cl2,防止污染环境,①中收集到的Cl2不纯,混有HCl和水蒸气。
答案:A
7.解析:①是制备氯气的装置,②是除去氯气中氯化氢杂质的装置,③是干燥装置,④是用于氯气与金属反应的装置。除杂时不能消耗欲保留的气体,因为氯气可与NaOH溶液反应,化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O,所以②处错误;③中进气管短,出气管却插入液面下,所以无法干燥气体,也不能使气体进入④中与金属反应,所以③处错误;④是一个封闭体系,未反应的气体不断蓄积会使容器内压强过大而发生爆炸,所以④处错误。
答案:D
8.解析:二氧化锰与浓盐酸反应,随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完,A错误;图Ⅱ中溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,B正确;铜丝在氯气中燃烧,生成了棕黄色的烟,C正确;氯气没有漂白性,不能使干燥有色布条褪色,图Ⅳ中氯气遇到湿润有色布条与水反应生成HClO,HClO具有漂白性,可使有色布条褪色,D正确。
答案:A
9.答案:D
10.解析:(1)根据焰色试验显黄色、透过蓝色钴玻璃无紫色,说明含有Na+、无K+;加入盐酸有气体产生,说明存在CO,但不能确定是否有Cl-;则原溶液中一定存在Na+和CO,一定不存在K+,可能存在的是Cl-。(2)要检验是否存在Cl-选用AgNO3溶液和稀HNO3,所进行的操作和判断的依据为取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-。
答案:(1)Na+和CO K+ Cl- (2)取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-
11.解析:(1)仪器P的名称为分液漏斗。
(2)②处有棕黄色物质产生,说明有单质I2生成,说明HCl经过①处后被氧化生成Cl2,①处包有的固体物质可能是KMnO4,②处反应的离子方程式为Cl2+2I-===I2+2Cl-。
(3)Cl2通过蘸有石蕊溶液的棉花时,会使石蕊溶液先变红后褪色。
(4)甲同学实验的原理如下:用铜丝网证明剩余气体中含有Cl2(若铜网颜色变化,可以证明含有Cl2);根据Cl2易液化的性质用冰水将Cl2冷凝从而除去;再根据剩余气体与硝酸银溶液的反应情况验证是否存在HCl气体。
答案:(1)分液漏斗
(2)b Cl2+2I-===I2+2Cl-
(3)先变红后褪色
(4)①验证HCl气体中含有Cl2(或验证HCl气体中含有Cl2和除去HCl气体中的Cl2)
②有白色沉淀产生 Ag++Cl-===AgCl↓
12.解析:(1)根据题干中制备氯气的化学方程式可知,液体与液体在加热条件下制取气体,应选择c装置制取Cl2。(2)B中干燥的红色布条褪色证明Cl2中混有H2O(g),生成了HClO,所以应增加除去H2O(g)的装置。(3)Cl2与NaOH溶液反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;检验Cl-,应先用稀硝酸酸化吸收液,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-。(4)因酸性HCl>H2CO3>HClO,HCl与NaHCO3反应:HCl+NaHCO3===NaCl+H2O+CO2↑,而HClO不与NaHCO3反应,故题述实验能证明Cl2与H2O反应的产物中含有HCl。
答案:(1)c (2)Cl2中混有少量H2O(g) 在A~B之间增加装有浓硫酸的洗气瓶 (3)Cl2+2OH-===Cl-+ClO-+H2O 取少量烧杯内吸收Cl2后的溶液,加入足量的稀硝酸酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl- (4)HCl
