2024-2025学年高中化学人教版必修第一册 第二章 海水中的重要元素——钠和氯 重难题型突破练(含答案)
文档属性
| 名称 | 2024-2025学年高中化学人教版必修第一册 第二章 海水中的重要元素——钠和氯 重难题型突破练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 200.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-06 15:16:37 | ||
图片预览


文档简介
重难题型突破练二
题型一 与钠的化合物有关的图像题
1.将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴滴加稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
2.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图所示(忽略CO2的溶解和HCl的挥发):
则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1
③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1
④Ⅳ图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
题型二 与钠的化合物有关的实验题
3.下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是( )
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
4.
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
题型三 与Cl2的制法有关的实验题
5.含氯消毒剂在新冠肺炎疫情防控中发挥了巨大作用。实验室中利用下图装置模拟制备“84”消毒液(有效成分为NaClO,由氯气和NaOH溶液反应制得),下列说法正确的是( )
A.盛放浓盐酸的仪器是长颈漏斗
B.为除去Cl2中的HCl,装置a中的试剂为饱和NaCl溶液
C.装置c中的试剂为澄清石灰水,其作用是吸收尾气
D.实验装置中缺少氯气的干燥装置
6.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是____________,a中的试剂为________。
(2)b中采用的加热方式是________。c中化学反应的离子方程式是______________________,采用冰水浴冷却的目的是________________________________________________________________________
________________________________________________________________________。
(3)d的作用是________________,可选用试剂________(填标号)。
A.Na2S B.NaCl
C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力________NaClO(填“大于”或“小于”)。
题型四 有关NA的判断题
7.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH所含的质子数和电子数都为10NA
B.NA个微粒就是6.02×1023个微粒
C.0.1 mol硫酸中含有的原子总数为0.7NA
D.1 mol CO所含电子数是28NA
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6NA个Na+
C.14 g氮气中含NA个氮原子
D.18 g水中所含的电子数为8NA
题型五 配制一定物质的量浓度溶液的实验题
9.下列a~e是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.托盘天平 d.温度计
e.分液漏斗
(1)标出使用温度的仪器是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________g。
(4)在某次实验中,要用500 mL 0.52 mol·L-1的NaOH溶液,配制此浓度NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、________和________。
(5)下列操作使所配溶液物质的量浓度偏大的有________(填写字母)。
A.称量时用了生锈的砝码
B.将NaOH放在托盘天平的右盘上称量(使用游码)
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.定容时俯视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(6)实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸。
请回答下列问题:
①浓盐酸的物质的量浓度为________。
②配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积________ mL,应选用容量瓶的规格是________ mL。
10.某实验小组拟配制0.1 mol·L-1的NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下表中选择称量NaOH固体所需要的仪器:________(填序号)。
名称 托盘天平 (带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
(3)下列情况会使所配溶液浓度偏低的是________(填序号)。
①称量NaOH固体读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并接着进行后续操作
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
重难题型突破练二
1.解析:向NaOH和Na2CO3混合溶液中滴加盐酸时,盐酸首先和NaOH反应生成水和氯化钠,当滴加到第一个格时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生反应:HCl+Na2CO3===NaHCO3+NaCl,不放出气体,当再加到第二格时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl===NaCl+H2O+CO2↑,此时开始放出气体,正好与选项C图像相符,故C正确。
答案:C
2.解析:图像Ⅰ中从O点即开始产生CO2气体,对应溶液中的溶质为NaHCO3,①正确;图像Ⅱ中Oa段消耗HCl的量小于ab段消耗HCl的量,对应的溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比==,②正确;图像Ⅲ中,Oa段消耗HCl的量等于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3,③不正确;图像Ⅳ中,Oa段消耗HCl的量大于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3、NaOH,且二者的物质的量之比==,④不正确。
答案:A
3.解析:用酒精灯加热时,外管温度高,内管温度低,NaHCO3受热易分解,Na2CO3受热不易分解,故将Na2CO3放在外管中,温度高却未分解,NaHCO3放在内管中,温度低却分解,证明Na2CO3热稳定性强于NaHCO3,NaHCO3受热分解产生CO2,可使澄清石灰水变浑浊。甲为小苏打(NaHCO3),乙为纯碱(Na2CO3),故A项正确,B项错误;NaHCO3分解产生的水可以使无水硫酸铜变蓝色,故C项正确;Na2CO3不会分解产生CO2,故不能使丙中澄清石灰水变浑浊,故D项正确。
答案:B
4.解析:由于CO2在水中的溶解度比较小,而NH3极易溶于水,所以在实验中要先通入溶解度较大的NH3,再通入CO2;由于NH3极易溶于水,在溶于水时极易发生倒吸现象,所以通入NH3的导气管的末端不能伸入到溶液中,即a先通入NH3,然后b通入CO2,A、B、D选项均错误;因为NH3是碱性气体,所以过量的NH3要用稀硫酸来吸收,选项C合理。
答案:C
5.解析:制备Cl2装置中盛放浓盐酸的仪器是分液漏斗,相对于长颈漏斗,更便于控制滴加速度、随用随停,A项错误;装置a中的试剂为饱和NaCl溶液,除去Cl2中的HCl,B项正确;装置c中用NaOH溶液吸收尾气,C项错误;实验过程是将生成的氯气通入NaOH溶液中反应,因此无需干燥装置,D项错误。
答案:B
6.解析:(1)实验室常用MnO2与浓盐酸在加热条件下制取Cl2,由于制得的Cl2中混有HCl,HCl会消耗b中试管内的KOH,所以应使用饱和食盐水除去HCl。(2)用酒精灯加热烧杯中的水从而对试管中的反应体系进行加热,这样的加热方式为水浴加热。Cl2和NaOH在不加热条件下反应生成NaCl和NaClO,离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。Cl2与NaOH反应放热,由题意可知,温度较高时Cl2与KOH反应生成KClO3,所以不使用冰水浴会使得溶液温度升高而生成NaClO3杂质。(3)Cl2是有毒气体,所以必须进行尾气处理,防止污染空气。Cl2可以与Na2S反应,化学方程式为Cl2+Na2S===2NaCl+S↓;Cl2可以与Ca(OH)2反应,化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。Cl2在食盐水和H2SO4溶液中溶解度较小,所以可用Na2S溶液和Ca(OH)2溶液来进行尾气处理,A、C符合题意。(4)从溶液中获得溶质的常见方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(5)2号试管中溶液变为棕色,说明有I2生成,则加入CCl4振荡,静置后CCl4层呈紫色,故2号试管中I-被氧化,而1号试管中I-未被氧化,所以该条件下氧化性:KClO3答案:(1)圆底烧瓶 饱和食盐水
(2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成NaClO3
(3)吸收尾气(Cl2) AC
(4)过滤 少量(冷)水洗涤
(5)紫 小于
7.答案:C
8.答案:C
9.解析:(1)标出使用温度的仪器是量筒、容量瓶和温度计,液体体积受温度的影响,量取液体体积需在标明的温度下进行;配制溶液时需指明温度,温度改变会影响浓度;温度计是测量物质的温度的仪器,须标明温度的量程和刻度值。(2)使用前需要检查是否漏水的是容量瓶、分液漏斗,它们都是需密封使用的容器,所以需要检查是否漏水。(3)称取10.5 g固体样品,则砝码为10 g,游码为0.5 g,天平的设计是左盘的物质质量等于右盘砝码质量加游码的质量,如放反,则物品的质量等于砝码减游码的质量,则物品的质量为10 g-0.5 g=9.5 g。(4)配制500 mL 0.52 mol·L-1的NaOH溶液,需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、500 mL容量瓶和胶头滴管。(5)A.砝码生锈后质量偏大,导致所取溶质物质的量偏高,溶液的浓度偏大,A符合题意。B.将NaOH放在托盘天平的右盘上称量(使用游码);导致所取溶质物质的量偏低,溶液的浓度偏小,B不符合题意。C.待溶液冷却至室温后体积减小,则溶液的浓度偏大,C符合题意。D.往容量瓶转移时,有少量液体溅出,导致溶质的物质的量偏低,溶液的浓度偏小,D不符合题意。E.定容时俯视容量瓶刻度线,导致溶液总体积偏小,溶液的浓度偏大,E符合题意。F.容量瓶内残留一定量蒸馏水,不影响溶液配制,溶液的浓度不变,故F不符合题意。G.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液总体积偏大,溶液的浓度偏小,G不符合题意。(6)c(HCl)== mol·L-1=12.5 mol·L-1。配制240 mL 0.1 mol·L-1的盐酸应选用250 mL容量瓶,量取浓盐酸的浓度为12.5 mol·L-1,设需要12.5 mol·L-1的盐酸的体积为V L,则根据溶液稀释公式可得,0.25 L×0.1 mol·L-1=12.5 mol·L-1×V L,需该浓度盐酸体积V= L=0.002 L。
答案:(1)abd (2)be (3)9.5 (4)500 mL容量瓶 胶头滴管 (5)ACE (6)①12.5 mol·L-1 ②2 250
10.解析:(1)配制的溶液体积应为500 mL,所需NaOH固体的质量为0.10 mol·L-1×0.5×40 g·mol-1=2.0 g。(2)NaOH需放在烧杯中称量,称量NaOH要用到托盘天平、烧杯和药匙。(3)①砝码质量大于NaOH质量,实际NaOH质量小于计算质量,所配溶液浓度偏低。②砝码质量偏大,所称NaOH质量也偏大,所配溶液浓度偏高。③未洗涤烧杯和玻璃棒会导致溶质减少,所配溶液浓度偏低。④容量瓶未干燥不影响所配溶液浓度。⑤溶液液面高于刻度线,溶液浓度偏低。⑥未冷却,定容后溶液液面低于刻度线,溶液浓度偏高。⑦摇匀后溶液液面低于刻度线是由于部分溶液沾到了容量瓶上壁和瓶口处,再加水,溶液浓度偏低。
答案:(1)2.0 (2)abe (3)①③⑤⑦
题型一 与钠的化合物有关的图像题
1.将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴滴加稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
2.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图所示(忽略CO2的溶解和HCl的挥发):
则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1
③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1
④Ⅳ图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
题型二 与钠的化合物有关的实验题
3.下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是( )
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
4.
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
题型三 与Cl2的制法有关的实验题
5.含氯消毒剂在新冠肺炎疫情防控中发挥了巨大作用。实验室中利用下图装置模拟制备“84”消毒液(有效成分为NaClO,由氯气和NaOH溶液反应制得),下列说法正确的是( )
A.盛放浓盐酸的仪器是长颈漏斗
B.为除去Cl2中的HCl,装置a中的试剂为饱和NaCl溶液
C.装置c中的试剂为澄清石灰水,其作用是吸收尾气
D.实验装置中缺少氯气的干燥装置
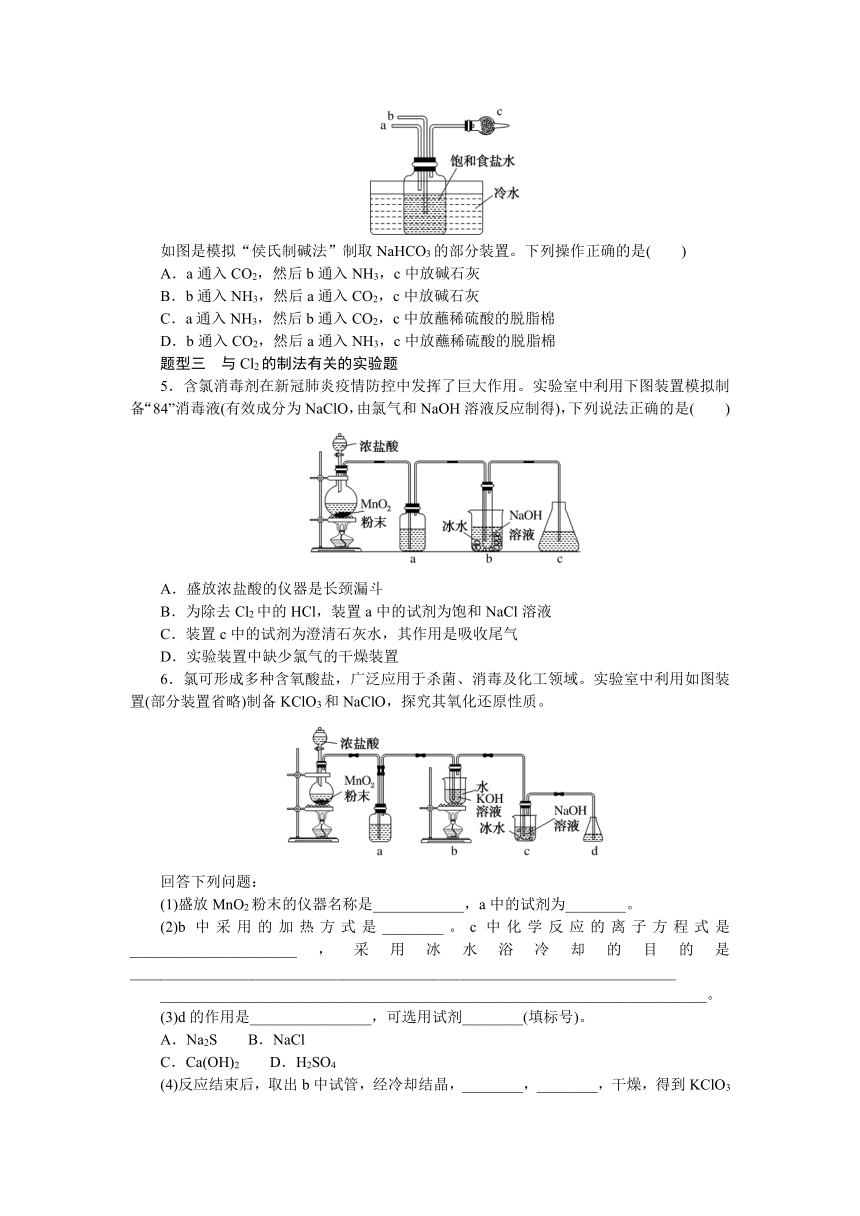
6.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是____________,a中的试剂为________。
(2)b中采用的加热方式是________。c中化学反应的离子方程式是______________________,采用冰水浴冷却的目的是________________________________________________________________________
________________________________________________________________________。
(3)d的作用是________________,可选用试剂________(填标号)。
A.Na2S B.NaCl
C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力________NaClO(填“大于”或“小于”)。
题型四 有关NA的判断题
7.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH所含的质子数和电子数都为10NA
B.NA个微粒就是6.02×1023个微粒
C.0.1 mol硫酸中含有的原子总数为0.7NA
D.1 mol CO所含电子数是28NA
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6NA个Na+
C.14 g氮气中含NA个氮原子
D.18 g水中所含的电子数为8NA
题型五 配制一定物质的量浓度溶液的实验题
9.下列a~e是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.托盘天平 d.温度计
e.分液漏斗
(1)标出使用温度的仪器是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________g。
(4)在某次实验中,要用500 mL 0.52 mol·L-1的NaOH溶液,配制此浓度NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、________和________。
(5)下列操作使所配溶液物质的量浓度偏大的有________(填写字母)。
A.称量时用了生锈的砝码
B.将NaOH放在托盘天平的右盘上称量(使用游码)
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.定容时俯视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(6)实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸。
请回答下列问题:
①浓盐酸的物质的量浓度为________。
②配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积________ mL,应选用容量瓶的规格是________ mL。
10.某实验小组拟配制0.1 mol·L-1的NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下表中选择称量NaOH固体所需要的仪器:________(填序号)。
名称 托盘天平 (带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
(3)下列情况会使所配溶液浓度偏低的是________(填序号)。
①称量NaOH固体读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中并接着进行后续操作
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
重难题型突破练二
1.解析:向NaOH和Na2CO3混合溶液中滴加盐酸时,盐酸首先和NaOH反应生成水和氯化钠,当滴加到第一个格时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生反应:HCl+Na2CO3===NaHCO3+NaCl,不放出气体,当再加到第二格时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl===NaCl+H2O+CO2↑,此时开始放出气体,正好与选项C图像相符,故C正确。
答案:C
2.解析:图像Ⅰ中从O点即开始产生CO2气体,对应溶液中的溶质为NaHCO3,①正确;图像Ⅱ中Oa段消耗HCl的量小于ab段消耗HCl的量,对应的溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比==,②正确;图像Ⅲ中,Oa段消耗HCl的量等于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3,③不正确;图像Ⅳ中,Oa段消耗HCl的量大于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3、NaOH,且二者的物质的量之比==,④不正确。
答案:A
3.解析:用酒精灯加热时,外管温度高,内管温度低,NaHCO3受热易分解,Na2CO3受热不易分解,故将Na2CO3放在外管中,温度高却未分解,NaHCO3放在内管中,温度低却分解,证明Na2CO3热稳定性强于NaHCO3,NaHCO3受热分解产生CO2,可使澄清石灰水变浑浊。甲为小苏打(NaHCO3),乙为纯碱(Na2CO3),故A项正确,B项错误;NaHCO3分解产生的水可以使无水硫酸铜变蓝色,故C项正确;Na2CO3不会分解产生CO2,故不能使丙中澄清石灰水变浑浊,故D项正确。
答案:B
4.解析:由于CO2在水中的溶解度比较小,而NH3极易溶于水,所以在实验中要先通入溶解度较大的NH3,再通入CO2;由于NH3极易溶于水,在溶于水时极易发生倒吸现象,所以通入NH3的导气管的末端不能伸入到溶液中,即a先通入NH3,然后b通入CO2,A、B、D选项均错误;因为NH3是碱性气体,所以过量的NH3要用稀硫酸来吸收,选项C合理。
答案:C
5.解析:制备Cl2装置中盛放浓盐酸的仪器是分液漏斗,相对于长颈漏斗,更便于控制滴加速度、随用随停,A项错误;装置a中的试剂为饱和NaCl溶液,除去Cl2中的HCl,B项正确;装置c中用NaOH溶液吸收尾气,C项错误;实验过程是将生成的氯气通入NaOH溶液中反应,因此无需干燥装置,D项错误。
答案:B
6.解析:(1)实验室常用MnO2与浓盐酸在加热条件下制取Cl2,由于制得的Cl2中混有HCl,HCl会消耗b中试管内的KOH,所以应使用饱和食盐水除去HCl。(2)用酒精灯加热烧杯中的水从而对试管中的反应体系进行加热,这样的加热方式为水浴加热。Cl2和NaOH在不加热条件下反应生成NaCl和NaClO,离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。Cl2与NaOH反应放热,由题意可知,温度较高时Cl2与KOH反应生成KClO3,所以不使用冰水浴会使得溶液温度升高而生成NaClO3杂质。(3)Cl2是有毒气体,所以必须进行尾气处理,防止污染空气。Cl2可以与Na2S反应,化学方程式为Cl2+Na2S===2NaCl+S↓;Cl2可以与Ca(OH)2反应,化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。Cl2在食盐水和H2SO4溶液中溶解度较小,所以可用Na2S溶液和Ca(OH)2溶液来进行尾气处理,A、C符合题意。(4)从溶液中获得溶质的常见方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(5)2号试管中溶液变为棕色,说明有I2生成,则加入CCl4振荡,静置后CCl4层呈紫色,故2号试管中I-被氧化,而1号试管中I-未被氧化,所以该条件下氧化性:KClO3
(2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成NaClO3
(3)吸收尾气(Cl2) AC
(4)过滤 少量(冷)水洗涤
(5)紫 小于
7.答案:C
8.答案:C
9.解析:(1)标出使用温度的仪器是量筒、容量瓶和温度计,液体体积受温度的影响,量取液体体积需在标明的温度下进行;配制溶液时需指明温度,温度改变会影响浓度;温度计是测量物质的温度的仪器,须标明温度的量程和刻度值。(2)使用前需要检查是否漏水的是容量瓶、分液漏斗,它们都是需密封使用的容器,所以需要检查是否漏水。(3)称取10.5 g固体样品,则砝码为10 g,游码为0.5 g,天平的设计是左盘的物质质量等于右盘砝码质量加游码的质量,如放反,则物品的质量等于砝码减游码的质量,则物品的质量为10 g-0.5 g=9.5 g。(4)配制500 mL 0.52 mol·L-1的NaOH溶液,需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、500 mL容量瓶和胶头滴管。(5)A.砝码生锈后质量偏大,导致所取溶质物质的量偏高,溶液的浓度偏大,A符合题意。B.将NaOH放在托盘天平的右盘上称量(使用游码);导致所取溶质物质的量偏低,溶液的浓度偏小,B不符合题意。C.待溶液冷却至室温后体积减小,则溶液的浓度偏大,C符合题意。D.往容量瓶转移时,有少量液体溅出,导致溶质的物质的量偏低,溶液的浓度偏小,D不符合题意。E.定容时俯视容量瓶刻度线,导致溶液总体积偏小,溶液的浓度偏大,E符合题意。F.容量瓶内残留一定量蒸馏水,不影响溶液配制,溶液的浓度不变,故F不符合题意。G.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液总体积偏大,溶液的浓度偏小,G不符合题意。(6)c(HCl)== mol·L-1=12.5 mol·L-1。配制240 mL 0.1 mol·L-1的盐酸应选用250 mL容量瓶,量取浓盐酸的浓度为12.5 mol·L-1,设需要12.5 mol·L-1的盐酸的体积为V L,则根据溶液稀释公式可得,0.25 L×0.1 mol·L-1=12.5 mol·L-1×V L,需该浓度盐酸体积V= L=0.002 L。
答案:(1)abd (2)be (3)9.5 (4)500 mL容量瓶 胶头滴管 (5)ACE (6)①12.5 mol·L-1 ②2 250
10.解析:(1)配制的溶液体积应为500 mL,所需NaOH固体的质量为0.10 mol·L-1×0.5×40 g·mol-1=2.0 g。(2)NaOH需放在烧杯中称量,称量NaOH要用到托盘天平、烧杯和药匙。(3)①砝码质量大于NaOH质量,实际NaOH质量小于计算质量,所配溶液浓度偏低。②砝码质量偏大,所称NaOH质量也偏大,所配溶液浓度偏高。③未洗涤烧杯和玻璃棒会导致溶质减少,所配溶液浓度偏低。④容量瓶未干燥不影响所配溶液浓度。⑤溶液液面高于刻度线,溶液浓度偏低。⑥未冷却,定容后溶液液面低于刻度线,溶液浓度偏高。⑦摇匀后溶液液面低于刻度线是由于部分溶液沾到了容量瓶上壁和瓶口处,再加水,溶液浓度偏低。
答案:(1)2.0 (2)abe (3)①③⑤⑦
