人教版高中物理选修3-5 18.4 波尔的量子模型 课件(共25张PPT)
文档属性
| 名称 | 人教版高中物理选修3-5 18.4 波尔的量子模型 课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2016-01-24 21:39:50 | ||
图片预览








文档简介
课件25张PPT。伦敦伦敦—英帝国第一位物理学家 开尔文开尔文
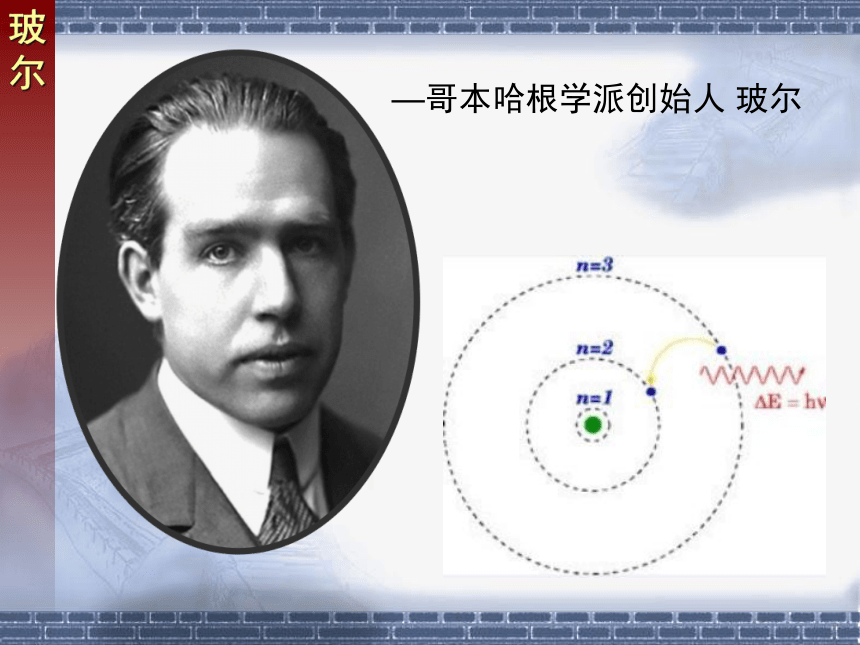
开尔文—经典物理学终结者 普朗克普朗克—世纪伟人 爱因斯坦爱因斯坦—哥本哈根学派创始人 玻尔玻尔薛定谔海森堡
泡利
狄拉克1927年索尔维会议 汤姆孙
发现电子汤姆孙的西瓜模型 α粒子
散射实验卢瑟福的核式结构模型回顾科学家对原子结构的探究过程原子不可割汤姆孙的西瓜模型卢瑟福模型的困难原子核式结构模型与经典电磁理论的矛盾核外电子绕核运动事实上:?原子是稳定的?原子光谱是线状谱卢瑟福核式模型无法解释原子的稳定性和氢原子光谱的分立特征卢瑟福的核式结构模型? 围绕原子核运动的电子轨道半径只
能是某些不连续(分立)的数值。一、玻尔的原子模型1、轨道量子化假设:(1)如氢原子电子的可能轨道r半经:…(3)人造卫星轨道可按要求任意轨道半经,这种轨道半经是连续的(2)电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射电子在不同的轨道运动对应着不同的状态,原子在不同的状态中具有不同的能量,即能量是量子化的2、能量量子化假设 :(1)能级:这些量子化的能量值叫做能级. (2)定态:在这些状态中原子是稳的, 电子虽然绕核运动,但并不向外辐射能量。这些状态叫定态。
能级图 (3) 基态:能量值最低的状态轨道半径最小(离核最近)-----与卫星绕地球运动类比
(4) 激发态:除基态外的状态氢原子能级图 原子的能量包括核外电子动能和核与电子间的势能 取 时的能量为0,其他的能级能量均为负 当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En)时,会放出能量为hv的光子.3、跃迁假设能级图 反之电子吸收光子时会从能量较低的轨道跃迁到能量较高的轨道,同样满足上式关系
问题:氢原子的电子从 n=3的轨道,跃迁到基态发射的光子频率为多少??(m>n)玻尔理论成功解释了氢原子光谱的不连续 原子从较高能级跃迁到较低能级,放出光子的能量等于前后两能级差,( ) 由于能级是分立的,所以发射的光子能量也是分立的 ,因此原子光谱只有一些分立的亮线。小结一、玻尔原子结构模型内容1、轨道量子化假设2、能量量子化假设3、跃迁假设二、玻尔理论对氢光谱的解释1、向低能级跃迁发射光子2、向高能级跃迁吸收光子跃迁:三、玻尔理论的成功与局限之处1、成功之处:引入了“量子”的观念成功解释了氢原子的线状光谱2、局限之处:(1)对于外层电子较多元素的原子光谱,其理论与事实相差很大(2)过多地引用了经典的物理理论根据玻尔的原子理论,原子中电子绕核运动的半径( )
A、可以取任意值
B、可以在某一范围内取任意值
C、可以取一系列不连续的任意值
D、是一系列不连续的特定值D思考 按照波尔理论,氢原子核外电子从半径较小的轨道跃迁到半径较大的轨道上,有关能量变化的说法中,正确的是:
A、电子的动能变大,电势能变大,总能量变大
B、电子的动能变小,电势能变小,总能量变小
C、电子的动能变小,电势能变大,总能量不变
D、电子的动能变小,电势能变大,总能量变大D思考
泡利
狄拉克1927年索尔维会议 汤姆孙
发现电子汤姆孙的西瓜模型 α粒子
散射实验卢瑟福的核式结构模型回顾科学家对原子结构的探究过程原子不可割汤姆孙的西瓜模型卢瑟福模型的困难原子核式结构模型与经典电磁理论的矛盾核外电子绕核运动事实上:?原子是稳定的?原子光谱是线状谱卢瑟福核式模型无法解释原子的稳定性和氢原子光谱的分立特征卢瑟福的核式结构模型? 围绕原子核运动的电子轨道半径只
能是某些不连续(分立)的数值。一、玻尔的原子模型1、轨道量子化假设:(1)如氢原子电子的可能轨道r半经:…(3)人造卫星轨道可按要求任意轨道半经,这种轨道半经是连续的(2)电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射电子在不同的轨道运动对应着不同的状态,原子在不同的状态中具有不同的能量,即能量是量子化的2、能量量子化假设 :(1)能级:这些量子化的能量值叫做能级. (2)定态:在这些状态中原子是稳的, 电子虽然绕核运动,但并不向外辐射能量。这些状态叫定态。
能级图 (3) 基态:能量值最低的状态轨道半径最小(离核最近)-----与卫星绕地球运动类比
(4) 激发态:除基态外的状态氢原子能级图 原子的能量包括核外电子动能和核与电子间的势能 取 时的能量为0,其他的能级能量均为负 当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En)时,会放出能量为hv的光子.3、跃迁假设能级图 反之电子吸收光子时会从能量较低的轨道跃迁到能量较高的轨道,同样满足上式关系
问题:氢原子的电子从 n=3的轨道,跃迁到基态发射的光子频率为多少??(m>n)玻尔理论成功解释了氢原子光谱的不连续 原子从较高能级跃迁到较低能级,放出光子的能量等于前后两能级差,( ) 由于能级是分立的,所以发射的光子能量也是分立的 ,因此原子光谱只有一些分立的亮线。小结一、玻尔原子结构模型内容1、轨道量子化假设2、能量量子化假设3、跃迁假设二、玻尔理论对氢光谱的解释1、向低能级跃迁发射光子2、向高能级跃迁吸收光子跃迁:三、玻尔理论的成功与局限之处1、成功之处:引入了“量子”的观念成功解释了氢原子的线状光谱2、局限之处:(1)对于外层电子较多元素的原子光谱,其理论与事实相差很大(2)过多地引用了经典的物理理论根据玻尔的原子理论,原子中电子绕核运动的半径( )
A、可以取任意值
B、可以在某一范围内取任意值
C、可以取一系列不连续的任意值
D、是一系列不连续的特定值D思考 按照波尔理论,氢原子核外电子从半径较小的轨道跃迁到半径较大的轨道上,有关能量变化的说法中,正确的是:
A、电子的动能变大,电势能变大,总能量变大
B、电子的动能变小,电势能变小,总能量变小
C、电子的动能变小,电势能变大,总能量不变
D、电子的动能变小,电势能变大,总能量变大D思考
