2.1空气的成分 第1课时课件 (共36张PPT内嵌视频)化学科粤版九年级上册
文档属性
| 名称 | 2.1空气的成分 第1课时课件 (共36张PPT内嵌视频)化学科粤版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 65.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-10 09:04:38 | ||
图片预览











文档简介
(共36张PPT)
2.1 空气的成分
第1课时
第二单元 空气、物质的构成与组成
The composition of the air
Chapter two Air ,Composition and composition of matter
学习目标
01
02
了解空气的主要成分和所占体积比
通过引导“测定空气里氧气含量”实验视频的观察和分析,使学生初步学习简羊的实验设计、观来实验现象并加以描述,对相关实验现象能给出合理的解粹
教学重点
通过实验探究空气的组成
01 空气的组成
教学难点
知道氦气、稀有气体的主要用途,体会物质性质与用途之间的关系
03
02 空气中氧气含量的测定
课程导入
是什么让棉被成功变身?
是什么让塑料袋变得鼓鼓的?
空 气
问题探讨
目
录
CONTENTS
1
空气有哪些成分
2
氮气和稀有气体有用吗?
空气有哪些成分
01
新课探究
一、空气有哪些成分
1. 空气成分发现史
很久以前,人们以为空气只是单一的某种物质。
新课探究
1772
浊气(氮气)
卢瑟福(苏格兰)
1773
火气(氧气)
舍勒(瑞典)
1774
脱燃素空气(氧气)
普利斯特利(英国)
1774
空气中存在氮气、氧气
拉瓦锡(法国)
一、空气有哪些成分
1. 空气成分发现史
新课探究
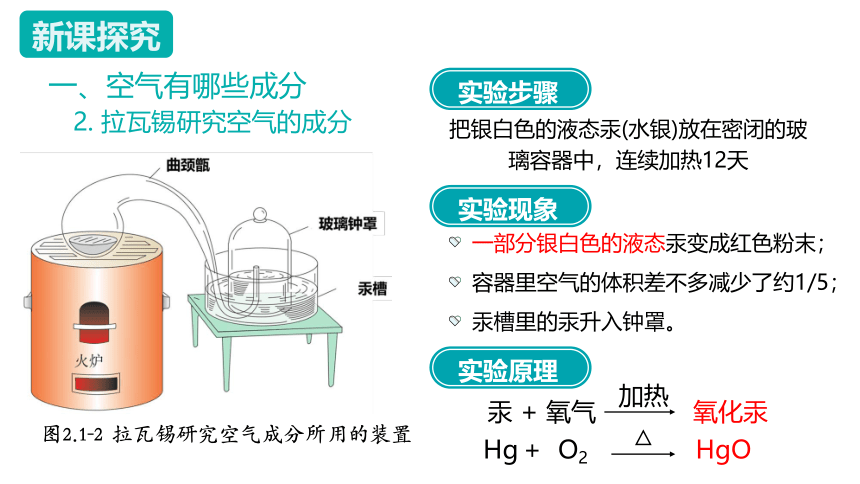
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
图2.1-2 拉瓦锡研究空气成分所用的装置
把银白色的液态汞(水银)放在密闭的玻璃容器中,连续加热12天
一部分银白色的液态汞变成红色粉末;
实验步骤
容器里空气的体积差不多减少了约1/5;
汞 + 氧气 氧化汞
加热
Hg
O2
+
HgO
△
实验现象
汞槽里的汞升入钟罩。
实验原理
新课探究
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
把汞表面上所生成的红色粉末收集后,放在一个小的容器里再加强热。
实验步骤
红色粉末又生成了银白色物质和能使带火星木条复燃的气体。
而且氧气的体积恰好等于密闭容器里所减少的体积
实验现象
空气中含有氧气,且氧气约占空气总体积的1/5。
实验结论
实验原理
氧化汞 汞+氧气
加热
HgO Hg + O2
加热
他把得到的氧气加到前一个容器里剩下的约4/5体积的气体中,结果所得气体的性质与空气的完全一样。
实验验证
拓展延伸
新课探究
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
对剩余的气体进行研究
既不供给呼吸也不支持燃烧
他认为这些气体全是氮气
空气由氧气(O2)和氮气(N2)组成
发 现
实验结论
其中氧气约占空气总体积的1/5
新课探究
由于氧气约占空气体积的1/5,因此水进入集气瓶内的体积也约占容器中空气体积的1/5。
一、空气有哪些成分
图2.1-2的实验中,汞槽里的汞为什么会升入钟罩且升入体积约占容器中空气体积的1/5?
思考
钟罩液面上升是因为瓶内压强减小。汞与氧气发生化学反应,消耗了容器内的氧气,生成物氧化汞是固体,所以密闭容器压强减小,在外界大气压强的作用下,汞液面上升。
新课探究
一、空气有哪些成分
思考
科学家是通过什么证据推理出剩余气体中除了氮气外还有其他成分的
新课探究
一、空气有哪些成分
3. 瑞利发现稀有气体的存在
从空气中分离的
氮气的密度
化学方法制得的纯净
氮气的密度
说明空气中还含有其他不支持燃烧的气体
新课探究
1894 氩
拉姆西(英语)
后经多位科学家的实验和探究
1894
稀有气体
瑞利(英国)
一、空气有哪些成分
4.稀有气体成分的发现
陆续发现了稀有气体还有氦(He)、氖(Ne)、氪(Kr)、氙(Xe)、氡(Rn)等成分
新课探究
实验时间较长;
一、空气有哪些成分
拉瓦锡测定空气中氧气含量实验的不足:
实验操作及实验装置比较复杂;
且实验过程对环境有污染。
新课探究
空气中氧气含量的测定
观察活动>>>
目的
[实验2-1] 实验装置如图
请在通风橱中进行实验
提示信息
新课探究
新课探究
观察活动>>>
实验操作 观察和思考
1.用记号将集气瓶的水面上方容积划分为5等份,组装好仪器,夹紧止水夹 实验前集气瓶里装的是什么?
2.点燃燃烧匙中的红磷,迅速插入集气瓶中,塞好胶塞。 瓶内出现什么现象?
红磷燃烧消耗了瓶内的什么物质?
3.反应停止后,待集气瓶冷却至室温,松开止水夹。 你观察到什么现象?如何解释?
水和空气
红磷燃烧,发出黄光,产生大量白烟,放热
氧气
烧杯中的水经导管进入集气瓶,集气瓶内水面上升约为1/5;因为红磷燃烧消耗氧气,实际集气瓶内压强减小,在外界大气压的作用下,水进入容器
开始前先检查装置气密性
新课探究
观察活动>>>
氧气约占空气体积的1/5
实验结论
实验原理
红磷 + 氧气 五氧化二磷
加热
P O2 P2O5
△
+
利用过量可燃物红磷充分消耗密闭容器内空气中的氧气,生成固态的五氧化二磷,使密闭容器内压强减小,在大气压的作用下,进入集气瓶内水的体积即为减少的氧气的体积。
文字表达式:
符号表达式:
新课探究
讨论与交流>>>
1. 若集气瓶内的水未上升至1/5处,可能的原因有哪些?
① 装置气密性不好
② 红磷不足或燃烧不完全
③ 未冷却至室温就打开止水夹
④ 有部分水留在导管中未进入集气瓶
新课探究
空气中氧气含量测定实验的误差分析
因素 影响
测定结果小于1/5
测定结果大于1/5
装置漏气
反应结束后外界空气进入
红磷的量不足
氧气不能完全被消耗
未待装置冷却到室温就打开止水夹
温度较高,气体膨胀,剩余气体占有较大的体积
点燃的红磷伸入瓶中过慢或伸入瓶中后未立即塞上塞子
瓶内空气受热膨胀,部分逸出
最初止水夹未夹紧
新课探究
讨论与交流>>>
2. 能否用蜡烛、木碳、硫粉、铁丝等代替红磷进行实验?
不能
木炭、蜡烛、硫粉燃烧都会生成气体,使瓶内的气体压强变化不大,导致测定结果不准确;
而不能用铁丝,是因为铁丝在空气中不能燃烧;
由此可知,选择做测定空气中氧气体积实验的物质要满足两个条件:
①在空气中能燃烧,且只与空气中的氧气发生反应;
②燃烧后的生成物不能是气体,最好是固体,需产生压强差。
新课探究
讨论与交流>>>
3. 剩余气体的主要成分是什么?
氧气
氮气
科学家们通过许多科学实验证明:
剩下不支持燃烧的气体约占 4/5,其成分是 和少量 ,
如 、 和 等。
氮气(N2)
其他气体
稀有气体
二氧化碳(CO2)
水蒸气(H2O)
新课探究
空气中氧气含量测定的改进装置
氧气
拓展延伸
新课探究
气体成分 占空气总体积的百分比/%
氮气 78
氧气 21
稀有气体(氦氖氩氪氙氡) 0.94
二氧化碳 0.03
其他 0.03
氧气
氮气
一、空气有哪些成分
5.空气的组成成分(体积分数)
水蒸气在空气中的含量不固定,因地区和天气而异。例如阴雨天,空气中的湿度大,水蒸气含量会大些。二氧化碳的含量也会因人类活动的影响等原因而有所变化。
氮气和稀有气体有用吗?
02
新课探究
二、氮气和稀有气体有用吗
1.氮气
色态味 密度 溶解性 熔点 沸点
-209.9℃ -195.8℃
无色无味气体
略小于空气
不易溶于水
物理性质
性质
用途
决定
体现
液态氮气在医学上作冷冻剂
沸点低
新课探究
二、氮气和稀有气体有用吗
1.氮气
氮气
低温、常温条件下化学性质稳定
高温等条件下可参与化学反应
制取氮肥
合成染料
制造炸药
充氮包装,保存食品
充氮灯泡
不活泼,不支持燃烧
化学性质:
新课探究
2. 稀有气体
均为无色无味气体
氦、氖、氩、氪、氙、氡六种气体
二、氮气和稀有气体有用吗
包含:
物理性质:
很不活泼(化学性质稳定),惰性气体
化学性质:
难溶于水
新课探究
2.稀有气体
稀有气体一般不与其他物质反应,曾被称为“惰性气体”
探空气球
焊接保护气
稀有气体通电时,会发出各种颜色的光:
氦气——粉红色光
氖气——红光
氩气——蓝紫色光
氙气——特强白光
氦气是密度很小的气体,
很稳定(化学性质)
激光技术
霓虹灯
用于
用于
用于
课堂小结
【检测题1】测定空气中氧气含量的装置如图所示。下列有关该实验的说法中,正确的是( )
A.实验前要检查装置的气密性
B.实验时,只取用极少量的红磷,可减少污染且不影响实验结果
C.红磷熄灭后应立刻打开弹簧夹
D.最终瓶中剩余的气体是纯净的氮气
课堂检测
A
【检测题2】有人患咽喉炎或鼻炎,医生常用“冷冻法”治疗,其冷冻剂是下列物质中的( )
A.液态氧气 B.液态空气
C.液化石油气 D.液态氮气
课堂检测
D
【检测题3】最早用定量的方法研究了空气成分的科学家是( )
A.拉瓦锡 B.张青莲 C.道尔顿 D.门捷列夫
A
【检测题4】下列事实说明空气中(主要)含有哪种成分?
(1)木条能够在空气中燃烧 ;
(2)澄清的石灰水长期暴露在空气中会变浑浊 ;
(3)空气是制氮肥的原料 ;
(4)酥脆的饼干在空气中放置一段时间会变软 。
课堂检测
氧气
二氧化碳
氮气
水蒸气
【检测题5】小樱同学用如图所示的装置测定空气中氧气含量。
(1)红磷燃烧的符号方程式是 。
(2)实验过程中,红磷要足量的目的是 。
(3)能证明空气中氧气含量的现象是 。
(4)已知金属镁在空气中燃烧,可分别与氧气与氮气反应,都生成固体物质,该实验中的红磷 (选填“能”或“不能”)用镁来代替。
课堂检测
左管液面最终上升至刻度1处
不能
消耗完装置中的氧气
P O2 P2O5
△
+
2.1 空气的成分
第1课时
第二单元 空气、物质的构成与组成
The composition of the air
Chapter two Air ,Composition and composition of matter
学习目标
01
02
了解空气的主要成分和所占体积比
通过引导“测定空气里氧气含量”实验视频的观察和分析,使学生初步学习简羊的实验设计、观来实验现象并加以描述,对相关实验现象能给出合理的解粹
教学重点
通过实验探究空气的组成
01 空气的组成
教学难点
知道氦气、稀有气体的主要用途,体会物质性质与用途之间的关系
03
02 空气中氧气含量的测定
课程导入
是什么让棉被成功变身?
是什么让塑料袋变得鼓鼓的?
空 气
问题探讨
目
录
CONTENTS
1
空气有哪些成分
2
氮气和稀有气体有用吗?
空气有哪些成分
01
新课探究
一、空气有哪些成分
1. 空气成分发现史
很久以前,人们以为空气只是单一的某种物质。
新课探究
1772
浊气(氮气)
卢瑟福(苏格兰)
1773
火气(氧气)
舍勒(瑞典)
1774
脱燃素空气(氧气)
普利斯特利(英国)
1774
空气中存在氮气、氧气
拉瓦锡(法国)
一、空气有哪些成分
1. 空气成分发现史
新课探究
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
图2.1-2 拉瓦锡研究空气成分所用的装置
把银白色的液态汞(水银)放在密闭的玻璃容器中,连续加热12天
一部分银白色的液态汞变成红色粉末;
实验步骤
容器里空气的体积差不多减少了约1/5;
汞 + 氧气 氧化汞
加热
Hg
O2
+
HgO
△
实验现象
汞槽里的汞升入钟罩。
实验原理
新课探究
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
把汞表面上所生成的红色粉末收集后,放在一个小的容器里再加强热。
实验步骤
红色粉末又生成了银白色物质和能使带火星木条复燃的气体。
而且氧气的体积恰好等于密闭容器里所减少的体积
实验现象
空气中含有氧气,且氧气约占空气总体积的1/5。
实验结论
实验原理
氧化汞 汞+氧气
加热
HgO Hg + O2
加热
他把得到的氧气加到前一个容器里剩下的约4/5体积的气体中,结果所得气体的性质与空气的完全一样。
实验验证
拓展延伸
新课探究
一、空气有哪些成分
2. 拉瓦锡研究空气的成分
对剩余的气体进行研究
既不供给呼吸也不支持燃烧
他认为这些气体全是氮气
空气由氧气(O2)和氮气(N2)组成
发 现
实验结论
其中氧气约占空气总体积的1/5
新课探究
由于氧气约占空气体积的1/5,因此水进入集气瓶内的体积也约占容器中空气体积的1/5。
一、空气有哪些成分
图2.1-2的实验中,汞槽里的汞为什么会升入钟罩且升入体积约占容器中空气体积的1/5?
思考
钟罩液面上升是因为瓶内压强减小。汞与氧气发生化学反应,消耗了容器内的氧气,生成物氧化汞是固体,所以密闭容器压强减小,在外界大气压强的作用下,汞液面上升。
新课探究
一、空气有哪些成分
思考
科学家是通过什么证据推理出剩余气体中除了氮气外还有其他成分的
新课探究
一、空气有哪些成分
3. 瑞利发现稀有气体的存在
从空气中分离的
氮气的密度
化学方法制得的纯净
氮气的密度
说明空气中还含有其他不支持燃烧的气体
新课探究
1894 氩
拉姆西(英语)
后经多位科学家的实验和探究
1894
稀有气体
瑞利(英国)
一、空气有哪些成分
4.稀有气体成分的发现
陆续发现了稀有气体还有氦(He)、氖(Ne)、氪(Kr)、氙(Xe)、氡(Rn)等成分
新课探究
实验时间较长;
一、空气有哪些成分
拉瓦锡测定空气中氧气含量实验的不足:
实验操作及实验装置比较复杂;
且实验过程对环境有污染。
新课探究
空气中氧气含量的测定
观察活动>>>
目的
[实验2-1] 实验装置如图
请在通风橱中进行实验
提示信息
新课探究
新课探究
观察活动>>>
实验操作 观察和思考
1.用记号将集气瓶的水面上方容积划分为5等份,组装好仪器,夹紧止水夹 实验前集气瓶里装的是什么?
2.点燃燃烧匙中的红磷,迅速插入集气瓶中,塞好胶塞。 瓶内出现什么现象?
红磷燃烧消耗了瓶内的什么物质?
3.反应停止后,待集气瓶冷却至室温,松开止水夹。 你观察到什么现象?如何解释?
水和空气
红磷燃烧,发出黄光,产生大量白烟,放热
氧气
烧杯中的水经导管进入集气瓶,集气瓶内水面上升约为1/5;因为红磷燃烧消耗氧气,实际集气瓶内压强减小,在外界大气压的作用下,水进入容器
开始前先检查装置气密性
新课探究
观察活动>>>
氧气约占空气体积的1/5
实验结论
实验原理
红磷 + 氧气 五氧化二磷
加热
P O2 P2O5
△
+
利用过量可燃物红磷充分消耗密闭容器内空气中的氧气,生成固态的五氧化二磷,使密闭容器内压强减小,在大气压的作用下,进入集气瓶内水的体积即为减少的氧气的体积。
文字表达式:
符号表达式:
新课探究
讨论与交流>>>
1. 若集气瓶内的水未上升至1/5处,可能的原因有哪些?
① 装置气密性不好
② 红磷不足或燃烧不完全
③ 未冷却至室温就打开止水夹
④ 有部分水留在导管中未进入集气瓶
新课探究
空气中氧气含量测定实验的误差分析
因素 影响
测定结果小于1/5
测定结果大于1/5
装置漏气
反应结束后外界空气进入
红磷的量不足
氧气不能完全被消耗
未待装置冷却到室温就打开止水夹
温度较高,气体膨胀,剩余气体占有较大的体积
点燃的红磷伸入瓶中过慢或伸入瓶中后未立即塞上塞子
瓶内空气受热膨胀,部分逸出
最初止水夹未夹紧
新课探究
讨论与交流>>>
2. 能否用蜡烛、木碳、硫粉、铁丝等代替红磷进行实验?
不能
木炭、蜡烛、硫粉燃烧都会生成气体,使瓶内的气体压强变化不大,导致测定结果不准确;
而不能用铁丝,是因为铁丝在空气中不能燃烧;
由此可知,选择做测定空气中氧气体积实验的物质要满足两个条件:
①在空气中能燃烧,且只与空气中的氧气发生反应;
②燃烧后的生成物不能是气体,最好是固体,需产生压强差。
新课探究
讨论与交流>>>
3. 剩余气体的主要成分是什么?
氧气
氮气
科学家们通过许多科学实验证明:
剩下不支持燃烧的气体约占 4/5,其成分是 和少量 ,
如 、 和 等。
氮气(N2)
其他气体
稀有气体
二氧化碳(CO2)
水蒸气(H2O)
新课探究
空气中氧气含量测定的改进装置
氧气
拓展延伸
新课探究
气体成分 占空气总体积的百分比/%
氮气 78
氧气 21
稀有气体(氦氖氩氪氙氡) 0.94
二氧化碳 0.03
其他 0.03
氧气
氮气
一、空气有哪些成分
5.空气的组成成分(体积分数)
水蒸气在空气中的含量不固定,因地区和天气而异。例如阴雨天,空气中的湿度大,水蒸气含量会大些。二氧化碳的含量也会因人类活动的影响等原因而有所变化。
氮气和稀有气体有用吗?
02
新课探究
二、氮气和稀有气体有用吗
1.氮气
色态味 密度 溶解性 熔点 沸点
-209.9℃ -195.8℃
无色无味气体
略小于空气
不易溶于水
物理性质
性质
用途
决定
体现
液态氮气在医学上作冷冻剂
沸点低
新课探究
二、氮气和稀有气体有用吗
1.氮气
氮气
低温、常温条件下化学性质稳定
高温等条件下可参与化学反应
制取氮肥
合成染料
制造炸药
充氮包装,保存食品
充氮灯泡
不活泼,不支持燃烧
化学性质:
新课探究
2. 稀有气体
均为无色无味气体
氦、氖、氩、氪、氙、氡六种气体
二、氮气和稀有气体有用吗
包含:
物理性质:
很不活泼(化学性质稳定),惰性气体
化学性质:
难溶于水
新课探究
2.稀有气体
稀有气体一般不与其他物质反应,曾被称为“惰性气体”
探空气球
焊接保护气
稀有气体通电时,会发出各种颜色的光:
氦气——粉红色光
氖气——红光
氩气——蓝紫色光
氙气——特强白光
氦气是密度很小的气体,
很稳定(化学性质)
激光技术
霓虹灯
用于
用于
用于
课堂小结
【检测题1】测定空气中氧气含量的装置如图所示。下列有关该实验的说法中,正确的是( )
A.实验前要检查装置的气密性
B.实验时,只取用极少量的红磷,可减少污染且不影响实验结果
C.红磷熄灭后应立刻打开弹簧夹
D.最终瓶中剩余的气体是纯净的氮气
课堂检测
A
【检测题2】有人患咽喉炎或鼻炎,医生常用“冷冻法”治疗,其冷冻剂是下列物质中的( )
A.液态氧气 B.液态空气
C.液化石油气 D.液态氮气
课堂检测
D
【检测题3】最早用定量的方法研究了空气成分的科学家是( )
A.拉瓦锡 B.张青莲 C.道尔顿 D.门捷列夫
A
【检测题4】下列事实说明空气中(主要)含有哪种成分?
(1)木条能够在空气中燃烧 ;
(2)澄清的石灰水长期暴露在空气中会变浑浊 ;
(3)空气是制氮肥的原料 ;
(4)酥脆的饼干在空气中放置一段时间会变软 。
课堂检测
氧气
二氧化碳
氮气
水蒸气
【检测题5】小樱同学用如图所示的装置测定空气中氧气含量。
(1)红磷燃烧的符号方程式是 。
(2)实验过程中,红磷要足量的目的是 。
(3)能证明空气中氧气含量的现象是 。
(4)已知金属镁在空气中燃烧,可分别与氧气与氮气反应,都生成固体物质,该实验中的红磷 (选填“能”或“不能”)用镁来代替。
课堂检测
左管液面最终上升至刻度1处
不能
消耗完装置中的氧气
P O2 P2O5
△
+
同课章节目录
