第二章海水中的重要元素 复习课件(共58张ppt)高中化学人教版2019高中化学必修一
文档属性
| 名称 | 第二章海水中的重要元素 复习课件(共58张ppt)高中化学人教版2019高中化学必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-10 18:41:17 | ||
图片预览









文档简介
(共58张PPT)
第二章 海水中的重要元素
——钠和氯
章末复习
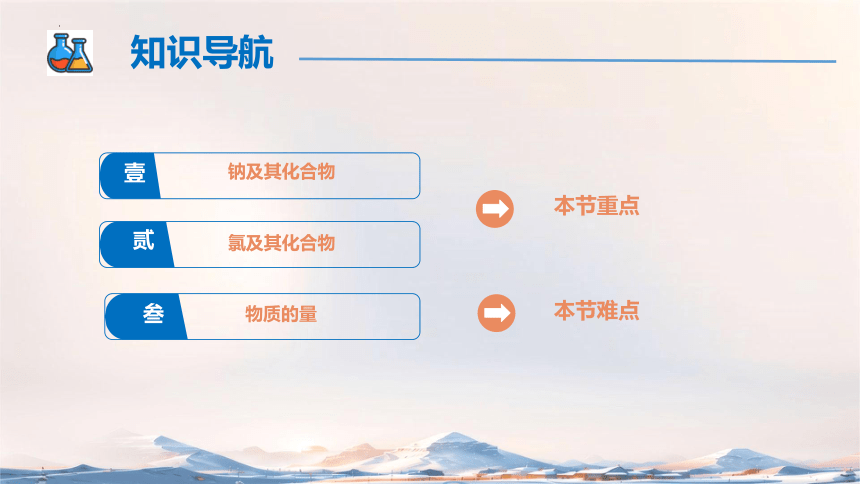
壹
贰
叁
钠及其化合物
氯及其化合物
物质的量
知识导航
本节重点
本节难点
金属钠放置于空气中,最终会变成什么物质?
银白色金属钠
(Na)
O2
①
表面变暗
(Na2O)
H2O
②
白色固体
(NaOH)
表面变成溶液
(NaOH潮解)
CO2
④
白色块状物质
(Na2CO3 10H2O)
风化
⑤
白色粉末状物质
(Na2CO3)
交流·讨论
H2O
③
探究课堂
①钠与其他非金属反应
2、钠的化学性质
(1)在氯气中燃烧:现象:燃烧、产生白色的烟
(2)与硫反应:现象:火星四射、发生爆炸
2Na + Cl2 == 2NaCl
2Na + S == Na2S
点燃
研磨
探究课堂
②钠与水的反应
2Na + 2H2O == 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
探究课堂
思考:(1)将金属钠投到CuSO4溶液中会有什么现象?为什么?
现象:浮、熔、游、响、蓝色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
(2)将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、熔、游、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
探究课堂
2Na+2HCl=2NaCl+H2↑
一般规律:遇酸酸优先,遇盐水在前
(3)将钠放入盐酸中会反应吗,生成什么物质?
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2、氧化钠(Na2O)的性质和CaO相似。请写出Na2O分别与H2O、CO2、HCl发生反应的化学方程式。
Na2O+2HCl=2NaCl+H2O
思考交流
探究课堂
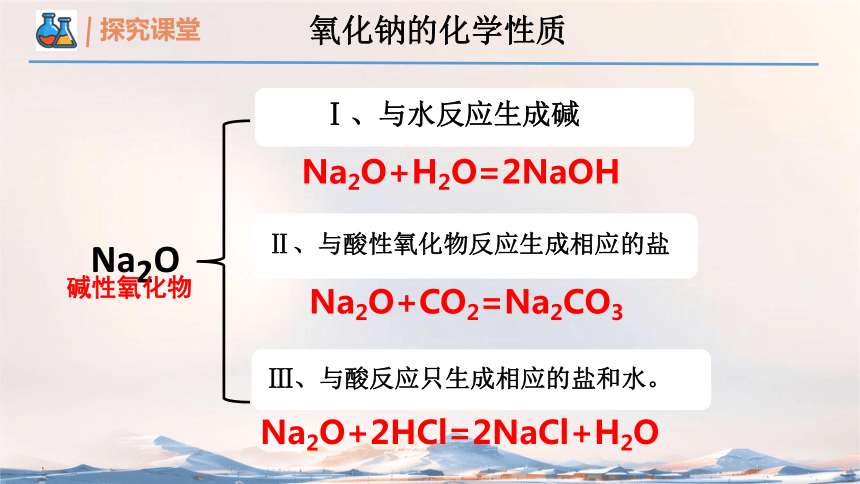
Na2O
碱性氧化物
Na2O+H2O=2NaOH
Na2O+2HCl=2NaCl+H2O
Na2O+CO2=Na2CO3
氧化钠的化学性质
Ⅰ、与水反应生成碱
Ⅱ、与酸性氧化物反应生成相应的盐
Ⅲ、与酸反应只生成相应的盐和水。
探究课堂
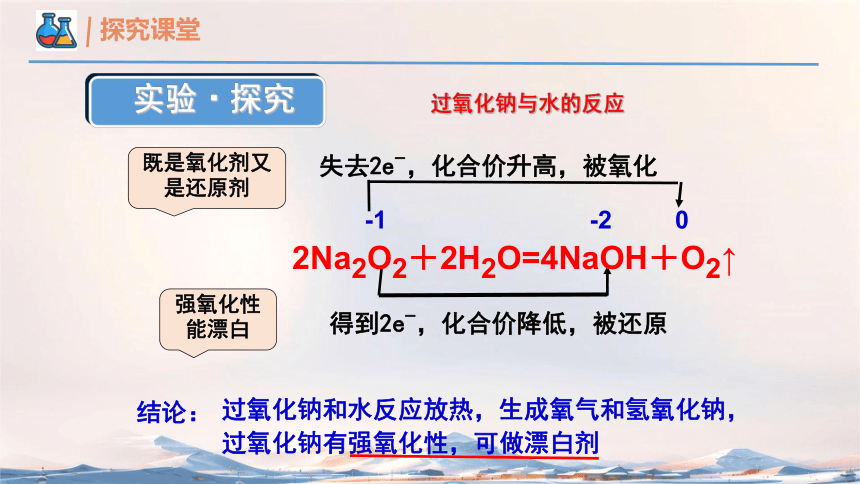
-1 -2 0
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
强氧化性能漂白
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性,可做漂白剂
实验·探究
2Na2O2+2H2O=4NaOH+O2↑
过氧化钠与水的反应
探究课堂
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
结论:
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
2Na2O2+2CO2=2Na2CO3+O2
-1 -2 0
过氧化钠与二氧化碳的反应
实验·探究
强氧化性能漂白
探究课堂
过氧化钠的用途
过氧化钠是强氧化剂,可用来漂白织物、麦杆、羽毛等;
探究课堂
III、过氧化钠与盐酸反应
2Na2O2 + 4HCl = =4NaCl + 2H2O + O2↑
思考:过氧化钠是碱性氧化物吗?
不是,因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。
探究课堂
步骤 Na2CO3 NaHCO3
①加入几滴水
②加10mL水
③加1~2滴酚酞溶液
初步结论 加水结块;放热
加水部分溶解;
感受不到热量变化
振荡时间长时可溶解
固体量减少
溶液变红(较深)
溶液变微红色
实验探究1
溶解性: Na2CO3 > NaHCO3,
溶液碱性: Na2CO3 > NaHCO3
Na2CO3和NaHCO3的溶解性
探究课堂
Na2CO3和NaHCO3的热稳定性
Na2CO3 NaHCO3
操作和现象 取等量的碳酸钠和碳酸氢钠(约1g)分别置于两支试管,同时加热,烧杯A和烧杯B的现象。 现象: 。 装置 结论 烧杯A无变化,烧杯B中溶液变浑浊
2NaHCO3 Na2CO3+H2O+CO2↑
△
实验探究2
Na2CO3和NaHCO3与稀盐酸的反应
Na2CO3 NaHCO3
现象 化学方程式
结论 NaHCO3反应更剧烈,产生的气体多。
Na2CO3+2HCl==2NaCl+H2O+CO2↑
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3+HCl==NaCl+H2O+CO2↑
碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。
实验探究3
利用与盐酸反应的快慢
鉴别Na2CO3和NaHCO3
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 俗名 纯碱、苏打 小苏打 颜色状态 白色粉末 细小白色晶体 溶解性 水溶液碱性强弱 热稳定性 Na2CO3 >NaHCO3 与酸反应
相互转化关系 Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
CO32- + 2H+=H2O+CO2↑
HCO3- + H+ = H2O+CO2↑
Na2CO3
NaHCO3
/ NaOH
△
/ HCl
H2O + CO2
小结:碳酸钠与碳酸氢钠的比较
思考1:怎样鉴别碳酸钠和碳酸氢钠?
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是NaHCO3 。
2NaHCO3 == Na2CO3 + H2O + CO2
△
(2) 在固体中加入相同浓度的盐酸,反应剧烈的是NaHCO3 。
CO32- + H+ = HCO3- HCO3- + H+ = H2O + CO2 ↑
逐滴加入盐酸立即产生气体的是NaHCO3 。
(3) 加入氯化钡或氯化钙,有沉淀生成的是Na2CO3 。
CO32- + Ba2+ = BaCO3
CO32- + Ca2+ = CaCO3
探究课堂
Na2O
Na
H2O
Na2CO3
CO2
NaHCO3
O2
Na2O2
NaOH
O2
H2O
H2O
CO2
钠及其重要化合物
小结
H2O + CO2
/ HCl
/ NaOH
探究课堂
2、焰色试验是金属元素(可以是金属原子也可以是金属离子)自身具有的性质,是物理变化。
注意:
1、钠元素的焰色呈黄色,
钾元素的焰色为紫色(必须透过蓝色钴玻璃观察)。
探究课堂
1、Cl2与金属、非金属单质的反应:
2Na + Cl2 === 2 NaCl
2Fe + 3Cl2 === 2FeCl3
Cl2 + Cu === CuCl2
点燃
点燃
点燃
氯气能与大多数金属化合,生成金属氯化物
探究课堂
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰。
生成的HCl在空气中与水蒸气结合呈现雾状。
H2+ Cl2 == 2HCl
点燃
HCl气体溶于水,就成为我们常用的盐酸
探究课堂
2、与水反应
次氯酸
(HClO)
的性质
①强氧化性 (消毒、漂白性 )
②一元弱酸 (酸性比碳酸还弱)
③ 不稳定易分解
2HClO==2HCl +O2↑
光照
次氯酸的强氧化性不仅可以杀菌、消毒,还可用作棉、麻和纸张的漂白剂。
常温时,1体积水可溶解约2体积的氯气,氯气的水溶液称为氯水
(溶于水中的部分Cl2与水发生反应)
既是氧化剂又是还原剂
液氯与氯水的区别?新制氯水与久置氯水的区别?
探究课堂
0
-1
+1
实验
将滴有酚酞的氢氧化钠溶液
滴入充满氯气的集气瓶中,振荡
气体颜色消失
溶液红色褪去
Cl2 + H2O = HCl + HClO
现象:
反应:
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
Cl2 + 2 NaOH = NaCl + NaClO + H2O
次氯酸钠
3、与碱反应
探究课堂
2NaOH+Cl2=NaClO+NaCl+H2O
有效成分:
NaClO
2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
漂白粉、漂粉精
漂白液
有效成分: Ca(ClO)2
3、与碱反应
探究课堂
氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
工业 Ca(ClO)2+2HCl===CaCl2+2HClO
漂白原理:
(反应原理:强酸制弱酸)
氯水、漂白液、漂白粉、漂粉精的漂白作用都是
反应生成的HClO
探究课堂
二、氯气的实验室制法
氧化剂:MnO2
MnO2 + 4HCl(浓)= MnCl2 +Cl2 + 2H2O
△
一定量的浓盐酸与过量MnO2 发生反应,能否把盐酸反应完?
还原剂:HCl
不能!稀盐酸与二氧化锰不发生反应。
舍勒发现氯气的方法至今还是实验室中制取氯气的主要方法之一
探究课堂
实验室中制取气体装置的设计
气体发生装置
气体净化、干燥装置
气体收集装置
尾气处理装置
探究课堂
固体与固体反应物,加热制气
1.气体发生装置
依据:反应物的状态和反应条件
例如:氧气等
长颈漏斗
固体和液体混合制气,不加热
例如:氢气、二氧化碳等
探究课堂
反应物中有液体,需加热
例如:氯气
分液漏斗
圆底烧瓶
酒精灯
铁架台(带铁圈铁夹)
石棉网
导管
双孔塞
探究课堂
洗气瓶:
盛液体试剂
球型干燥管:
盛固体试剂
U型干燥管:
盛固体试剂
硬质玻璃管加热条件下用固体除杂
2.气体净化装置
常用除杂(净化)装置如下:
“大进小出”
依据:气体及其所含杂质的性质
探究课堂
收集比空气重
的气体
收集难溶或微溶
于水的气体
收集比空气轻的
气体
3.气体收集装置
依据:气体的密度、溶解性、是否与水反应
例如:氧气、氯气
例如:氧气、氢气、
一氧化碳
例如:氢气、氨气
探究课堂
4.尾气处理装置(如需要)
难以吸收的可燃性气体处理,选用B。
A
C
B
说明:溶解速度不很快,溶解度也不很大的气体用装置A;
少量尾气可以集于气球中,选用C;
依据:气体的性质
探究课堂
(1)方法和结论:
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
(2)试剂AgNO3溶液、稀硝酸
稀硝酸—排除干扰离子CO32- 、 SO42-等
三、氯离子的检验
探究课堂
Cl- + Ag+ = AgCl
CO32- +2 Ag+ = Ag2CO3
Ag2CO3 +2H+ = 2Ag+ +CO2 + H2O
加硝酸,以排除CO32-的干扰
涉及到的相关反应:
探究课堂
三、物质的量与 NA、粒子数之间的关系
物质的量
粒子个数
阿伏加德罗常数
探究课堂
例:0.5mol O2中含有的氧分子数目是多少?
氧原子数目是多少?
解:O2 的分子数为
N(O2) = n × NA
= 0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
氧原子数为
N(O)= 3.01 ×1023×2
= 6.02 × 1023
探究课堂
1. 1mol H2SO4中含有 molH、____ molS 、___ molO
3 . 2NA个 H2 是 mol H2 ,含有____molH
2. 1.5mol Fe2(SO4)3中含 molFe3+, molSO42-
4、3.01×1023个H+相当于 mol H+
2
1
4
3
4.5
2
4
0.5
5、1molSO42- 有 _____个 SO42-,所带电荷为————个
NA
2NA
探究课堂
6、0.5 mol H2O中 含有 个H2O,其中含 个H,含 个O,含 个原子,含__________个电子
3.01×1023
6.02×1023
3.01×1023
9.03×1023
5NA
探究课堂
0.2
0.4NA
0.8
0.8NA
0.4
7、1.204×1023个H2SO4的物质的量为 mol ,含 mol H,含 mol O,含 个H,含 个O
五、物质的量、质量、摩尔质量之间的关系
物质的量(mol)
质量(g)
摩尔质量(g/mol)
探究课堂
1、 24.5gH2SO4的物质的量是多少?
2、 1.50molNa2CO3的质量是多少?
nH2SO4= =
mH2SO4
MH2SO4
24.5g
98g.mol-1
=0.25mol
mNa2CO3 = nNa2CO3 MNa2CO3
=1.5mol X 106g.mol-1=159g
探究课堂
二、阿伏加德罗定律
1、含义:同温同压下,相同体积的任何气体都含有相同数目的分子。
“三同”
定
“一同”
同温
同压
同体积
同分子数
2、适用范围:只适用于气体,可以是单一气体,也可以是混合气体。
3、依据: PV=nRT
探究课堂
A
③>②>⑤>④>①
探究课堂
1:2
3:4
11:14
1:2
11:7
11:7
探究课堂
三、气体摩尔体积(Vm)
1、定义:1mol气体所占的体积。
2、单位:L / mol( L · mol-1 )
3、公式: Vm=
V
n
4、影响 Vm 的因素:温度和压强
5、标准状况下(0 ℃ 1.01 kPa),1mol任何气体所占的体积都约为22.4 L。即标况下,气体的摩尔体积 Vm≈ 22.4 L/mol。
探究课堂
1:1
1:1
5:3
4:11
4:11
H2
H2
H2O
H2O
探究课堂
物质的量浓度(CB)
1. 定义:单位体积溶液里所含溶质B的物质的量,符号为 CB
cB =
nB
V液
2.表达式:
溶液体积
3.单位:mol / L 或 mol·L-1
注意:同一溶液,溶质的物质的量浓度与所取溶液体积无关。
V溶液 ≠ V溶质 + V溶剂
V溶液= =
m溶液
ρ液
m溶质 + m溶剂
ρ液
探究课堂
例题:某市售浓硫酸中溶质的质量分数为98%,密度为 1.84g/cm3,
计算该硫酸的物质的量浓度。
探究课堂
三、一定物质的量浓度溶液的配制
、 、 、 、 、 。
天平
量筒
烧杯
玻璃棒
容量瓶
胶头滴管
探究课堂
1. 容量瓶的使用
a 规格:
50mL、100 mL、250 mL、500 mL、1000 mL等
b 使用前检漏
c 不能加热,不能久贮溶液,不能在瓶内溶解固体或稀释液体,不能用于化学反应。
d 规格选择:配制溶液时选择与所配溶液体积相等或稍大的容量瓶
探究课堂
准确配制一定物质的量浓度溶液步骤:
计算
溶解
洗涤
转移
定容
摇匀
转移
称量
装瓶
探究课堂
增大
不变
增大
减小
不变
减小
减小
不变
减小
探究课堂
增大
不变
增大
减小
不变
减小
减小
不变
减小
减小
不变
减小
探究课堂
不变
减小
增大
减小
不变
减小
减小
不变
减小
不变
减小
增大
不变
增大
减小
探究课堂
1、等物质的量的CO与CO2
物质的量之比_________
分子数之比____________
原子个数之比__________
含氧原子数之比________
质量之比__________
1:1
1:1
2:3
1:2
7:11
探究课堂
等质量的CO与CO2
物质的量之比_________
分子数之比____________
原子个数之比__________
含氧原子数之比________
质量之比__________
11:7
11:7
11:14
22:21
1:1
随堂练习
2、下列离子方程式中,错误的是( )
A.氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.氯气与水反应:Cl2+H2O H++Cl-+HClO
C.盐酸与AgNO3溶液反应:HCl+Ag+= H++AgCl↓
D.NaCl溶液与AgNO3溶液反应:Cl-+Ag+= AgCl↓
C
Na
Na2O2
NaOH
Na2CO3
NaHCO3
2NaHCO3 Na2CO3+H2O+CO2↑
△
CO2 + 2OH- == CO32- + H2O
THANKS
第二章 海水中的重要元素
——钠和氯
章末复习
壹
贰
叁
钠及其化合物
氯及其化合物
物质的量
知识导航
本节重点
本节难点
金属钠放置于空气中,最终会变成什么物质?
银白色金属钠
(Na)
O2
①
表面变暗
(Na2O)
H2O
②
白色固体
(NaOH)
表面变成溶液
(NaOH潮解)
CO2
④
白色块状物质
(Na2CO3 10H2O)
风化
⑤
白色粉末状物质
(Na2CO3)
交流·讨论
H2O
③
探究课堂
①钠与其他非金属反应
2、钠的化学性质
(1)在氯气中燃烧:现象:燃烧、产生白色的烟
(2)与硫反应:现象:火星四射、发生爆炸
2Na + Cl2 == 2NaCl
2Na + S == Na2S
点燃
研磨
探究课堂
②钠与水的反应
2Na + 2H2O == 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
探究课堂
思考:(1)将金属钠投到CuSO4溶液中会有什么现象?为什么?
现象:浮、熔、游、响、蓝色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
(2)将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、熔、游、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
探究课堂
2Na+2HCl=2NaCl+H2↑
一般规律:遇酸酸优先,遇盐水在前
(3)将钠放入盐酸中会反应吗,生成什么物质?
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2、氧化钠(Na2O)的性质和CaO相似。请写出Na2O分别与H2O、CO2、HCl发生反应的化学方程式。
Na2O+2HCl=2NaCl+H2O
思考交流
探究课堂
Na2O
碱性氧化物
Na2O+H2O=2NaOH
Na2O+2HCl=2NaCl+H2O
Na2O+CO2=Na2CO3
氧化钠的化学性质
Ⅰ、与水反应生成碱
Ⅱ、与酸性氧化物反应生成相应的盐
Ⅲ、与酸反应只生成相应的盐和水。
探究课堂
-1 -2 0
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
强氧化性能漂白
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性,可做漂白剂
实验·探究
2Na2O2+2H2O=4NaOH+O2↑
过氧化钠与水的反应
探究课堂
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
结论:
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
2Na2O2+2CO2=2Na2CO3+O2
-1 -2 0
过氧化钠与二氧化碳的反应
实验·探究
强氧化性能漂白
探究课堂
过氧化钠的用途
过氧化钠是强氧化剂,可用来漂白织物、麦杆、羽毛等;
探究课堂
III、过氧化钠与盐酸反应
2Na2O2 + 4HCl = =4NaCl + 2H2O + O2↑
思考:过氧化钠是碱性氧化物吗?
不是,因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。
探究课堂
步骤 Na2CO3 NaHCO3
①加入几滴水
②加10mL水
③加1~2滴酚酞溶液
初步结论 加水结块;放热
加水部分溶解;
感受不到热量变化
振荡时间长时可溶解
固体量减少
溶液变红(较深)
溶液变微红色
实验探究1
溶解性: Na2CO3 > NaHCO3,
溶液碱性: Na2CO3 > NaHCO3
Na2CO3和NaHCO3的溶解性
探究课堂
Na2CO3和NaHCO3的热稳定性
Na2CO3 NaHCO3
操作和现象 取等量的碳酸钠和碳酸氢钠(约1g)分别置于两支试管,同时加热,烧杯A和烧杯B的现象。 现象: 。 装置 结论 烧杯A无变化,烧杯B中溶液变浑浊
2NaHCO3 Na2CO3+H2O+CO2↑
△
实验探究2
Na2CO3和NaHCO3与稀盐酸的反应
Na2CO3 NaHCO3
现象 化学方程式
结论 NaHCO3反应更剧烈,产生的气体多。
Na2CO3+2HCl==2NaCl+H2O+CO2↑
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3+HCl==NaCl+H2O+CO2↑
碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。
实验探究3
利用与盐酸反应的快慢
鉴别Na2CO3和NaHCO3
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 俗名 纯碱、苏打 小苏打 颜色状态 白色粉末 细小白色晶体 溶解性 水溶液碱性强弱 热稳定性 Na2CO3 >NaHCO3 与酸反应
相互转化关系 Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
CO32- + 2H+=H2O+CO2↑
HCO3- + H+ = H2O+CO2↑
Na2CO3
NaHCO3
/ NaOH
△
/ HCl
H2O + CO2
小结:碳酸钠与碳酸氢钠的比较
思考1:怎样鉴别碳酸钠和碳酸氢钠?
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是NaHCO3 。
2NaHCO3 == Na2CO3 + H2O + CO2
△
(2) 在固体中加入相同浓度的盐酸,反应剧烈的是NaHCO3 。
CO32- + H+ = HCO3- HCO3- + H+ = H2O + CO2 ↑
逐滴加入盐酸立即产生气体的是NaHCO3 。
(3) 加入氯化钡或氯化钙,有沉淀生成的是Na2CO3 。
CO32- + Ba2+ = BaCO3
CO32- + Ca2+ = CaCO3
探究课堂
Na2O
Na
H2O
Na2CO3
CO2
NaHCO3
O2
Na2O2
NaOH
O2
H2O
H2O
CO2
钠及其重要化合物
小结
H2O + CO2
/ HCl
/ NaOH
探究课堂
2、焰色试验是金属元素(可以是金属原子也可以是金属离子)自身具有的性质,是物理变化。
注意:
1、钠元素的焰色呈黄色,
钾元素的焰色为紫色(必须透过蓝色钴玻璃观察)。
探究课堂
1、Cl2与金属、非金属单质的反应:
2Na + Cl2 === 2 NaCl
2Fe + 3Cl2 === 2FeCl3
Cl2 + Cu === CuCl2
点燃
点燃
点燃
氯气能与大多数金属化合,生成金属氯化物
探究课堂
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰。
生成的HCl在空气中与水蒸气结合呈现雾状。
H2+ Cl2 == 2HCl
点燃
HCl气体溶于水,就成为我们常用的盐酸
探究课堂
2、与水反应
次氯酸
(HClO)
的性质
①强氧化性 (消毒、漂白性 )
②一元弱酸 (酸性比碳酸还弱)
③ 不稳定易分解
2HClO==2HCl +O2↑
光照
次氯酸的强氧化性不仅可以杀菌、消毒,还可用作棉、麻和纸张的漂白剂。
常温时,1体积水可溶解约2体积的氯气,氯气的水溶液称为氯水
(溶于水中的部分Cl2与水发生反应)
既是氧化剂又是还原剂
液氯与氯水的区别?新制氯水与久置氯水的区别?
探究课堂
0
-1
+1
实验
将滴有酚酞的氢氧化钠溶液
滴入充满氯气的集气瓶中,振荡
气体颜色消失
溶液红色褪去
Cl2 + H2O = HCl + HClO
现象:
反应:
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
Cl2 + 2 NaOH = NaCl + NaClO + H2O
次氯酸钠
3、与碱反应
探究课堂
2NaOH+Cl2=NaClO+NaCl+H2O
有效成分:
NaClO
2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
漂白粉、漂粉精
漂白液
有效成分: Ca(ClO)2
3、与碱反应
探究课堂
氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
工业 Ca(ClO)2+2HCl===CaCl2+2HClO
漂白原理:
(反应原理:强酸制弱酸)
氯水、漂白液、漂白粉、漂粉精的漂白作用都是
反应生成的HClO
探究课堂
二、氯气的实验室制法
氧化剂:MnO2
MnO2 + 4HCl(浓)= MnCl2 +Cl2 + 2H2O
△
一定量的浓盐酸与过量MnO2 发生反应,能否把盐酸反应完?
还原剂:HCl
不能!稀盐酸与二氧化锰不发生反应。
舍勒发现氯气的方法至今还是实验室中制取氯气的主要方法之一
探究课堂
实验室中制取气体装置的设计
气体发生装置
气体净化、干燥装置
气体收集装置
尾气处理装置
探究课堂
固体与固体反应物,加热制气
1.气体发生装置
依据:反应物的状态和反应条件
例如:氧气等
长颈漏斗
固体和液体混合制气,不加热
例如:氢气、二氧化碳等
探究课堂
反应物中有液体,需加热
例如:氯气
分液漏斗
圆底烧瓶
酒精灯
铁架台(带铁圈铁夹)
石棉网
导管
双孔塞
探究课堂
洗气瓶:
盛液体试剂
球型干燥管:
盛固体试剂
U型干燥管:
盛固体试剂
硬质玻璃管加热条件下用固体除杂
2.气体净化装置
常用除杂(净化)装置如下:
“大进小出”
依据:气体及其所含杂质的性质
探究课堂
收集比空气重
的气体
收集难溶或微溶
于水的气体
收集比空气轻的
气体
3.气体收集装置
依据:气体的密度、溶解性、是否与水反应
例如:氧气、氯气
例如:氧气、氢气、
一氧化碳
例如:氢气、氨气
探究课堂
4.尾气处理装置(如需要)
难以吸收的可燃性气体处理,选用B。
A
C
B
说明:溶解速度不很快,溶解度也不很大的气体用装置A;
少量尾气可以集于气球中,选用C;
依据:气体的性质
探究课堂
(1)方法和结论:
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
(2)试剂AgNO3溶液、稀硝酸
稀硝酸—排除干扰离子CO32- 、 SO42-等
三、氯离子的检验
探究课堂
Cl- + Ag+ = AgCl
CO32- +2 Ag+ = Ag2CO3
Ag2CO3 +2H+ = 2Ag+ +CO2 + H2O
加硝酸,以排除CO32-的干扰
涉及到的相关反应:
探究课堂
三、物质的量与 NA、粒子数之间的关系
物质的量
粒子个数
阿伏加德罗常数
探究课堂
例:0.5mol O2中含有的氧分子数目是多少?
氧原子数目是多少?
解:O2 的分子数为
N(O2) = n × NA
= 0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
氧原子数为
N(O)= 3.01 ×1023×2
= 6.02 × 1023
探究课堂
1. 1mol H2SO4中含有 molH、____ molS 、___ molO
3 . 2NA个 H2 是 mol H2 ,含有____molH
2. 1.5mol Fe2(SO4)3中含 molFe3+, molSO42-
4、3.01×1023个H+相当于 mol H+
2
1
4
3
4.5
2
4
0.5
5、1molSO42- 有 _____个 SO42-,所带电荷为————个
NA
2NA
探究课堂
6、0.5 mol H2O中 含有 个H2O,其中含 个H,含 个O,含 个原子,含__________个电子
3.01×1023
6.02×1023
3.01×1023
9.03×1023
5NA
探究课堂
0.2
0.4NA
0.8
0.8NA
0.4
7、1.204×1023个H2SO4的物质的量为 mol ,含 mol H,含 mol O,含 个H,含 个O
五、物质的量、质量、摩尔质量之间的关系
物质的量(mol)
质量(g)
摩尔质量(g/mol)
探究课堂
1、 24.5gH2SO4的物质的量是多少?
2、 1.50molNa2CO3的质量是多少?
nH2SO4= =
mH2SO4
MH2SO4
24.5g
98g.mol-1
=0.25mol
mNa2CO3 = nNa2CO3 MNa2CO3
=1.5mol X 106g.mol-1=159g
探究课堂
二、阿伏加德罗定律
1、含义:同温同压下,相同体积的任何气体都含有相同数目的分子。
“三同”
定
“一同”
同温
同压
同体积
同分子数
2、适用范围:只适用于气体,可以是单一气体,也可以是混合气体。
3、依据: PV=nRT
探究课堂
A
③>②>⑤>④>①
探究课堂
1:2
3:4
11:14
1:2
11:7
11:7
探究课堂
三、气体摩尔体积(Vm)
1、定义:1mol气体所占的体积。
2、单位:L / mol( L · mol-1 )
3、公式: Vm=
V
n
4、影响 Vm 的因素:温度和压强
5、标准状况下(0 ℃ 1.01 kPa),1mol任何气体所占的体积都约为22.4 L。即标况下,气体的摩尔体积 Vm≈ 22.4 L/mol。
探究课堂
1:1
1:1
5:3
4:11
4:11
H2
H2
H2O
H2O
探究课堂
物质的量浓度(CB)
1. 定义:单位体积溶液里所含溶质B的物质的量,符号为 CB
cB =
nB
V液
2.表达式:
溶液体积
3.单位:mol / L 或 mol·L-1
注意:同一溶液,溶质的物质的量浓度与所取溶液体积无关。
V溶液 ≠ V溶质 + V溶剂
V溶液= =
m溶液
ρ液
m溶质 + m溶剂
ρ液
探究课堂
例题:某市售浓硫酸中溶质的质量分数为98%,密度为 1.84g/cm3,
计算该硫酸的物质的量浓度。
探究课堂
三、一定物质的量浓度溶液的配制
、 、 、 、 、 。
天平
量筒
烧杯
玻璃棒
容量瓶
胶头滴管
探究课堂
1. 容量瓶的使用
a 规格:
50mL、100 mL、250 mL、500 mL、1000 mL等
b 使用前检漏
c 不能加热,不能久贮溶液,不能在瓶内溶解固体或稀释液体,不能用于化学反应。
d 规格选择:配制溶液时选择与所配溶液体积相等或稍大的容量瓶
探究课堂
准确配制一定物质的量浓度溶液步骤:
计算
溶解
洗涤
转移
定容
摇匀
转移
称量
装瓶
探究课堂
增大
不变
增大
减小
不变
减小
减小
不变
减小
探究课堂
增大
不变
增大
减小
不变
减小
减小
不变
减小
减小
不变
减小
探究课堂
不变
减小
增大
减小
不变
减小
减小
不变
减小
不变
减小
增大
不变
增大
减小
探究课堂
1、等物质的量的CO与CO2
物质的量之比_________
分子数之比____________
原子个数之比__________
含氧原子数之比________
质量之比__________
1:1
1:1
2:3
1:2
7:11
探究课堂
等质量的CO与CO2
物质的量之比_________
分子数之比____________
原子个数之比__________
含氧原子数之比________
质量之比__________
11:7
11:7
11:14
22:21
1:1
随堂练习
2、下列离子方程式中,错误的是( )
A.氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.氯气与水反应:Cl2+H2O H++Cl-+HClO
C.盐酸与AgNO3溶液反应:HCl+Ag+= H++AgCl↓
D.NaCl溶液与AgNO3溶液反应:Cl-+Ag+= AgCl↓
C
Na
Na2O2
NaOH
Na2CO3
NaHCO3
2NaHCO3 Na2CO3+H2O+CO2↑
△
CO2 + 2OH- == CO32- + H2O
THANKS
