2.1钠及其化合物 课件(共35张ppt)高中化学人教版2019高中化学必修一
文档属性
| 名称 | 2.1钠及其化合物 课件(共35张ppt)高中化学人教版2019高中化学必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-11 18:47:23 | ||
图片预览









文档简介
(共35张PPT)
第一节 钠及其化合物
一、旧知回顾
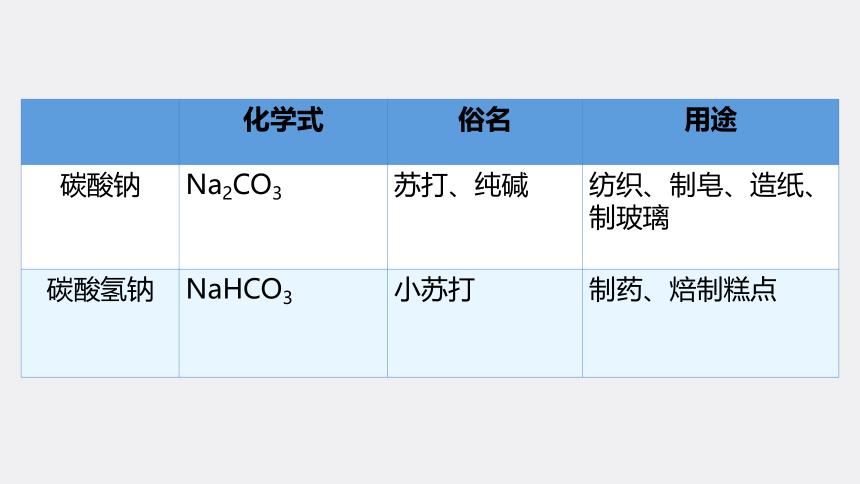
化学式 俗名 用途
碳酸钠 Na2CO3 苏打、纯碱 纺织、制皂、造纸、制玻璃
碳酸氢钠 NaHCO3 小苏打 制药、焙制糕点
二、碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
①观察碳酸钠、碳酸氢钠的外观并进行描述
Na2CO3
NaHCO3
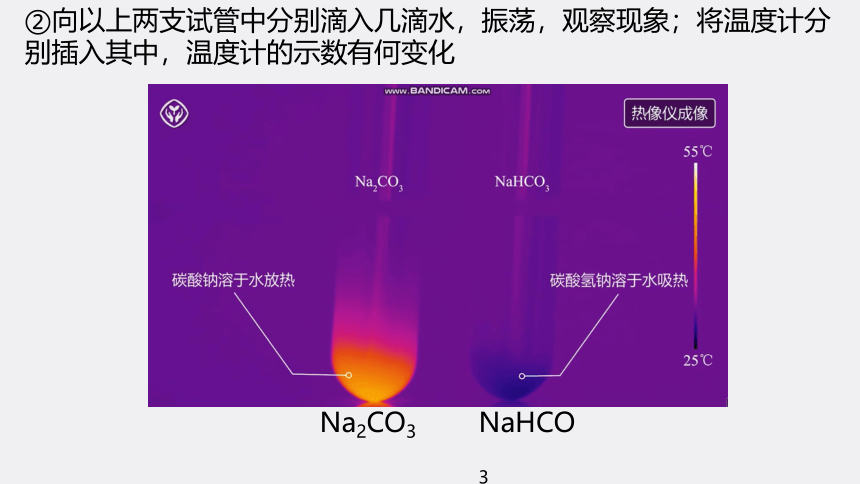
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
Na2CO3
NaHCO3
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象
Na2CO3
NaHCO3
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象
Na2CO3
NaHCO3
碳酸钠 碳酸氢钠
①观察碳酸钠、碳酸氢钠的外观并进行描述 白色粉末 细小的白色晶体
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加水后结块变成晶体,温度计示数升高 加水后部分溶解,温度计示数降低
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象 振荡一段时间后可溶解 固体量减少
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变红,溶液碱性较强 溶液变浅红,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均易溶于水,在水中的溶解度:Na2CO3>NaHCO3,Na2CO3溶于水放热,NaHCO3溶于水吸热,水溶液均显碱性,碱性:Na2CO3>NaHCO3 【实验2-4】
三、碳酸钠、碳酸氢钠热稳定性的实验探究
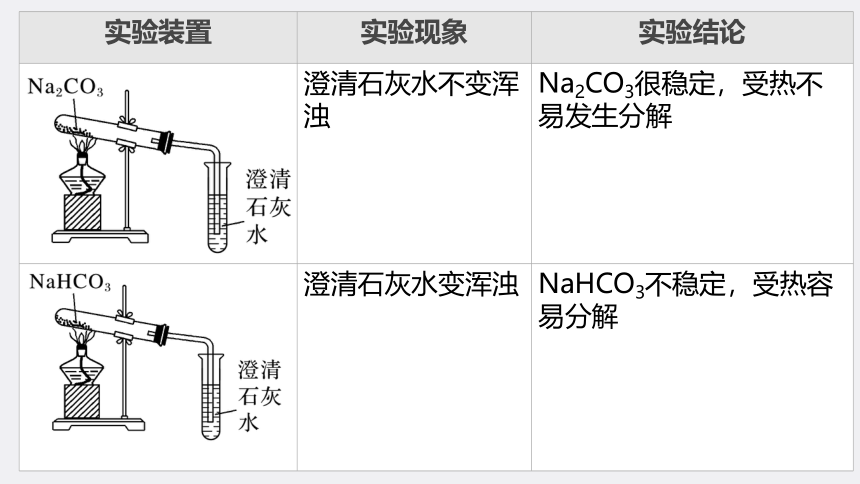
实验装置 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3很稳定,受热不易发生分解
澄清石灰水变浑浊 NaHCO3不稳定,受热容易分解
我不是胖,
是"知识"使我膨胀!
烤面包是怎么变得如此蓬松的?
思考
制作面团时,向其中加入了适量的小苏打,在烤制过程中,小苏打受热会分解产生CO2
四、碳酸钠、碳酸氢钠与酸、碱的反应
碳酸钠 碳酸氢钠
盐酸 √ √
氢氧化钠溶液 × √
分别写出各个反应的离子方程式
五、钠及其化合物的转化
一块金属钠长期暴露在空气中最终会转变为什么?
Na
Na2O/Na2O2
NaOH
NaCl
+O2
+H2O
+Cl2
+
H2O
+
HCl
+HCl
+HCl
Na2CO3
+CO2
NaHCO3
+CO2
+NaOH/
+CO2
六、深度思考
【深度思考】
1.
(1)向Na2CO3溶液、NaHCO3溶液中逐滴滴入稀盐酸并振荡。观察实验现象并解释原因?
(2)向盐酸中逐滴滴入Na2CO3溶液的现象呢?试用离子方程式及必要文字解释原因?
开始即有大量气泡,由于盐酸量多,直接发生CO32-+2H+=H2O+CO2↑
向Na2CO3溶液逐滴滴入稀盐酸过一会有大量气泡产生;向NaHCO3溶液逐滴滴入稀盐酸马上有大量气泡产生
(3)试着利用图像粗略描述上述两种情况,
Ⅰ.向Na2CO3溶液中逐滴滴入盐酸 Ⅱ.向盐酸中逐滴滴入Na2CO3溶液
【深度思考】
【深度思考】
2.(1)Na2CO3和NaHCO3相互转化的方法?
(2)能否用加Ba(OH)2的方法鉴别Na2CO3、NaHCO3溶液?
均有白色沉淀,所以不能鉴别。
NaHCO3
+CO2
Na2CO3
【深度思考】
3.如何鉴别碳酸钠和碳酸氢钠?
pH法:溶液碱性强的是碳酸钠
【深度思考】
4.碳酸钠和碳酸氢钠混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
碳酸钠固体(碳酸氢钠) 加热至恒重
碳酸氢钠溶液(碳酸钠) 通入足量二氧化碳气体
碳酸钠溶液(碳酸氢钠) 加入适量氢氧化钠溶液
七、科学拓展
八、焰色实验
(1) 定义
很多 在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验,是物理变化
金属或它们的化合物
(2) 操作
(3) 几种金属的焰色
九、课堂练习
1.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
A.均为钠盐 B.受热均易分解
C.焰色试验均为黄色 D.均能与盐酸反应
2.下列物质的溶液,能与小苏打溶液发生化学反应,既无气体生成也无沉淀生成的是( )
A.苏打 B.氯化氢 C.熟石灰 D.烧碱
B
D
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A.分别加热这两种固体物质,并将生成的气体通入澄清石灰水中
B.分别在这两种物质的溶液中,加入CaCl2溶液
C.分别把等质量的这两种固体物质加入同浓度的稀盐酸中
D.分别在这两种物质的溶液中,加入少量澄清石灰水
D
第一节 钠及其化合物
一、旧知回顾
化学式 俗名 用途
碳酸钠 Na2CO3 苏打、纯碱 纺织、制皂、造纸、制玻璃
碳酸氢钠 NaHCO3 小苏打 制药、焙制糕点
二、碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
①观察碳酸钠、碳酸氢钠的外观并进行描述
Na2CO3
NaHCO3
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
Na2CO3
NaHCO3
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象
Na2CO3
NaHCO3
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象
Na2CO3
NaHCO3
碳酸钠 碳酸氢钠
①观察碳酸钠、碳酸氢钠的外观并进行描述 白色粉末 细小的白色晶体
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加水后结块变成晶体,温度计示数升高 加水后部分溶解,温度计示数降低
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象 振荡一段时间后可溶解 固体量减少
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变红,溶液碱性较强 溶液变浅红,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均易溶于水,在水中的溶解度:Na2CO3>NaHCO3,Na2CO3溶于水放热,NaHCO3溶于水吸热,水溶液均显碱性,碱性:Na2CO3>NaHCO3 【实验2-4】
三、碳酸钠、碳酸氢钠热稳定性的实验探究
实验装置 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3很稳定,受热不易发生分解
澄清石灰水变浑浊 NaHCO3不稳定,受热容易分解
我不是胖,
是"知识"使我膨胀!
烤面包是怎么变得如此蓬松的?
思考
制作面团时,向其中加入了适量的小苏打,在烤制过程中,小苏打受热会分解产生CO2
四、碳酸钠、碳酸氢钠与酸、碱的反应
碳酸钠 碳酸氢钠
盐酸 √ √
氢氧化钠溶液 × √
分别写出各个反应的离子方程式
五、钠及其化合物的转化
一块金属钠长期暴露在空气中最终会转变为什么?
Na
Na2O/Na2O2
NaOH
NaCl
+O2
+H2O
+Cl2
+
H2O
+
HCl
+HCl
+HCl
Na2CO3
+CO2
NaHCO3
+CO2
+NaOH/
+CO2
六、深度思考
【深度思考】
1.
(1)向Na2CO3溶液、NaHCO3溶液中逐滴滴入稀盐酸并振荡。观察实验现象并解释原因?
(2)向盐酸中逐滴滴入Na2CO3溶液的现象呢?试用离子方程式及必要文字解释原因?
开始即有大量气泡,由于盐酸量多,直接发生CO32-+2H+=H2O+CO2↑
向Na2CO3溶液逐滴滴入稀盐酸过一会有大量气泡产生;向NaHCO3溶液逐滴滴入稀盐酸马上有大量气泡产生
(3)试着利用图像粗略描述上述两种情况,
Ⅰ.向Na2CO3溶液中逐滴滴入盐酸 Ⅱ.向盐酸中逐滴滴入Na2CO3溶液
【深度思考】
【深度思考】
2.(1)Na2CO3和NaHCO3相互转化的方法?
(2)能否用加Ba(OH)2的方法鉴别Na2CO3、NaHCO3溶液?
均有白色沉淀,所以不能鉴别。
NaHCO3
+CO2
Na2CO3
【深度思考】
3.如何鉴别碳酸钠和碳酸氢钠?
pH法:溶液碱性强的是碳酸钠
【深度思考】
4.碳酸钠和碳酸氢钠混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
碳酸钠固体(碳酸氢钠) 加热至恒重
碳酸氢钠溶液(碳酸钠) 通入足量二氧化碳气体
碳酸钠溶液(碳酸氢钠) 加入适量氢氧化钠溶液
七、科学拓展
八、焰色实验
(1) 定义
很多 在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验,是物理变化
金属或它们的化合物
(2) 操作
(3) 几种金属的焰色
九、课堂练习
1.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
A.均为钠盐 B.受热均易分解
C.焰色试验均为黄色 D.均能与盐酸反应
2.下列物质的溶液,能与小苏打溶液发生化学反应,既无气体生成也无沉淀生成的是( )
A.苏打 B.氯化氢 C.熟石灰 D.烧碱
B
D
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A.分别加热这两种固体物质,并将生成的气体通入澄清石灰水中
B.分别在这两种物质的溶液中,加入CaCl2溶液
C.分别把等质量的这两种固体物质加入同浓度的稀盐酸中
D.分别在这两种物质的溶液中,加入少量澄清石灰水
D
