2024-2025学年高一上学期化学人教版(2019)必修第一册1.1.3物质的转化课件(共25张PPT)
文档属性
| 名称 | 2024-2025学年高一上学期化学人教版(2019)必修第一册1.1.3物质的转化课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 755.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-12 19:19:44 | ||
图片预览






文档简介
(共25张PPT)
物质的转化
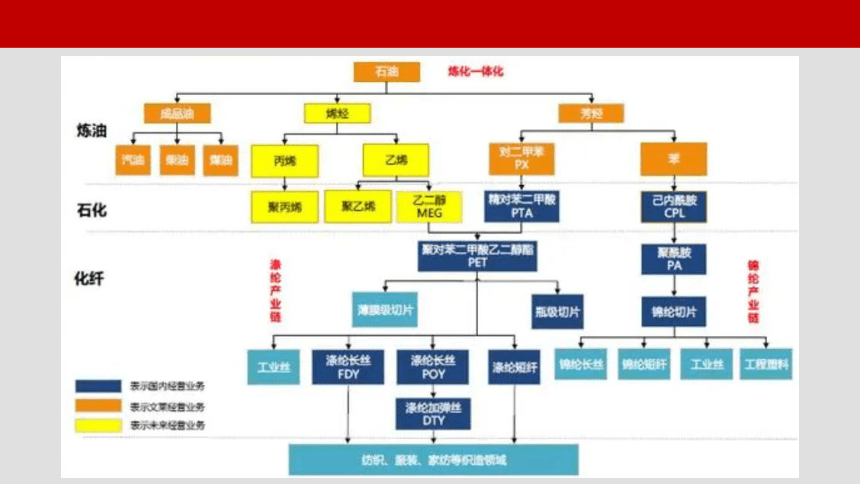
石油的华丽变身
归纳酸碱盐的性质
Task 1
(一)酸的通性
思考
什么是酸性?酸性从何而来?
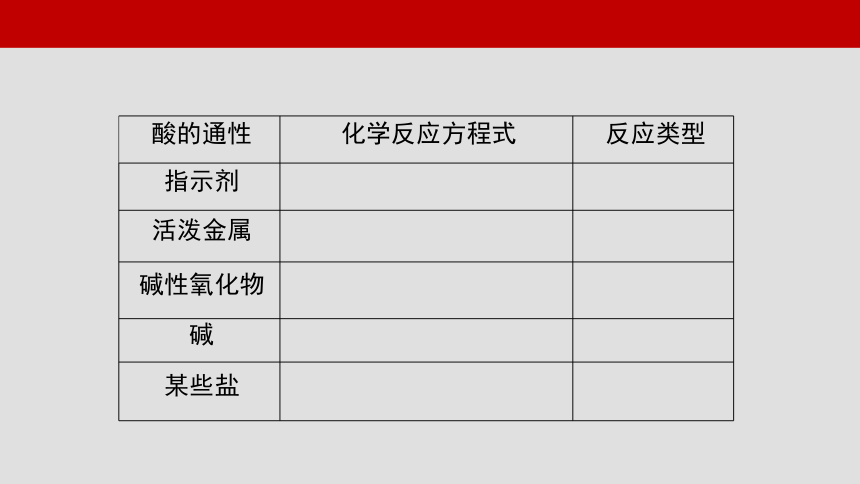
酸的通性 化学反应方程式 反应类型
指示剂
活泼金属
碱性氧化物
碱
某些盐
1.金属与酸反应
小结:活泼金属(H以前)与酸反应的本质是金属单质置换酸中的氢离子为氢气,反应前后伴随着化合价变化。
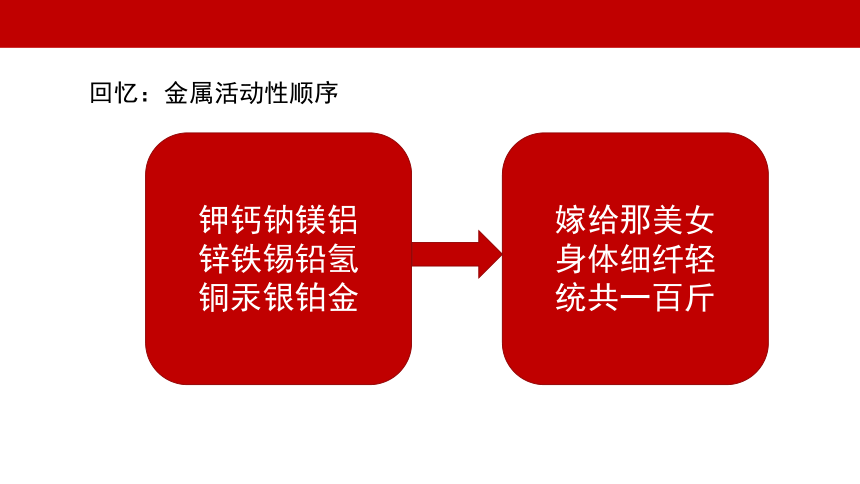
回忆:金属活动性顺序
嫁给那美女
身体细纤轻
统共一百斤
钾钙钠镁铝
锌铁锡铅氢
铜汞银铂金
2.金属氧化物与酸反应
小结:金属氧化物与酸反应通常生成对应的盐和水,一般地,反应前后无化合价变化。
拓展:已知Fe3O4可写成FeO·Fe2O3,试写出Fe3O4与盐酸反应的化学方程式。
3.碱与酸反应
4.酸与盐反应
注意:1.符合复分解反应的条件
2.强酸制弱酸
3.高沸点酸制低沸点酸
小结:
酸的性质取决于其所电离出的H+,可以认为H+表现出来的性质就是酸性。
(二)碱的通性
碱的通性 化学方程式 反应类型
指示剂
酸
酸性氧化物
某些盐
1.非金属氧化物与碱反应
思考:如果二氧化碳过量,会发生什么变化?
试写出SO3与NaOH溶液反应的化学方程式
2.碱与盐反应
碱与盐的反应通常遵循如下规律:
1.强碱制弱碱
2.参与反应的两种物质必须可溶入水
3.符合复分解反应条件
规律
小结:
碱的性质主要取决于其所电离的OH-,故可认为OH-所表现出来的性质即为碱性。
(三)盐的通性
盐的主要化学性质 反应的化学方程式 反应类型
与酸反应
与碱反应
与盐反应
金属与盐反应
小结:排在金属活动性顺序前面的金属常常可与排在金属活动性顺序后面的金属离子从其盐溶液中置换出来,伴随元素化合价的变化。
1.不同的酸或碱具有相似的化学性质,原因是 组成 上具有相似性。如不同的酸都含有 H+,不同的碱都含有 OH- 。同类物质化学反应类型相似。
2.根据反应物和生成物的类别和种类可分为 、
、 和 ;金属与酸的反应一般属于 ,酸与碱、盐与酸、盐与碱、盐与盐的反应一般属于 。
总结
(三)物质的转化
完成学案学习任务二
小结:单质到盐的转化关系是
非金属
非金属氧化物
酸
盐
金属
金属氧化物
碱
盐
复分解
复分解
1.试以铜为原料,制得硫酸铜。写出每一步反应的化学方程式并判断反应类型。
课堂练习
制备物质的思路确定
1.物质的组成与性质(不可无中生有)
2.物质间转化关系(能否发生)
2.试用三种方法制取NaOH。
(1)氧化钠和水反应制取: 。
(2)盐和碱生成新盐和新碱: 。
(3)电解饱和食盐水:2NaCl+2H2O=2NaOH+H2↑+Cl2↑。
比较三种方法的优劣,选择最适合的工业制备方法,总结选择最适当方法需要考虑哪些因素。
通电
总结:
制备物质需要考虑的因素有哪些?
1.反应是否易发生?
2.原料来源是否易得?
3.反应成本(转化率、原子利用率等)
4.反应条件、设备是否苛刻
5.无关物质是否容易除掉
物质的转化
石油的华丽变身
归纳酸碱盐的性质
Task 1
(一)酸的通性
思考
什么是酸性?酸性从何而来?
酸的通性 化学反应方程式 反应类型
指示剂
活泼金属
碱性氧化物
碱
某些盐
1.金属与酸反应
小结:活泼金属(H以前)与酸反应的本质是金属单质置换酸中的氢离子为氢气,反应前后伴随着化合价变化。
回忆:金属活动性顺序
嫁给那美女
身体细纤轻
统共一百斤
钾钙钠镁铝
锌铁锡铅氢
铜汞银铂金
2.金属氧化物与酸反应
小结:金属氧化物与酸反应通常生成对应的盐和水,一般地,反应前后无化合价变化。
拓展:已知Fe3O4可写成FeO·Fe2O3,试写出Fe3O4与盐酸反应的化学方程式。
3.碱与酸反应
4.酸与盐反应
注意:1.符合复分解反应的条件
2.强酸制弱酸
3.高沸点酸制低沸点酸
小结:
酸的性质取决于其所电离出的H+,可以认为H+表现出来的性质就是酸性。
(二)碱的通性
碱的通性 化学方程式 反应类型
指示剂
酸
酸性氧化物
某些盐
1.非金属氧化物与碱反应
思考:如果二氧化碳过量,会发生什么变化?
试写出SO3与NaOH溶液反应的化学方程式
2.碱与盐反应
碱与盐的反应通常遵循如下规律:
1.强碱制弱碱
2.参与反应的两种物质必须可溶入水
3.符合复分解反应条件
规律
小结:
碱的性质主要取决于其所电离的OH-,故可认为OH-所表现出来的性质即为碱性。
(三)盐的通性
盐的主要化学性质 反应的化学方程式 反应类型
与酸反应
与碱反应
与盐反应
金属与盐反应
小结:排在金属活动性顺序前面的金属常常可与排在金属活动性顺序后面的金属离子从其盐溶液中置换出来,伴随元素化合价的变化。
1.不同的酸或碱具有相似的化学性质,原因是 组成 上具有相似性。如不同的酸都含有 H+,不同的碱都含有 OH- 。同类物质化学反应类型相似。
2.根据反应物和生成物的类别和种类可分为 、
、 和 ;金属与酸的反应一般属于 ,酸与碱、盐与酸、盐与碱、盐与盐的反应一般属于 。
总结
(三)物质的转化
完成学案学习任务二
小结:单质到盐的转化关系是
非金属
非金属氧化物
酸
盐
金属
金属氧化物
碱
盐
复分解
复分解
1.试以铜为原料,制得硫酸铜。写出每一步反应的化学方程式并判断反应类型。
课堂练习
制备物质的思路确定
1.物质的组成与性质(不可无中生有)
2.物质间转化关系(能否发生)
2.试用三种方法制取NaOH。
(1)氧化钠和水反应制取: 。
(2)盐和碱生成新盐和新碱: 。
(3)电解饱和食盐水:2NaCl+2H2O=2NaOH+H2↑+Cl2↑。
比较三种方法的优劣,选择最适合的工业制备方法,总结选择最适当方法需要考虑哪些因素。
通电
总结:
制备物质需要考虑的因素有哪些?
1.反应是否易发生?
2.原料来源是否易得?
3.反应成本(转化率、原子利用率等)
4.反应条件、设备是否苛刻
5.无关物质是否容易除掉
