周周测三 第一章水和水的溶液(1.5-1.7)(含解析)
文档属性
| 名称 | 周周测三 第一章水和水的溶液(1.5-1.7)(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 600.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-09-13 23:41:35 | ||
图片预览



文档简介
周周测三 第一章水和水的溶液(1.5-1.7)
、选择题
生活中常见的下列标志中,属于节水标志的是( )
A. B. C. D.
水是生命之源,造成水体污染的主要原因是( )
A.未经处理的生活污水和工业污水直接排放到江河湖泊或海洋中
B.在农田中使用过量的农药化肥并且渗入土壤水和地下水中
C.任意堆放垃圾,经过雨水把有害的物质带入河水中
D.以上都是
目前从海水中提取食盐的方法主要是利用海水晒盐,它所利用的物质分离方法是( )
A.溶解法 B.过滤法 C.结晶法 D.蒸馏法
t℃时,向一支盛有0.1g熟石灰的试管内加入10mL水,充分振荡后,静置,试管底部仍有未溶解的白色固体。对于试管内上层澄清液体的叙述正确的是( )
A.溶液是t℃时的饱和溶液 B.升高温度溶液变为不饱和溶液
C.溶液中溶质的质量等于0.1g D.溶液中溶质的质量分数等于1%
水是世界上最宝贵的资源之一。今年世界水日宣传主题是“借自然之力,护绿水青山”。下列做法不符合这一主题的是( )
A.加强水资源的保护
B.推动世界各国对水资源进行综合性统筹规划和管理
C.大力推广工业用水循环利用的方式
D.大量开采地下水缓解水资源紧缺
为测定粗盐中氯化钠的质量分数,下列实验操作会使测得的结果偏大的是( )
A.食盐没有全部溶解就过滤 B.蒸发过程中晶体飞溅
C.蒸发所得的精盐较潮湿 D.蒸发皿中的精盐没有全部转移到称量纸上
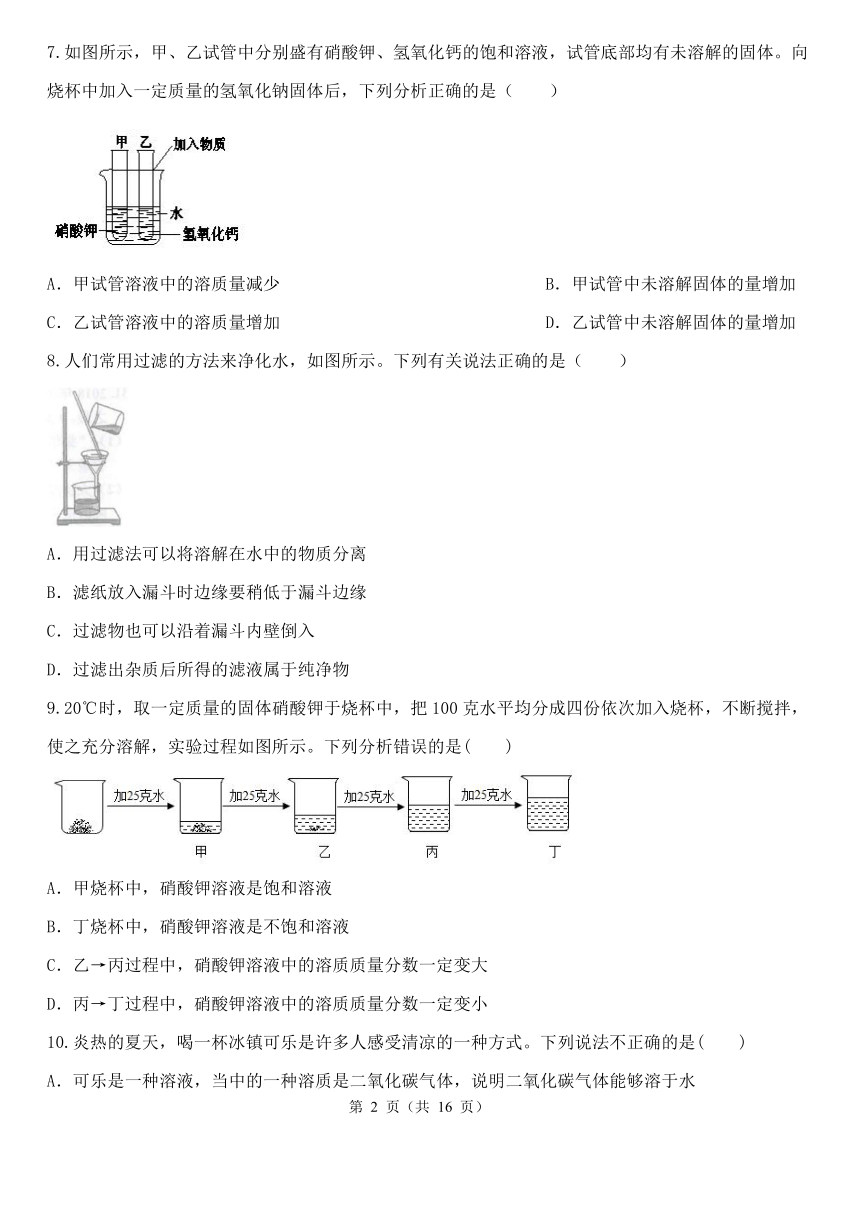
如图所示,甲、乙试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一定质量的氢氧化钠固体后,下列分析正确的是( )
A.甲试管溶液中的溶质量减少 B.甲试管中未溶解固体的量增加
C.乙试管溶液中的溶质量增加 D.乙试管中未溶解固体的量增加
人们常用过滤的方法来净化水,如图所示。下列有关说法正确的是( )
A.用过滤法可以将溶解在水中的物质分离
B.滤纸放入漏斗时边缘要稍低于漏斗边缘
C.过滤物也可以沿着漏斗内壁倒入
D.过滤出杂质后所得的滤液属于纯净物
20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析错误的是( )
A.甲烧杯中,硝酸钾溶液是饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液中的溶质质量分数一定变大
D.丙→丁过程中,硝酸钾溶液中的溶质质量分数一定变小
炎热的夏天,喝一杯冰镇可乐是许多人感受清凉的一种方式。下列说法不正确的是( )
A.可乐是一种溶液,当中的一种溶质是二氧化碳气体,说明二氧化碳气体能够溶于水
B.喝过可乐后,往往会打嗝,这是因为气体的溶解度随着温度的升高而降低
C.可乐里面除了二氧化碳气体外,还有其他溶质,这说明可乐是不饱和溶液
D.冰过的可乐比未冰过的可乐口感更好,说明气体的溶解度随着温度的降低而升高
、填空题
在南方,台风每年都会带来大风强降雨,造成很多道路积水严重,最深达到 2 米,造成经济损失严重。
(1)台风过后,河道里出现大量漂浮物,为清理河道,河道管理人员使用铁圈和塑料网做成的网兜(如图)来打捞河道漂浮物,这种方法最接近 。
A.沉淀 B.过滤 C.蒸馏 D.结晶
(2)受强台风影响,温州市某些沿海地方的水厂受淹,市民用水困难,为了解决缺水问题。暂时采用海水淡化技术,该技术(原理如图所示)采用对海水加压,海水中的溶剂分子可以通过半透膜,而溶质分子很难透过。海水淡化过程中,浓海水中溶质质量分数将 。
小金用20mL一次性注射器吸取10mL某碳酸饮料,并用胶头封闭注射器针孔,分别进行了如图实验。图Ⅰ中,用力向外拉动注射器,管中出现许多小气泡;图Ⅱ中,用力向里推注射器,小气泡减少。此实验可以说明气压变大,气体在水中的溶解度 (选填“变大”、“变小”或“不变)。气体的溶解度还受温度等因素的影响,请解释“一些工厂向河里排放热水,会造成河里的鱼因缺氧而死亡”的原因 。
从100毫升16℃时的硫酸铜饱和溶液中取出10毫升(温度不变)。下列关于这10毫升硫酸铜溶液的描述错误的是( )。
A.溶质的质量分数变小 B.溶质的质量分数不变
C.溶质是原溶液中溶质的 D.仍是16℃时的饱和溶液
地球拥有大量的水资源使得地球如此丰富多彩和充满生机。请回答下列有关水的问题:
(1)生物生存需要水,各种生物有特殊的“本领”使之能生活在不同的水环境中。猴面包树体内能贮存大量的水,所以这种树能生活在沙漠缺水环境中。请以仙人掌或骆驼为例说明这类生物能生活在沙漠中的特殊本领: 。
(2)地球上虽然存在大量的水,但可供人类使用的水资源并不多,我们要保护水资源。保护水资源的重要内容除了节约用水外,还有就是 。
(3)上图是电解水过程的微观模型,从中我们可以看出每一个水分子都是由 构成的。
如表是碳酸钠的溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)实验过程如图甲所示。当升温至60℃时,烧杯④中出现的现象是 。
(2)20℃时,将装有饱和碳酸钠溶液(底部有少量碳酸钠晶体)的小试管放入盛水的烧杯中,如图乙。若要使试管底部的晶体减少,可向烧杯中加入适量的 (选填“硝酸铵”或“氢氧化钠”)。
、实验探究题
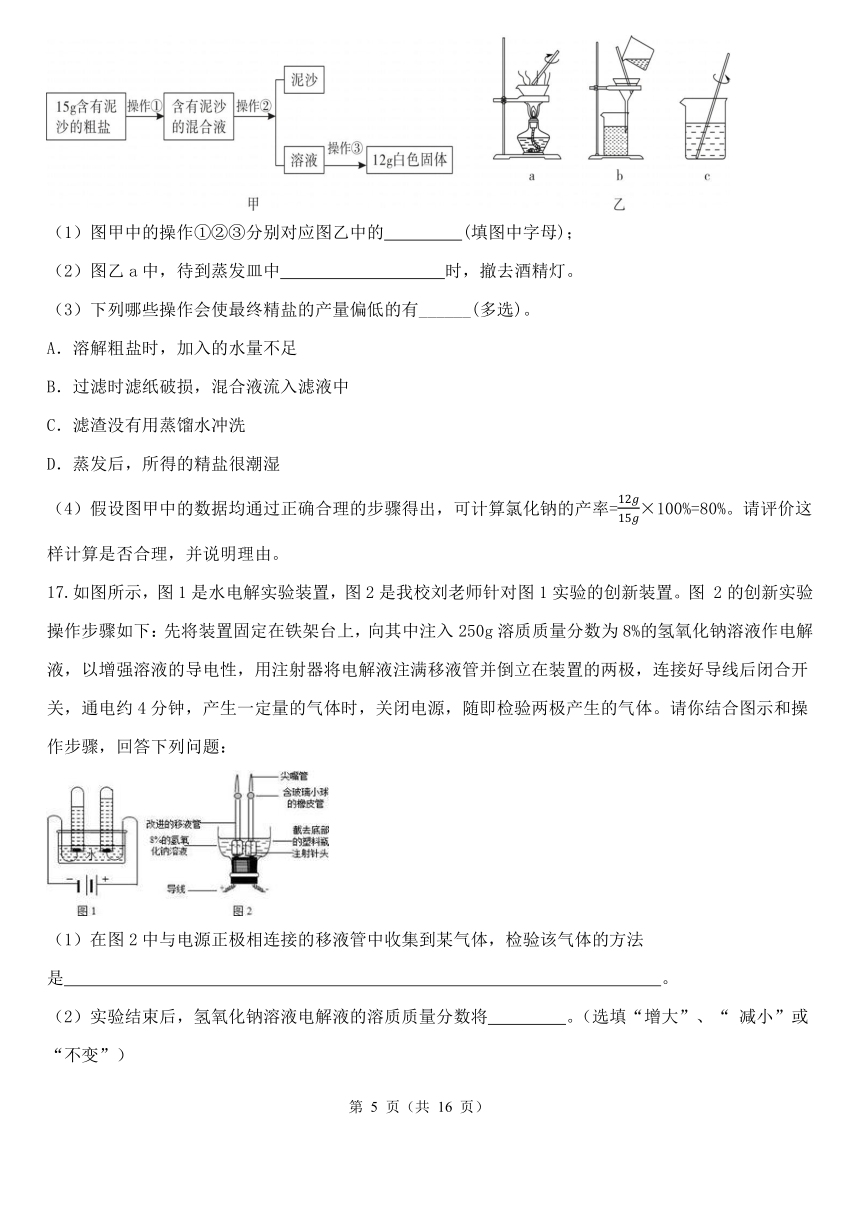
小科同学暑期去宁波象山游玩,来到了花岙岛的盐场。据说这里是浙江省最后一块传统盐场,这里的晒盐技术已传承1300多年。爱探索的小科同学从盐场带回粗盐样品,进行粗盐提纯实验,如下图:
(1)图甲中的操作①②③分别对应图乙中的 (填图中字母);
(2)图乙a中,待到蒸发皿中 时,撤去酒精灯。
(3)下列哪些操作会使最终精盐的产量偏低的有______(多选)。
A.溶解粗盐时,加入的水量不足
B.过滤时滤纸破损,混合液流入滤液中
C.滤渣没有用蒸馏水冲洗
D.蒸发后,所得的精盐很潮湿
(4)假设图甲中的数据均通过正确合理的步骤得出,可计算氯化钠的产率=×100%=80%。请评价这样计算是否合理,并说明理由。
如图所示,图1是水电解实验装置,图2是我校刘老师针对图1实验的创新装置。图 2的创新实验操作步骤如下:先将装置固定在铁架台上,向其中注入250g溶质质量分数为8%的氢氧化钠溶液作电解液,以增强溶液的导电性,用注射器将电解液注满移液管并倒立在装置的两极,连接好导线后闭合开关,通电约4分钟,产生一定量的气体时,关闭电源,随即检验两极产生的气体。请你结合图示和操作步骤,回答下列问题:
(1)在图2中与电源正极相连接的移液管中收集到某气体,检验该气体的方法是 。
(2)实验结束后,氢氧化钠溶液电解液的溶质质量分数将 。(选填“增大”、“ 减小”或“不变”)
(3)你认为图2的创新实验相对图1来说,所具备的优点有 。
A.实验时手不用直接接触有腐蚀性的电解液;
B.非常方便两极气体的检验;
C.所用实验器材都是用家里常见的物品改制而成
、解答题
“配置一定质量分数的溶液”是一个重要的实验,实验过程如下:
(1)现要配置5%的盐水200克,则应称取食盐 克。若在称量过程中,天平的指针出现了如图所示的情况,该如何处理?
A.取出一些食盐 B.增加砝码或向右移动游码
(2)一位同学最后所配溶液的质量分数小于5%,可能的原因是
A.食盐中含有杂质
B.将量筒中的水倒入烧杯时还有部分残留
C.砝码生锈
D.食盐还未溶解完
(3)现准备将这些盐水稀释为0.9%的生理盐水,需加多少水?(通过计算说明,结果保留一位小数。)
海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如氯化钠等。请思考回答下列问题
(1)已知某盐场测得①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用 (填序号)作原料。
(2)下图就是利用卤水原料提取氯化钠的大致过程
请计算125千克含氯化钠为8%的井水在蒸发池中蒸发形成浓度为20%时,需要蒸发水的质量。
可乐是青少年特别喜爱的一种饮料,但是可乐含糖量较高,经常饮用会引发肥胖,还有可能引起龋齿、糖尿病等。国际卫生组织建议人体每日摄入糖的量不应超过50克,已知一瓶500mL可乐含有54克糖,请根据材料回答问题。
(1)喝上几口冰镇可乐往往会打嗝,根据上图分析其主要原因是 。
(2)求500毫升可乐中糖的质量分数。(该可乐溶液的密度约为1g/cm3)
(3)可乐主要由糖水和碳酸水按一定比例混合而成。现用溶质质量分数为50%的糖水,配制含糖量10%的可乐300克,需用50%的糖水多少克?
周周测三 第一章水和水的溶液(1.5-1.7)答案解析
、选择题
C
【解析】分析各个选项中标志代表的意义即可。
A. 的意义是禁止明火,故A不合题意;
B. 的意义是可回收垃圾,故B不合题意;
C. 的意义是节约用水,故C符合题意;
D. 的意义是禁止鸣笛,故D不合题意。
故选C。
D
【解析】水资源的污染有工业污染、农业污染和生活污染三个部分;水资源污染是指让大量的污染物排放进入水体,超出了水体的自我净化能力,就会使水环境的生态平衡遭到破坏;
A. 未经处理的生活污水和工业污水直接排放到江河湖泊或海洋中,会造成水体污染;
B. 在农田中使用过量的农药化肥并且渗入土壤水和地下水中,会污染水体;
C. 在农田中使用过量的农药化肥并且渗入土壤水和地下水中 ,会污染水体;
D.以上都是,正确;
故答案为:D。
C
【解析】根据食盐的溶解度受温度变化的情况来解题。
食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,故选C。
A
【解析】(1)如果溶液内有未溶的物质出现,那么溶液饱和;
(2)氢氧化钙的溶解度随温度的升高而减小;
(3)溶质的质量=熟石灰的质量-未溶解的质量;
(4)根据溶质质量分数=计算即可。
A.因为出现未溶解的熟石灰,所以溶液是饱和的,故A正确;
B.升高温度氢氧化钙的溶解度变小,会有固体析出,当仍然饱和,故B错误;
C.因为有未溶的熟石灰,所以溶质的质量肯定小于0.1g,故C错误;
D.如果0.1g熟石灰全部溶解,那么溶质质量分数为:。由于溶质质量小于0.1g,所以溶质质量分数肯定小于1%,故D错误。
故选A.
D
【解析】保护水资源就是保护人类自己,保护水资源主要从两个方面做起:一是节约用水,二是防止水污染,据此分析解答。
A.加强水资源的保护,符合“借自然之力,护绿水青山”,故A不符合题意;
B、推动世界各国对水资源进行综合性统筹规划和管理,符合“借自然之力,护绿水青山”,故B不符合题意;
C、大力推广工业用水循环利用的方式既可以节约用水,又可以防止水体污染,符合“借自然之力,护绿水青山”,故C不符合题意;
D、大量开采地下水缓解水资源紧缺,会造成地面下沉,造成水资源的枯竭,不符合“借自然之力,护绿水青山”,故D不符合题意;
故答案为:D。
C
【解析】根据质量分数=可知,氯化钠质量分数偏大,无非就是测量得到的氯化钠的质量偏大,据此分析判断。
A.食盐没有全部溶解就过滤,那么得到氯化钠的质量会偏小,故A不合题意;
B.蒸发过程中晶体飞溅,会使最终得到的氯化钠的质量偏小,故B不合题意;
C.蒸发所得的精盐较潮湿,那么测得氯化钠的质量就包括水的质量,因此会偏大,故C符合题意;
D.蒸发皿中的精盐没有全部转移到称量纸上,那么测得的氯化钠的质量偏小,故D不合题意。
D
【解析】根据物质溶解度随温度的变化规律分析判断。
向烧杯中加入氢氧化钠固体后,会放出热量,使溶液温度升高。硝酸钾的溶解度随温度的升高而增大,因此试管底部的晶体会溶解,则甲试管里溶液质量增大。而氢氧化钙的溶解度随温度的升高而减小,那么会析出晶体,则乙试管溶液质量减小,故D正确,而A.B、C错误。
故选D。
B
【解析】根据过滤操作的注意事项来分析。
A过滤是分离不溶性固体和液体的方法,不能除去水中的可溶性物质以及细菌微生物,错误;
B在过滤时,滤纸会吸收滤液。湿了的滤纸就会变软。如果滤纸高于漏斗的边缘,滤纸就会变形,不能紧贴漏斗的同时还会使滤液渗出,造成滤液损失,正确;
C如果过滤物沿着漏斗内壁倒入,就起不到过滤的效果,错误;
D只有蒸馏水才是纯净物,所以滤液是混合物,错误。
故答案为:B
C
【解析】(1)(2)如果溶液中存在未溶的固体,那么溶液肯定饱和;如果没有未溶的固体,那么溶液无法判断是否饱和;
(3)在相同温度下,同种物质的饱和溶液的溶质质量分数肯定大于不饱和溶液的溶质质量分数;
(4)溶质质量分数=。A.从图可以看出,20℃时,甲烧杯中还有未溶解的硝酸钾固体,所以甲烧杯中硝酸钾溶液是饱和溶液,故A正确不合题意;
B.从图可以看出,20℃时,丙烧杯中没有未溶解的硝酸钾固体,所以丙烧杯中,硝酸钾溶液可能是饱和溶液,也可能是不饱和溶液,在此基础中继续加水得到丁溶液,溶剂增多,所以丁烧杯中,硝酸钾溶液是不饱和溶液,故B正确不合题意;
C.乙烧杯中是硝酸钾的饱和溶液,所以溶质质量分数最大,乙→丙过程中,故硝酸钾溶液的溶质质量分数不变或变小,故C错误符合题意;
D.丙→丁过程中,继续加入溶剂,溶质质量不变,所以硝酸钾溶液的溶质质量分数变小,故D正确不合题意。
故选C。
C
【解析】(1)根据二氧化碳的物理性质分析;
(2)根据气体的溶解度和温度的关系分析;
(3)如果溶液中有溶质析出,那么它肯定是饱和溶液;
(4)可乐的口感由溶解的二氧化碳的多少决定。A.可乐是由水、二氧化碳和蔗糖等组成的混合物,因此它是溶液,说明二氧化碳气体能够溶于水,故A正确不合题意;
B.气体的溶解度随着温度的升高而降低,所以可乐喝到肚子里面后,人过会会打嗝,故B正确不合题意;
C.打开可乐后,其中的二氧化碳气体冒出,这说明可乐是二氧化碳的饱和溶液,故C错误符合题意;
D.气体的溶解度随着温度的降低而升高,因此冰过的可乐可以溶解更多二氧化碳,因此冰过的可乐比不冰过的可乐口感更好,故D正确不合题意。
故选C。
、填空题
(1)B
(2)变大
【解析】(1)过滤是分离不溶性物质与液体的方法;
(2)海水中的水通过半透膜,则海水中的溶剂减少,但溶质质量不变,则溶液质质量分数增大。
(1)河道管理人员使用网兜打捞河道漂浮物的方法最接近过滤,故选B;
(2)海水淡化时,对海水加压,水分子通过半透膜,而溶质分子很能透过,则可认为原溶液的溶剂质量减少,溶质质量不变,则浓海水的溶质质量分数变大;
故答案为:(1)B;(2)变大。
变大;热水使河水温度升高,氧气的溶解能力降低,河水中含氧量低,鱼类因缺氧而死亡
【解析】(1)如果有气泡产生,说明有气体溢出,即气体的溶解度减小;如果气泡减少,说明气体溶解,即气体的溶解度增大;
(2)根据气体的溶解度随温度的升高而减小分析排放热水后水中氧气的溶解度变化即可。
(1)小金用20mL一次性注射器吸取10mL某碳酸饮料,并用胶头封闭注射器针孔,分别进行了如图实验。图Ⅰ中,用力向外拉动注射器,管中出现许多小气泡;图Ⅱ中,用力向里推注射器,小气泡减少。此实验可以说明气压变大,气体在水中的溶解度变大。
(2)“一些工厂向河里排放热水,会造成河里的鱼因缺氧而死亡”的原因:热水使河水温度升高,氧气的溶解能力降低,河水中含氧量低,鱼类因缺氧而死亡。
A
【解析】AB.当物质的溶解度不变时,饱和溶液的溶质质量分数不变;
C.根据质量和体积的关系判断;
D.根据溶解度的影响因素判断。
ABC.硫酸铜溶液的温度保持不变,则溶解度不变,那么饱和溶液的溶质质量分数不变,故A错误符合题意,B、D正确不合题意;
C.根据题意可知,硫酸铜溶液的溶质质量分数不变,因为10毫升是100毫升的,所以溶质质量也是原来溶质质量的,故C正确不合题意。
故选A.
(1)仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小
(2)防止水污染
(3)1 个氧原子和 2 个氢原子
【解析】(1)仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小;骆驼的两个驼峰能够储藏很多水分;
(2)保护水资源包括两个方面:①节约用水;②防止水污染;
(3)分子由原子构成。
(1) 以仙人掌或骆驼为例说明这类生物能生活在沙漠中的特殊本领:仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小。骆驼的两个驼峰能够储藏很多水分)
(2) 保护水资源的重要内容除了节约用水外,还有就是防止水污染 ;
(3)上图是电解水过程的微观模型,从中我们可以看出每一个水分子都是由 1 个氧原子和 2 个氢原子 构成的。
(1)有晶体析出
(2)氢氧化钠
【解析】(1)根据表格确定碳酸钠溶解度的变化,进而推测出现的现象。
(2)要使晶体减少,就要增大碳酸钠的溶解度,根据表格数据确定溶液的温度变化,最后结合物质溶解时吸热还是放热的知识解答。
(1)根据表格数据可知,当升温到60℃时,碳酸钠的溶解度为46.4g小于47g,那么烧杯④中出现的现象:有晶体析出。
(2)根据表格数据可知,要使试管中的晶体减少,就要升高温度。硝酸铵溶于水时吸热,导致溶液温度降低;氢氧化钠溶于水时放热,导致温度升高,因此应该加入适量的氢氧化钠。
、实验探究题
(1)cba
(2)有大量晶体析出
(3)A;C
(4)不合理,最终得到的白色固体仍是混合物,不是纯净的氯化钠
【解析】粗盐提纯的步骤:溶解、过滤、蒸发结晶
(1)操作①是溶解,故对应的是c,操作②是过滤,对应的是b,操作③是蒸发结晶,对应的是a,故填cba
(2)蒸发结晶时为了防止固体飞溅,待到蒸发皿中有大量晶体析出时,撤去酒精灯,用余温将剩余的水分蒸干
(3)A. 加入的水量不足会导致粗盐中的氯化钠不能完全溶解,会使产量偏低,A正确
B. 过滤时滤纸破损,会导致得到的细盐中含有杂质,对产量没有影响,B错误
C. 滤渣上会残留食盐溶液,因此没有用蒸馏水冲洗会使残留在滤渣表面的食盐没被蒸发出来,产量会偏低,C正确
D. 蒸发后,所得的精盐很潮湿,只是水分没有蒸干,对产量没有影响,D错误
故选A C
(4)粗盐中除了氯化钠和泥沙杂质之外还有一些可溶性的杂质,甲步骤中只除去了不溶性的泥沙杂质,并未除去可溶性杂质,因此最终得到的12g白色固体中还有气体物质,不是纯净的氯化钠
故答案为(1)cba (2)有大量晶体析出 (3)A C (4) 不合理,最终得到的白色固体仍是混合物,不是纯净的氯化钠
(1)用带火星木条放在尖嘴管口,捏动橡皮管放出气体,若木条复燃则是氧气
(2)增大
(3)A;B;C
【解析】(1)在电解水的实验中,与正极相连的试管产生氧气,与负极相连的试管产生氢气;氧气能够使带火星的小木条复燃;
(2)电解水产生氢气和氧气,那么水的质量会减小,而溶质氢氧化钠的质量保持不变,根据公式溶质质量分数=可知,氢氧化钠溶液的溶质质量分数增大;
(3)可以从实验操作的安全性、气体的检验和器材的获取容易程度方面思考改进装置的优点。
(1)在图2中,电源正极相连接的移液管中收集的是氧气,检验氧气的方法为:用带火星木条放在尖嘴管口,捏动橡皮管放出气体,若木条复燃则是氧气;
(2)实验结束后,氢氧化钠溶液电解液的溶质质量分数将增大;
(3)A.实验时手不用直接接触有腐蚀性的电解液,是实验操作更安全,故A符合题意;
B.非常方便两极气体的检验,故B符合题意;
C.所用实验器材都是用家里常见的物品改制而成,简单易得,故C符合题意。
故选ABC。
、解答题
(1)10g;A
(2)A;D
(3) 释为0.9%的生理盐水的质量为:10g÷0.9%≈1111.1g;
需要加水的质量:1111.1g-200g=911.1g。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数计算出食盐的质量;在定量的称量药品时,天平右盘的砝码和游码不能动,只能通过调节左盘药品的质量让天平实现平衡;
(2)根据溶质质量分数=可知,溶质的质量分数偏小的原因:①溶质食盐的质量偏小;②溶剂水的质量偏大;
(3)首先根据公式溶液质量=计算出稀释后食盐水的质量,然后减去原来食盐水的质量就是加水的质量。
(1)应称取食盐的质量:200g×5%=10g;在称量过程中,天平指针偏左,说明左盘食盐的质量偏大,因此接下来应该取出一些食盐,故选A;
(2)A.食盐中含有杂质,那么溶质的质量偏小,故A正确;
B.将量筒中的水倒入烧杯时还有部分残留,会使溶液中水的质量偏小,溶质质量分数偏大,故B错误;
C.砝码生锈,称取食盐的质量偏大,故C错误;
D.食盐还未溶解完,那么溶质的质量偏小,故D正确。
故选AD。
(3)稀释为0.9%的生理盐水的质量为:10g÷0.9%≈1111.1g;
需要加水的质量:1111.1g-200g=911.1g。
(1)②
(2)125kg×8%=(125kg-m)×20%,解得m=75kg。
【解析】(1)粗盐提纯需要经过溶解、过滤、蒸发、结晶等过程。
(2)蒸发浓缩问题中,可以根据溶质质量不变列式。
(1)晒盐的目的是提取溶液中的溶质,因此选用溶质质量分数较大的②更为合适。
(1)人体内温度较高,二氧化碳的溶解度随温度的上升而下降,二氧化碳析出
(2)m可乐=500mL×1g/cm3=500g
糖的质量分数是=54g/500g ×100%=10.8%
(3)50%x=300g×10%,x=60g
【解析】(1)可乐里面含有大量的二氧化碳气体,根据气体的溶解度随温度的变化规律分析解答;
(2)首先根据m=ρV计算出500mL可乐的质量,再根据溶质质量分数=计算;
(3)配制前后糖的质量保持不变,以此为等量条件根据溶质质量=溶液质量×溶质质量分数列出方程,计算即可。
(1)喝上几口冰镇可乐往往会打嗝,其主要原因是:人体内温度较高,二氧化碳的溶解度随温度的上升而下降,二氧化碳析出;
(2)500mL可乐的质量: m可乐=ρV=500mL×1g/cm3=500g;
糖的质量分数是:。
(3)设需要50%的糖水质量为x,
50%x=300g×10%;
解得:x=60g。
第 1 页(共 1 页)
、选择题
生活中常见的下列标志中,属于节水标志的是( )
A. B. C. D.
水是生命之源,造成水体污染的主要原因是( )
A.未经处理的生活污水和工业污水直接排放到江河湖泊或海洋中
B.在农田中使用过量的农药化肥并且渗入土壤水和地下水中
C.任意堆放垃圾,经过雨水把有害的物质带入河水中
D.以上都是
目前从海水中提取食盐的方法主要是利用海水晒盐,它所利用的物质分离方法是( )
A.溶解法 B.过滤法 C.结晶法 D.蒸馏法
t℃时,向一支盛有0.1g熟石灰的试管内加入10mL水,充分振荡后,静置,试管底部仍有未溶解的白色固体。对于试管内上层澄清液体的叙述正确的是( )
A.溶液是t℃时的饱和溶液 B.升高温度溶液变为不饱和溶液
C.溶液中溶质的质量等于0.1g D.溶液中溶质的质量分数等于1%
水是世界上最宝贵的资源之一。今年世界水日宣传主题是“借自然之力,护绿水青山”。下列做法不符合这一主题的是( )
A.加强水资源的保护
B.推动世界各国对水资源进行综合性统筹规划和管理
C.大力推广工业用水循环利用的方式
D.大量开采地下水缓解水资源紧缺
为测定粗盐中氯化钠的质量分数,下列实验操作会使测得的结果偏大的是( )
A.食盐没有全部溶解就过滤 B.蒸发过程中晶体飞溅
C.蒸发所得的精盐较潮湿 D.蒸发皿中的精盐没有全部转移到称量纸上
如图所示,甲、乙试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一定质量的氢氧化钠固体后,下列分析正确的是( )
A.甲试管溶液中的溶质量减少 B.甲试管中未溶解固体的量增加
C.乙试管溶液中的溶质量增加 D.乙试管中未溶解固体的量增加
人们常用过滤的方法来净化水,如图所示。下列有关说法正确的是( )
A.用过滤法可以将溶解在水中的物质分离
B.滤纸放入漏斗时边缘要稍低于漏斗边缘
C.过滤物也可以沿着漏斗内壁倒入
D.过滤出杂质后所得的滤液属于纯净物
20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析错误的是( )
A.甲烧杯中,硝酸钾溶液是饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液中的溶质质量分数一定变大
D.丙→丁过程中,硝酸钾溶液中的溶质质量分数一定变小
炎热的夏天,喝一杯冰镇可乐是许多人感受清凉的一种方式。下列说法不正确的是( )
A.可乐是一种溶液,当中的一种溶质是二氧化碳气体,说明二氧化碳气体能够溶于水
B.喝过可乐后,往往会打嗝,这是因为气体的溶解度随着温度的升高而降低
C.可乐里面除了二氧化碳气体外,还有其他溶质,这说明可乐是不饱和溶液
D.冰过的可乐比未冰过的可乐口感更好,说明气体的溶解度随着温度的降低而升高
、填空题
在南方,台风每年都会带来大风强降雨,造成很多道路积水严重,最深达到 2 米,造成经济损失严重。
(1)台风过后,河道里出现大量漂浮物,为清理河道,河道管理人员使用铁圈和塑料网做成的网兜(如图)来打捞河道漂浮物,这种方法最接近 。
A.沉淀 B.过滤 C.蒸馏 D.结晶
(2)受强台风影响,温州市某些沿海地方的水厂受淹,市民用水困难,为了解决缺水问题。暂时采用海水淡化技术,该技术(原理如图所示)采用对海水加压,海水中的溶剂分子可以通过半透膜,而溶质分子很难透过。海水淡化过程中,浓海水中溶质质量分数将 。
小金用20mL一次性注射器吸取10mL某碳酸饮料,并用胶头封闭注射器针孔,分别进行了如图实验。图Ⅰ中,用力向外拉动注射器,管中出现许多小气泡;图Ⅱ中,用力向里推注射器,小气泡减少。此实验可以说明气压变大,气体在水中的溶解度 (选填“变大”、“变小”或“不变)。气体的溶解度还受温度等因素的影响,请解释“一些工厂向河里排放热水,会造成河里的鱼因缺氧而死亡”的原因 。
从100毫升16℃时的硫酸铜饱和溶液中取出10毫升(温度不变)。下列关于这10毫升硫酸铜溶液的描述错误的是( )。
A.溶质的质量分数变小 B.溶质的质量分数不变
C.溶质是原溶液中溶质的 D.仍是16℃时的饱和溶液
地球拥有大量的水资源使得地球如此丰富多彩和充满生机。请回答下列有关水的问题:
(1)生物生存需要水,各种生物有特殊的“本领”使之能生活在不同的水环境中。猴面包树体内能贮存大量的水,所以这种树能生活在沙漠缺水环境中。请以仙人掌或骆驼为例说明这类生物能生活在沙漠中的特殊本领: 。
(2)地球上虽然存在大量的水,但可供人类使用的水资源并不多,我们要保护水资源。保护水资源的重要内容除了节约用水外,还有就是 。
(3)上图是电解水过程的微观模型,从中我们可以看出每一个水分子都是由 构成的。
如表是碳酸钠的溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)实验过程如图甲所示。当升温至60℃时,烧杯④中出现的现象是 。
(2)20℃时,将装有饱和碳酸钠溶液(底部有少量碳酸钠晶体)的小试管放入盛水的烧杯中,如图乙。若要使试管底部的晶体减少,可向烧杯中加入适量的 (选填“硝酸铵”或“氢氧化钠”)。
、实验探究题
小科同学暑期去宁波象山游玩,来到了花岙岛的盐场。据说这里是浙江省最后一块传统盐场,这里的晒盐技术已传承1300多年。爱探索的小科同学从盐场带回粗盐样品,进行粗盐提纯实验,如下图:
(1)图甲中的操作①②③分别对应图乙中的 (填图中字母);
(2)图乙a中,待到蒸发皿中 时,撤去酒精灯。
(3)下列哪些操作会使最终精盐的产量偏低的有______(多选)。
A.溶解粗盐时,加入的水量不足
B.过滤时滤纸破损,混合液流入滤液中
C.滤渣没有用蒸馏水冲洗
D.蒸发后,所得的精盐很潮湿
(4)假设图甲中的数据均通过正确合理的步骤得出,可计算氯化钠的产率=×100%=80%。请评价这样计算是否合理,并说明理由。
如图所示,图1是水电解实验装置,图2是我校刘老师针对图1实验的创新装置。图 2的创新实验操作步骤如下:先将装置固定在铁架台上,向其中注入250g溶质质量分数为8%的氢氧化钠溶液作电解液,以增强溶液的导电性,用注射器将电解液注满移液管并倒立在装置的两极,连接好导线后闭合开关,通电约4分钟,产生一定量的气体时,关闭电源,随即检验两极产生的气体。请你结合图示和操作步骤,回答下列问题:
(1)在图2中与电源正极相连接的移液管中收集到某气体,检验该气体的方法是 。
(2)实验结束后,氢氧化钠溶液电解液的溶质质量分数将 。(选填“增大”、“ 减小”或“不变”)
(3)你认为图2的创新实验相对图1来说,所具备的优点有 。
A.实验时手不用直接接触有腐蚀性的电解液;
B.非常方便两极气体的检验;
C.所用实验器材都是用家里常见的物品改制而成
、解答题
“配置一定质量分数的溶液”是一个重要的实验,实验过程如下:
(1)现要配置5%的盐水200克,则应称取食盐 克。若在称量过程中,天平的指针出现了如图所示的情况,该如何处理?
A.取出一些食盐 B.增加砝码或向右移动游码
(2)一位同学最后所配溶液的质量分数小于5%,可能的原因是
A.食盐中含有杂质
B.将量筒中的水倒入烧杯时还有部分残留
C.砝码生锈
D.食盐还未溶解完
(3)现准备将这些盐水稀释为0.9%的生理盐水,需加多少水?(通过计算说明,结果保留一位小数。)
海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如氯化钠等。请思考回答下列问题
(1)已知某盐场测得①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用 (填序号)作原料。
(2)下图就是利用卤水原料提取氯化钠的大致过程
请计算125千克含氯化钠为8%的井水在蒸发池中蒸发形成浓度为20%时,需要蒸发水的质量。
可乐是青少年特别喜爱的一种饮料,但是可乐含糖量较高,经常饮用会引发肥胖,还有可能引起龋齿、糖尿病等。国际卫生组织建议人体每日摄入糖的量不应超过50克,已知一瓶500mL可乐含有54克糖,请根据材料回答问题。
(1)喝上几口冰镇可乐往往会打嗝,根据上图分析其主要原因是 。
(2)求500毫升可乐中糖的质量分数。(该可乐溶液的密度约为1g/cm3)
(3)可乐主要由糖水和碳酸水按一定比例混合而成。现用溶质质量分数为50%的糖水,配制含糖量10%的可乐300克,需用50%的糖水多少克?
周周测三 第一章水和水的溶液(1.5-1.7)答案解析
、选择题
C
【解析】分析各个选项中标志代表的意义即可。
A. 的意义是禁止明火,故A不合题意;
B. 的意义是可回收垃圾,故B不合题意;
C. 的意义是节约用水,故C符合题意;
D. 的意义是禁止鸣笛,故D不合题意。
故选C。
D
【解析】水资源的污染有工业污染、农业污染和生活污染三个部分;水资源污染是指让大量的污染物排放进入水体,超出了水体的自我净化能力,就会使水环境的生态平衡遭到破坏;
A. 未经处理的生活污水和工业污水直接排放到江河湖泊或海洋中,会造成水体污染;
B. 在农田中使用过量的农药化肥并且渗入土壤水和地下水中,会污染水体;
C. 在农田中使用过量的农药化肥并且渗入土壤水和地下水中 ,会污染水体;
D.以上都是,正确;
故答案为:D。
C
【解析】根据食盐的溶解度受温度变化的情况来解题。
食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,故选C。
A
【解析】(1)如果溶液内有未溶的物质出现,那么溶液饱和;
(2)氢氧化钙的溶解度随温度的升高而减小;
(3)溶质的质量=熟石灰的质量-未溶解的质量;
(4)根据溶质质量分数=计算即可。
A.因为出现未溶解的熟石灰,所以溶液是饱和的,故A正确;
B.升高温度氢氧化钙的溶解度变小,会有固体析出,当仍然饱和,故B错误;
C.因为有未溶的熟石灰,所以溶质的质量肯定小于0.1g,故C错误;
D.如果0.1g熟石灰全部溶解,那么溶质质量分数为:。由于溶质质量小于0.1g,所以溶质质量分数肯定小于1%,故D错误。
故选A.
D
【解析】保护水资源就是保护人类自己,保护水资源主要从两个方面做起:一是节约用水,二是防止水污染,据此分析解答。
A.加强水资源的保护,符合“借自然之力,护绿水青山”,故A不符合题意;
B、推动世界各国对水资源进行综合性统筹规划和管理,符合“借自然之力,护绿水青山”,故B不符合题意;
C、大力推广工业用水循环利用的方式既可以节约用水,又可以防止水体污染,符合“借自然之力,护绿水青山”,故C不符合题意;
D、大量开采地下水缓解水资源紧缺,会造成地面下沉,造成水资源的枯竭,不符合“借自然之力,护绿水青山”,故D不符合题意;
故答案为:D。
C
【解析】根据质量分数=可知,氯化钠质量分数偏大,无非就是测量得到的氯化钠的质量偏大,据此分析判断。
A.食盐没有全部溶解就过滤,那么得到氯化钠的质量会偏小,故A不合题意;
B.蒸发过程中晶体飞溅,会使最终得到的氯化钠的质量偏小,故B不合题意;
C.蒸发所得的精盐较潮湿,那么测得氯化钠的质量就包括水的质量,因此会偏大,故C符合题意;
D.蒸发皿中的精盐没有全部转移到称量纸上,那么测得的氯化钠的质量偏小,故D不合题意。
D
【解析】根据物质溶解度随温度的变化规律分析判断。
向烧杯中加入氢氧化钠固体后,会放出热量,使溶液温度升高。硝酸钾的溶解度随温度的升高而增大,因此试管底部的晶体会溶解,则甲试管里溶液质量增大。而氢氧化钙的溶解度随温度的升高而减小,那么会析出晶体,则乙试管溶液质量减小,故D正确,而A.B、C错误。
故选D。
B
【解析】根据过滤操作的注意事项来分析。
A过滤是分离不溶性固体和液体的方法,不能除去水中的可溶性物质以及细菌微生物,错误;
B在过滤时,滤纸会吸收滤液。湿了的滤纸就会变软。如果滤纸高于漏斗的边缘,滤纸就会变形,不能紧贴漏斗的同时还会使滤液渗出,造成滤液损失,正确;
C如果过滤物沿着漏斗内壁倒入,就起不到过滤的效果,错误;
D只有蒸馏水才是纯净物,所以滤液是混合物,错误。
故答案为:B
C
【解析】(1)(2)如果溶液中存在未溶的固体,那么溶液肯定饱和;如果没有未溶的固体,那么溶液无法判断是否饱和;
(3)在相同温度下,同种物质的饱和溶液的溶质质量分数肯定大于不饱和溶液的溶质质量分数;
(4)溶质质量分数=。A.从图可以看出,20℃时,甲烧杯中还有未溶解的硝酸钾固体,所以甲烧杯中硝酸钾溶液是饱和溶液,故A正确不合题意;
B.从图可以看出,20℃时,丙烧杯中没有未溶解的硝酸钾固体,所以丙烧杯中,硝酸钾溶液可能是饱和溶液,也可能是不饱和溶液,在此基础中继续加水得到丁溶液,溶剂增多,所以丁烧杯中,硝酸钾溶液是不饱和溶液,故B正确不合题意;
C.乙烧杯中是硝酸钾的饱和溶液,所以溶质质量分数最大,乙→丙过程中,故硝酸钾溶液的溶质质量分数不变或变小,故C错误符合题意;
D.丙→丁过程中,继续加入溶剂,溶质质量不变,所以硝酸钾溶液的溶质质量分数变小,故D正确不合题意。
故选C。
C
【解析】(1)根据二氧化碳的物理性质分析;
(2)根据气体的溶解度和温度的关系分析;
(3)如果溶液中有溶质析出,那么它肯定是饱和溶液;
(4)可乐的口感由溶解的二氧化碳的多少决定。A.可乐是由水、二氧化碳和蔗糖等组成的混合物,因此它是溶液,说明二氧化碳气体能够溶于水,故A正确不合题意;
B.气体的溶解度随着温度的升高而降低,所以可乐喝到肚子里面后,人过会会打嗝,故B正确不合题意;
C.打开可乐后,其中的二氧化碳气体冒出,这说明可乐是二氧化碳的饱和溶液,故C错误符合题意;
D.气体的溶解度随着温度的降低而升高,因此冰过的可乐可以溶解更多二氧化碳,因此冰过的可乐比不冰过的可乐口感更好,故D正确不合题意。
故选C。
、填空题
(1)B
(2)变大
【解析】(1)过滤是分离不溶性物质与液体的方法;
(2)海水中的水通过半透膜,则海水中的溶剂减少,但溶质质量不变,则溶液质质量分数增大。
(1)河道管理人员使用网兜打捞河道漂浮物的方法最接近过滤,故选B;
(2)海水淡化时,对海水加压,水分子通过半透膜,而溶质分子很能透过,则可认为原溶液的溶剂质量减少,溶质质量不变,则浓海水的溶质质量分数变大;
故答案为:(1)B;(2)变大。
变大;热水使河水温度升高,氧气的溶解能力降低,河水中含氧量低,鱼类因缺氧而死亡
【解析】(1)如果有气泡产生,说明有气体溢出,即气体的溶解度减小;如果气泡减少,说明气体溶解,即气体的溶解度增大;
(2)根据气体的溶解度随温度的升高而减小分析排放热水后水中氧气的溶解度变化即可。
(1)小金用20mL一次性注射器吸取10mL某碳酸饮料,并用胶头封闭注射器针孔,分别进行了如图实验。图Ⅰ中,用力向外拉动注射器,管中出现许多小气泡;图Ⅱ中,用力向里推注射器,小气泡减少。此实验可以说明气压变大,气体在水中的溶解度变大。
(2)“一些工厂向河里排放热水,会造成河里的鱼因缺氧而死亡”的原因:热水使河水温度升高,氧气的溶解能力降低,河水中含氧量低,鱼类因缺氧而死亡。
A
【解析】AB.当物质的溶解度不变时,饱和溶液的溶质质量分数不变;
C.根据质量和体积的关系判断;
D.根据溶解度的影响因素判断。
ABC.硫酸铜溶液的温度保持不变,则溶解度不变,那么饱和溶液的溶质质量分数不变,故A错误符合题意,B、D正确不合题意;
C.根据题意可知,硫酸铜溶液的溶质质量分数不变,因为10毫升是100毫升的,所以溶质质量也是原来溶质质量的,故C正确不合题意。
故选A.
(1)仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小
(2)防止水污染
(3)1 个氧原子和 2 个氢原子
【解析】(1)仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小;骆驼的两个驼峰能够储藏很多水分;
(2)保护水资源包括两个方面:①节约用水;②防止水污染;
(3)分子由原子构成。
(1) 以仙人掌或骆驼为例说明这类生物能生活在沙漠中的特殊本领:仙人掌的肉质肥厚,能够储藏很多水,且叶片呈针状,水分的蒸发量很小。骆驼的两个驼峰能够储藏很多水分)
(2) 保护水资源的重要内容除了节约用水外,还有就是防止水污染 ;
(3)上图是电解水过程的微观模型,从中我们可以看出每一个水分子都是由 1 个氧原子和 2 个氢原子 构成的。
(1)有晶体析出
(2)氢氧化钠
【解析】(1)根据表格确定碳酸钠溶解度的变化,进而推测出现的现象。
(2)要使晶体减少,就要增大碳酸钠的溶解度,根据表格数据确定溶液的温度变化,最后结合物质溶解时吸热还是放热的知识解答。
(1)根据表格数据可知,当升温到60℃时,碳酸钠的溶解度为46.4g小于47g,那么烧杯④中出现的现象:有晶体析出。
(2)根据表格数据可知,要使试管中的晶体减少,就要升高温度。硝酸铵溶于水时吸热,导致溶液温度降低;氢氧化钠溶于水时放热,导致温度升高,因此应该加入适量的氢氧化钠。
、实验探究题
(1)cba
(2)有大量晶体析出
(3)A;C
(4)不合理,最终得到的白色固体仍是混合物,不是纯净的氯化钠
【解析】粗盐提纯的步骤:溶解、过滤、蒸发结晶
(1)操作①是溶解,故对应的是c,操作②是过滤,对应的是b,操作③是蒸发结晶,对应的是a,故填cba
(2)蒸发结晶时为了防止固体飞溅,待到蒸发皿中有大量晶体析出时,撤去酒精灯,用余温将剩余的水分蒸干
(3)A. 加入的水量不足会导致粗盐中的氯化钠不能完全溶解,会使产量偏低,A正确
B. 过滤时滤纸破损,会导致得到的细盐中含有杂质,对产量没有影响,B错误
C. 滤渣上会残留食盐溶液,因此没有用蒸馏水冲洗会使残留在滤渣表面的食盐没被蒸发出来,产量会偏低,C正确
D. 蒸发后,所得的精盐很潮湿,只是水分没有蒸干,对产量没有影响,D错误
故选A C
(4)粗盐中除了氯化钠和泥沙杂质之外还有一些可溶性的杂质,甲步骤中只除去了不溶性的泥沙杂质,并未除去可溶性杂质,因此最终得到的12g白色固体中还有气体物质,不是纯净的氯化钠
故答案为(1)cba (2)有大量晶体析出 (3)A C (4) 不合理,最终得到的白色固体仍是混合物,不是纯净的氯化钠
(1)用带火星木条放在尖嘴管口,捏动橡皮管放出气体,若木条复燃则是氧气
(2)增大
(3)A;B;C
【解析】(1)在电解水的实验中,与正极相连的试管产生氧气,与负极相连的试管产生氢气;氧气能够使带火星的小木条复燃;
(2)电解水产生氢气和氧气,那么水的质量会减小,而溶质氢氧化钠的质量保持不变,根据公式溶质质量分数=可知,氢氧化钠溶液的溶质质量分数增大;
(3)可以从实验操作的安全性、气体的检验和器材的获取容易程度方面思考改进装置的优点。
(1)在图2中,电源正极相连接的移液管中收集的是氧气,检验氧气的方法为:用带火星木条放在尖嘴管口,捏动橡皮管放出气体,若木条复燃则是氧气;
(2)实验结束后,氢氧化钠溶液电解液的溶质质量分数将增大;
(3)A.实验时手不用直接接触有腐蚀性的电解液,是实验操作更安全,故A符合题意;
B.非常方便两极气体的检验,故B符合题意;
C.所用实验器材都是用家里常见的物品改制而成,简单易得,故C符合题意。
故选ABC。
、解答题
(1)10g;A
(2)A;D
(3) 释为0.9%的生理盐水的质量为:10g÷0.9%≈1111.1g;
需要加水的质量:1111.1g-200g=911.1g。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数计算出食盐的质量;在定量的称量药品时,天平右盘的砝码和游码不能动,只能通过调节左盘药品的质量让天平实现平衡;
(2)根据溶质质量分数=可知,溶质的质量分数偏小的原因:①溶质食盐的质量偏小;②溶剂水的质量偏大;
(3)首先根据公式溶液质量=计算出稀释后食盐水的质量,然后减去原来食盐水的质量就是加水的质量。
(1)应称取食盐的质量:200g×5%=10g;在称量过程中,天平指针偏左,说明左盘食盐的质量偏大,因此接下来应该取出一些食盐,故选A;
(2)A.食盐中含有杂质,那么溶质的质量偏小,故A正确;
B.将量筒中的水倒入烧杯时还有部分残留,会使溶液中水的质量偏小,溶质质量分数偏大,故B错误;
C.砝码生锈,称取食盐的质量偏大,故C错误;
D.食盐还未溶解完,那么溶质的质量偏小,故D正确。
故选AD。
(3)稀释为0.9%的生理盐水的质量为:10g÷0.9%≈1111.1g;
需要加水的质量:1111.1g-200g=911.1g。
(1)②
(2)125kg×8%=(125kg-m)×20%,解得m=75kg。
【解析】(1)粗盐提纯需要经过溶解、过滤、蒸发、结晶等过程。
(2)蒸发浓缩问题中,可以根据溶质质量不变列式。
(1)晒盐的目的是提取溶液中的溶质,因此选用溶质质量分数较大的②更为合适。
(1)人体内温度较高,二氧化碳的溶解度随温度的上升而下降,二氧化碳析出
(2)m可乐=500mL×1g/cm3=500g
糖的质量分数是=54g/500g ×100%=10.8%
(3)50%x=300g×10%,x=60g
【解析】(1)可乐里面含有大量的二氧化碳气体,根据气体的溶解度随温度的变化规律分析解答;
(2)首先根据m=ρV计算出500mL可乐的质量,再根据溶质质量分数=计算;
(3)配制前后糖的质量保持不变,以此为等量条件根据溶质质量=溶液质量×溶质质量分数列出方程,计算即可。
(1)喝上几口冰镇可乐往往会打嗝,其主要原因是:人体内温度较高,二氧化碳的溶解度随温度的上升而下降,二氧化碳析出;
(2)500mL可乐的质量: m可乐=ρV=500mL×1g/cm3=500g;
糖的质量分数是:。
(3)设需要50%的糖水质量为x,
50%x=300g×10%;
解得:x=60g。
第 1 页(共 1 页)
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
