(2)化学物质及其变化—高考化学一轮复习大单元知识清单
文档属性
| 名称 | (2)化学物质及其变化—高考化学一轮复习大单元知识清单 |  | |
| 格式 | docx | ||
| 文件大小 | 634.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 14:32:00 | ||
图片预览

文档简介
(2)化学物质及其变化—高考化学一轮复习大单元知识清单
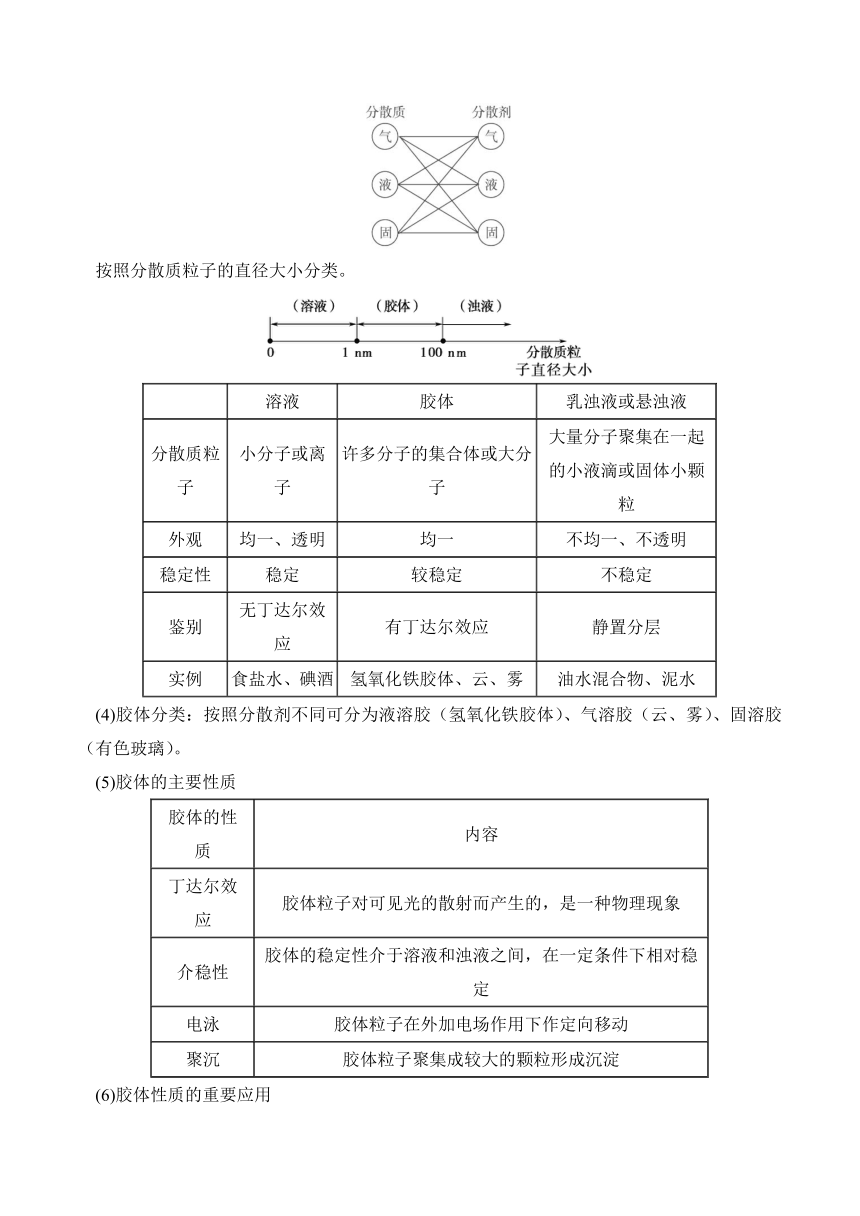
常见物质的分类方法
(1)树状分类法
(2)交叉分类法
根据性质对氧化物进行分类
(1)酸性氧化物:与碱反应生成盐和水的氧化物:如CO2、SO3等。多数酸性氧化物能溶于水,与水化合生成酸:如CO2+H2O=H2CO3。
(2)碱性氧化物:与酸反应生成盐和水的氧化物:如CaO、Fe2O3等。有的碱性氧化物能溶于水生成碱:如CaO+H2O=Ca(OH)2。
(3)两性氧化物(如Al2O3)
(4)其他(如CO、Na2O2等)
分散系及其分类
(1)概念:化学上把一种或多种物质以粒子形式分散到另一种或多种物质中所形成的混合物,叫做分散系。
(2)组成:分散系中被分散成粒子(小液滴或固体小颗粒)的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:因为分散质和分散系的状态都有固体、液体和气体三种,所以用交叉分类法得到的分散系的组合方式为:
按照分散质粒子的直径大小分类。
溶液 胶体 乳浊液或悬浊液
分散质粒子 小分子或离子 许多分子的集合体或大分子 大量分子聚集在一起的小液滴或固体小颗粒
外观 均一、透明 均一 不均一、不透明
稳定性 稳定 较稳定 不稳定
鉴别 无丁达尔效应 有丁达尔效应 静置分层
实例 食盐水、碘酒 氢氧化铁胶体、云、雾 油水混合物、泥水
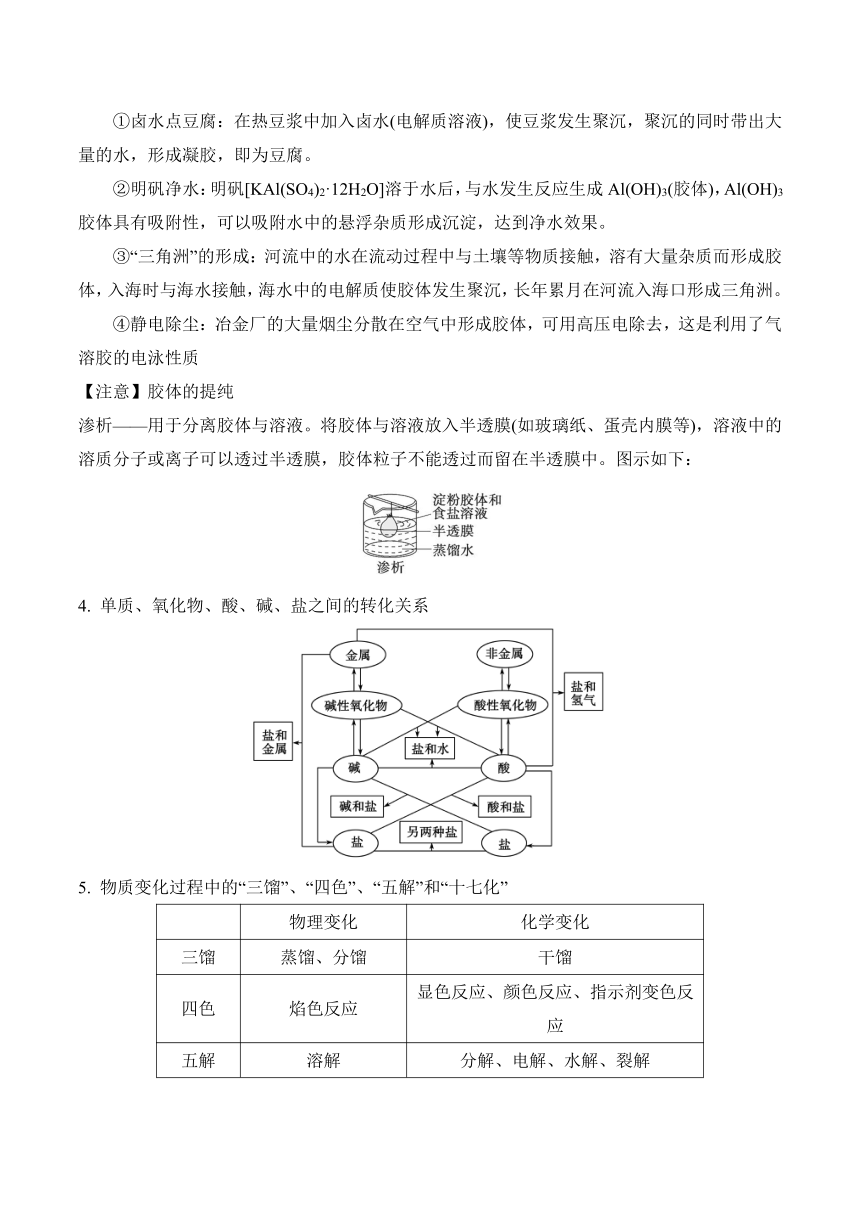
(4)胶体分类:按照分散剂不同可分为液溶胶(氢氧化铁胶体)、气溶胶(云、雾)、固溶胶(有色玻璃)。
(5)胶体的主要性质
胶体的性质 内容
丁达尔效应 胶体粒子对可见光的散射而产生的,是一种物理现象
介稳性 胶体的稳定性介于溶液和浊液之间,在一定条件下相对稳定
电泳 胶体粒子在外加电场作用下作定向移动
聚沉 胶体粒子聚集成较大的颗粒形成沉淀
(6)胶体性质的重要应用
①卤水点豆腐:在热豆浆中加入卤水(电解质溶液),使豆浆发生聚沉,聚沉的同时带出大量的水,形成凝胶,即为豆腐。
②明矾净水:明矾[KAl(SO4)2·12H2O]溶于水后,与水发生反应生成Al(OH)3(胶体),Al(OH)3胶体具有吸附性,可以吸附水中的悬浮杂质形成沉淀,达到净水效果。
③“三角洲”的形成:河流中的水在流动过程中与土壤等物质接触,溶有大量杂质而形成胶体,入海时与海水接触,海水中的电解质使胶体发生聚沉,长年累月在河流入海口形成三角洲。
④静电除尘:冶金厂的大量烟尘分散在空气中形成胶体,可用高压电除去,这是利用了气溶胶的电泳性质
【注意】胶体的提纯
渗析——用于分离胶体与溶液。将胶体与溶液放入半透膜(如玻璃纸、蛋壳内膜等),溶液中的溶质分子或离子可以透过半透膜,胶体粒子不能透过而留在半透膜中。图示如下:
单质、氧化物、酸、碱、盐之间的转化关系
物质变化过程中的“三馏”、“四色”、“五解”和“十七化”
物理变化 化学变化
三馏 蒸馏、分馏 干馏
四色 焰色反应 显色反应、颜色反应、指示剂变色反应
五解 溶解 分解、电解、水解、裂解
十七化 熔化、汽化、液化 氢化、水化、炭化、卤化、氧化、风化、钝化、催化、皂化、歧化、硝化、酯化、裂化、油脂的硬化
电解质:在水溶液或熔融状态下能够导电的化合物叫做电解质。
判断物质是不是电解质的方法
离子反应:是指电解质在溶液中电离产生的离子之间进行的反应。
离子反应发生的条件
(1)生成难溶物或微溶物。如Ba2+与CO32-、SO42-,Ag+与Cl-,Fe3+、Ca2+与OH-等。
(2)生成气体或挥发性物质。如NH4+与OH-,H+与CO32-、HCO3-等。
(3)生成难电离物质。如H+与CH3COO-、CO32-、HCO3-、S2-、HS-、SO42-、HSO3-等生成难电离的酸;OH-与NH4+生成难电离的碱;H+与OH-生成水等。
书写离子方程式的拆分原则
(1)常见物质的拆分原则
书写原则 物质类型
能拆成离子的物质 ①强酸:HCl、H2SO4、HNO3等 ②强碱:KOH、NaOH、Ba(OH)2等 ③可溶性盐:NaCl、K2SO4、NaNO3等
不能拆成离子的物质 ①单质 ②气体 ③氧化物 ④难溶物:Cu(OH)2、BaSO4、AgCl等 ⑤难电离的物质:CH3COOH、NH3·H2O、H2O ⑥非电解质:乙醇等 ⑦浓硫酸
(2)微溶物的书写原则
离子共存问题中易忽视的三类隐含条件
(1)溶液无色透明时,则溶液中一定没有有色离子,如Cu2+、Fe3+、Fe2+、MnO4-等。
(2)滴入酚酞溶液变红的溶液或pH>7(常温下)的溶液中肯定不能大量存在与OH-反应的离子,如Al3+、Mg2+、Cu2+、Zn2+、Fe3+、Fe2+、Ca2+、NH4+、H+、HCO3-、HSO3-等。
(3)滴入石蕊溶液变红的溶液或pH<7(常温下)的溶液中肯定不能大量存在与H+反应的离子,如OH-、CO32-、HCO3-等。
氧化还原反应
记忆口诀:
氧化剂:降→得→还
即氧化剂:所含元素化合价降低→得到电子→被还原,发生还原反应,得到还原产物;
还原剂:升→失→氧
即还原剂:所含元素化合价升高→失去电子→被氧化,发生氧化反应,得到氧化产物。
氧化还原反应电子转移的表示方法
双线桥法
示例:用双线桥法表示氢气还原氧化铜的电子转移情况:
单线桥法
示例:用单线桥法表示铁与盐酸反应的电子转移情况:
常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、FeCl3等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO、SO2等
物质氧化性、还原性强弱的比较
(1)根据氧化还原反应方程式判断:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。
氧化剂+还原剂=还原被还原产物+氧化被氧化产物
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(2)根据金属、非金属活动性顺序判断:
(3)根据反应的条件及反应的剧烈程度比较:反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
例如,MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4>MnO2
(4)根据氧化还原反应的程度比较:不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。
氧化还原反应价态规律
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)“价态归中,互不交叉”规律:同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
常见物质的分类方法
(1)树状分类法
(2)交叉分类法
根据性质对氧化物进行分类
(1)酸性氧化物:与碱反应生成盐和水的氧化物:如CO2、SO3等。多数酸性氧化物能溶于水,与水化合生成酸:如CO2+H2O=H2CO3。
(2)碱性氧化物:与酸反应生成盐和水的氧化物:如CaO、Fe2O3等。有的碱性氧化物能溶于水生成碱:如CaO+H2O=Ca(OH)2。
(3)两性氧化物(如Al2O3)
(4)其他(如CO、Na2O2等)
分散系及其分类
(1)概念:化学上把一种或多种物质以粒子形式分散到另一种或多种物质中所形成的混合物,叫做分散系。
(2)组成:分散系中被分散成粒子(小液滴或固体小颗粒)的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:因为分散质和分散系的状态都有固体、液体和气体三种,所以用交叉分类法得到的分散系的组合方式为:
按照分散质粒子的直径大小分类。
溶液 胶体 乳浊液或悬浊液
分散质粒子 小分子或离子 许多分子的集合体或大分子 大量分子聚集在一起的小液滴或固体小颗粒
外观 均一、透明 均一 不均一、不透明
稳定性 稳定 较稳定 不稳定
鉴别 无丁达尔效应 有丁达尔效应 静置分层
实例 食盐水、碘酒 氢氧化铁胶体、云、雾 油水混合物、泥水
(4)胶体分类:按照分散剂不同可分为液溶胶(氢氧化铁胶体)、气溶胶(云、雾)、固溶胶(有色玻璃)。
(5)胶体的主要性质
胶体的性质 内容
丁达尔效应 胶体粒子对可见光的散射而产生的,是一种物理现象
介稳性 胶体的稳定性介于溶液和浊液之间,在一定条件下相对稳定
电泳 胶体粒子在外加电场作用下作定向移动
聚沉 胶体粒子聚集成较大的颗粒形成沉淀
(6)胶体性质的重要应用
①卤水点豆腐:在热豆浆中加入卤水(电解质溶液),使豆浆发生聚沉,聚沉的同时带出大量的水,形成凝胶,即为豆腐。
②明矾净水:明矾[KAl(SO4)2·12H2O]溶于水后,与水发生反应生成Al(OH)3(胶体),Al(OH)3胶体具有吸附性,可以吸附水中的悬浮杂质形成沉淀,达到净水效果。
③“三角洲”的形成:河流中的水在流动过程中与土壤等物质接触,溶有大量杂质而形成胶体,入海时与海水接触,海水中的电解质使胶体发生聚沉,长年累月在河流入海口形成三角洲。
④静电除尘:冶金厂的大量烟尘分散在空气中形成胶体,可用高压电除去,这是利用了气溶胶的电泳性质
【注意】胶体的提纯
渗析——用于分离胶体与溶液。将胶体与溶液放入半透膜(如玻璃纸、蛋壳内膜等),溶液中的溶质分子或离子可以透过半透膜,胶体粒子不能透过而留在半透膜中。图示如下:
单质、氧化物、酸、碱、盐之间的转化关系
物质变化过程中的“三馏”、“四色”、“五解”和“十七化”
物理变化 化学变化
三馏 蒸馏、分馏 干馏
四色 焰色反应 显色反应、颜色反应、指示剂变色反应
五解 溶解 分解、电解、水解、裂解
十七化 熔化、汽化、液化 氢化、水化、炭化、卤化、氧化、风化、钝化、催化、皂化、歧化、硝化、酯化、裂化、油脂的硬化
电解质:在水溶液或熔融状态下能够导电的化合物叫做电解质。
判断物质是不是电解质的方法
离子反应:是指电解质在溶液中电离产生的离子之间进行的反应。
离子反应发生的条件
(1)生成难溶物或微溶物。如Ba2+与CO32-、SO42-,Ag+与Cl-,Fe3+、Ca2+与OH-等。
(2)生成气体或挥发性物质。如NH4+与OH-,H+与CO32-、HCO3-等。
(3)生成难电离物质。如H+与CH3COO-、CO32-、HCO3-、S2-、HS-、SO42-、HSO3-等生成难电离的酸;OH-与NH4+生成难电离的碱;H+与OH-生成水等。
书写离子方程式的拆分原则
(1)常见物质的拆分原则
书写原则 物质类型
能拆成离子的物质 ①强酸:HCl、H2SO4、HNO3等 ②强碱:KOH、NaOH、Ba(OH)2等 ③可溶性盐:NaCl、K2SO4、NaNO3等
不能拆成离子的物质 ①单质 ②气体 ③氧化物 ④难溶物:Cu(OH)2、BaSO4、AgCl等 ⑤难电离的物质:CH3COOH、NH3·H2O、H2O ⑥非电解质:乙醇等 ⑦浓硫酸
(2)微溶物的书写原则
离子共存问题中易忽视的三类隐含条件
(1)溶液无色透明时,则溶液中一定没有有色离子,如Cu2+、Fe3+、Fe2+、MnO4-等。
(2)滴入酚酞溶液变红的溶液或pH>7(常温下)的溶液中肯定不能大量存在与OH-反应的离子,如Al3+、Mg2+、Cu2+、Zn2+、Fe3+、Fe2+、Ca2+、NH4+、H+、HCO3-、HSO3-等。
(3)滴入石蕊溶液变红的溶液或pH<7(常温下)的溶液中肯定不能大量存在与H+反应的离子,如OH-、CO32-、HCO3-等。
氧化还原反应
记忆口诀:
氧化剂:降→得→还
即氧化剂:所含元素化合价降低→得到电子→被还原,发生还原反应,得到还原产物;
还原剂:升→失→氧
即还原剂:所含元素化合价升高→失去电子→被氧化,发生氧化反应,得到氧化产物。
氧化还原反应电子转移的表示方法
双线桥法
示例:用双线桥法表示氢气还原氧化铜的电子转移情况:
单线桥法
示例:用单线桥法表示铁与盐酸反应的电子转移情况:
常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、FeCl3等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO、SO2等
物质氧化性、还原性强弱的比较
(1)根据氧化还原反应方程式判断:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。
氧化剂+还原剂=还原被还原产物+氧化被氧化产物
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(2)根据金属、非金属活动性顺序判断:
(3)根据反应的条件及反应的剧烈程度比较:反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
例如,MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4>MnO2
(4)根据氧化还原反应的程度比较:不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。
氧化还原反应价态规律
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)“价态归中,互不交叉”规律:同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
同课章节目录
