(7)化学反应与电能—高考化学一轮复习大单元知识清单
文档属性
| 名称 | (7)化学反应与电能—高考化学一轮复习大单元知识清单 |  | |
| 格式 | docx | ||
| 文件大小 | 836.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 14:32:51 | ||
图片预览


文档简介
(7)化学反应与电能—高考化学一轮复习大单元知识清单
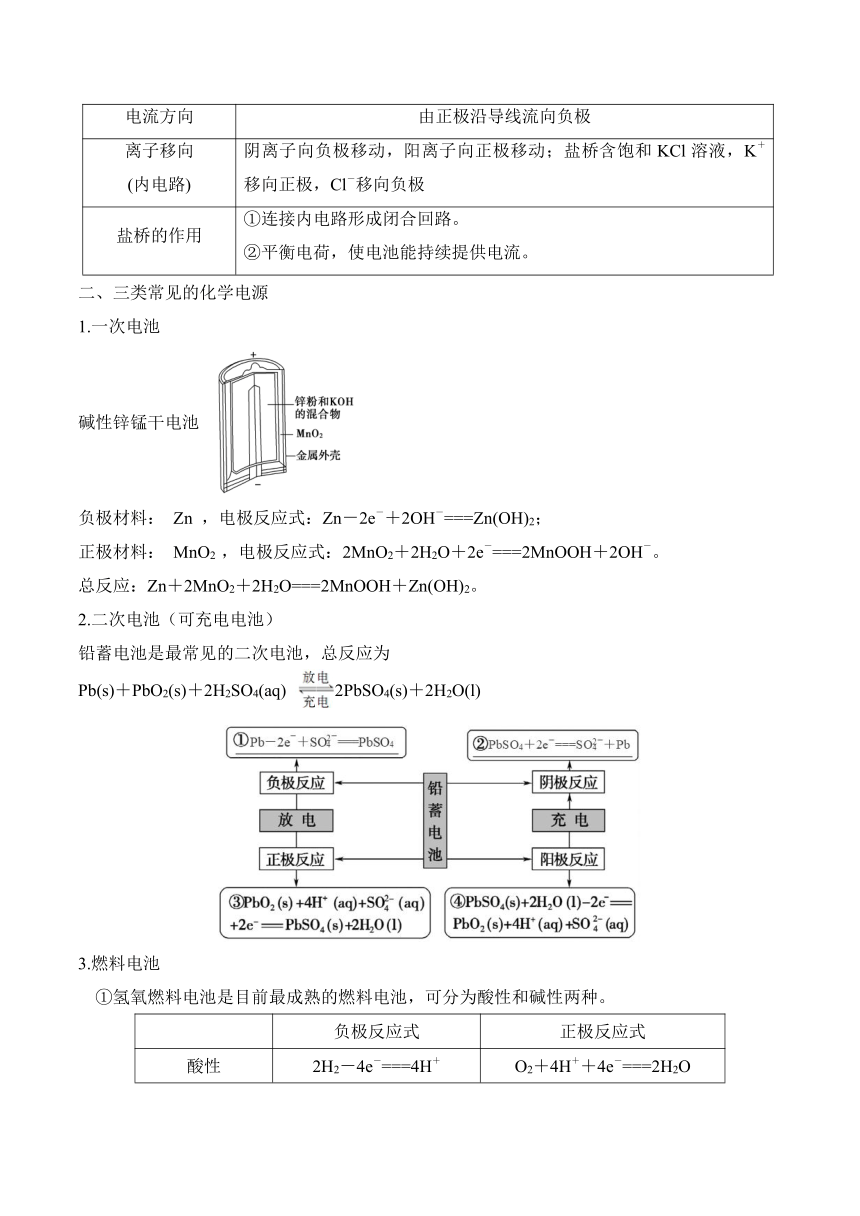
一、原电池及其工作原理
1.原电池的概念和本质:把化学能转化为电能的装置,其反应本质是发生了氧化还原反应。
2.构成条件
①有两个活泼性不同的电极。
②将电极插入电解质溶液中并形成闭合回路 。
③能自发进行的氧化还原反应。
注意:构成条件可概括为“两极—液—线—反应”。
3.工作原理
①以铜锌原电池为例构建原电池的认知模型
②图解原电池工作原理
电极名称 负极 正极
电极材料 Zn Cu
电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu
反应类型 氧化反应 还原反应
电子流向 由负极沿导线流向正极
电流方向 由正极沿导线流向负极
离子移向 (内电路) 阴离子向负极移动,阳离子向正极移动;盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极
盐桥的作用 ①连接内电路形成闭合回路。 ②平衡电荷,使电池能持续提供电流。
二、三类常见的化学电源
1.一次电池
碱性锌锰干电池
负极材料: Zn ,电极反应式:Zn-2e-+2OH-===Zn(OH)2;
正极材料: MnO2 ,电极反应式:2MnO2+2H2O+2e-===2MnOOH+2OH-。
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
2.二次电池(可充电电池)
铅蓄电池是最常见的二次电池,总反应为
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
3.燃料电池
①氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
负极反应式 正极反应式
酸性 2H2-4e-===4H+ O2+4H++4e-===2H2O
碱性 2H2+4OH--4e-===4H2O O2+2H2O+4e-===4OH-
熔融的金属氧化物作介质传导O2- H2-2e-+O2-===H2O O2+4e-===2O2-
碳酸盐作介质 H2-2e-+C===CO2+H2O O2+4e-+2CO2===2C
②甲烷—氧气燃料电池(只写出负极反应式)
a.CH4 -8e-+10OH- = C+7H2O (碱性介质);
b.CH4 -8e-+2H2O = CO2+8H+ (酸性介质);
c.CH4 -8e-+4C = 5CO2+2H2O (碳酸盐作介质);
d.CH4 -8e-+4O2- = CO2+2H2O (熔融的金属氧化物作介质高温下能传导O2-)。
三、电解池及电解原理
1.电解池
①概念:电解池是将电能转化为化学能的装置。
②电解池构成的条件:有外接电源;有与电解质溶液或熔融电解质相接触的两个电极;
形成闭合回路。
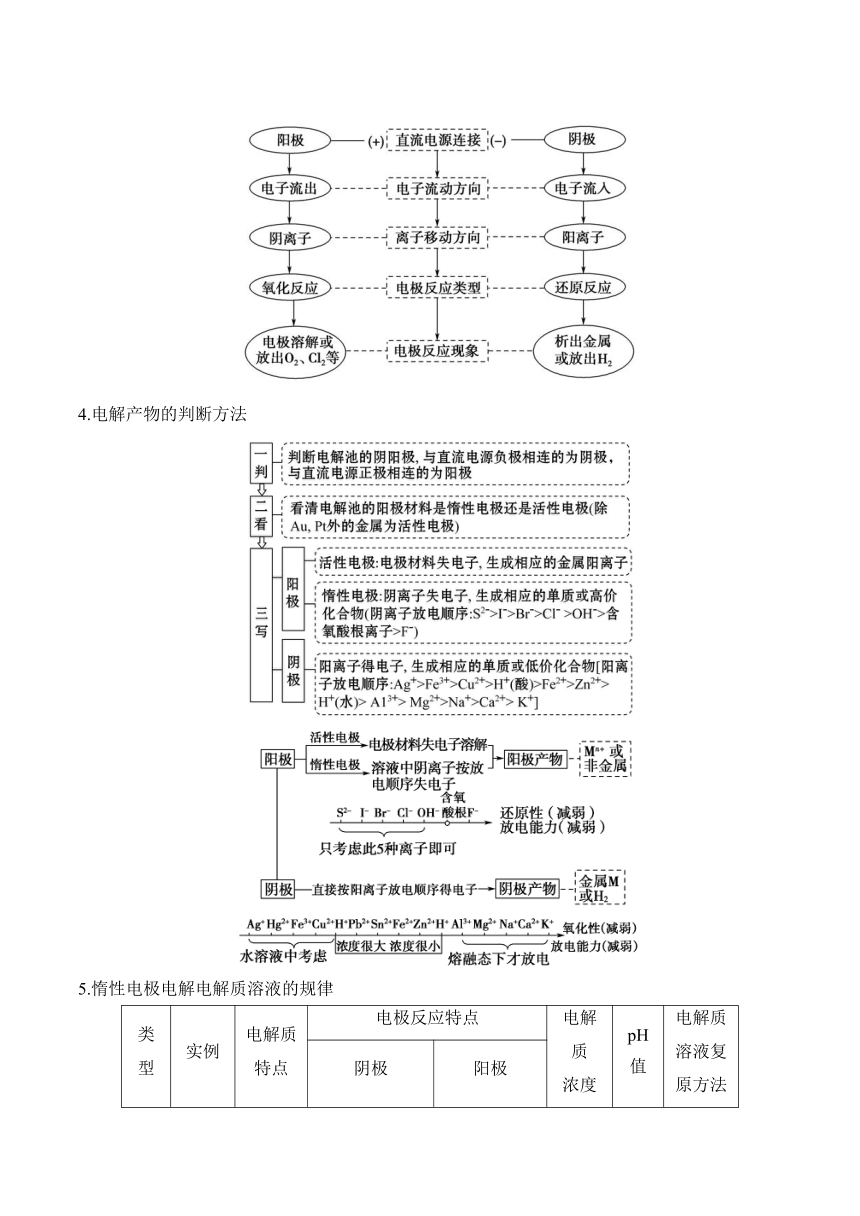
2.电解原理示意图
3.电解池的阴极、阳极的判断方法
4.电解产物的判断方法
5.惰性电极电解电解质溶液的规律
类型 实例 电解质 特点 电极反应特点 电解质 浓度 pH值 电解质溶液复 原方法
阴极 阳极
电解 水型 NaOH 可溶性 强碱 4H++4e-=2H2↑ 4OH--4e-=2H2O+O2↑ 增大 增大 加水
H2SO4 含氧酸 增大 减小 加水
Na2SO4 活泼金属含氧酸盐 增大 不变 加水
电解 电解 质型 HCl 无氧酸 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ 减小 增大 通氯化氢
CuCl2 不活泼 金属无 氧酸盐 Cu2++2e-=Cu 减小 增大 加氯化铜
放H2 生碱 型 NaCl 活泼金 属无氧 酸盐 2H++2e-=H2↑ 生成新 电解质 增大 通氯化氢
放O2 生酸 型 CuSO4 不活泼 金属含 氧酸盐 Cu2++2e-=Cu 4OH--4e-=2H2O+O2↑ 生成新 电解质 减小 加氧化铜
四、电解原理的应用
1.电解饱和食盐水
【氯碱工业的生产过程】
【注意】交换膜的分类及应用
2.电镀
(1)电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
(2)电镀
阳极:镀层金属,电极本身发生氧化反应
阴极:待镀金属制品
电镀溶液:含有镀层金属离子的溶液
3.电解精炼铜
(1)粗铜作阳极,主要的电极反应为Cu-2e- = Cu2+;粗铜作阴极,电极反应为Cu2++2e- = Cu;电解质溶液为CuSO4溶液。
(2)活泼性较强的铁、锌等以离子形式进入溶液,活泼性较差的Ag、Au形成阳极泥。
【注意】电镀铜与精炼铜的比较
电镀铜 精炼铜
能量转变 电能转化为化学能 电能转化为化学能
阳极材料 纯铜 粗铜(含锌、银、金等杂质)
阴极材料 镀件 纯铜
阳极反应 Cu-2e-=Cu2+ Zn-2e-=Zn2+ Cu-2e-=Cu2+等
阴极反应 Cu2++2e-=Cu Cu2++2e-=Cu
电解质溶液及其变化 硫酸铜溶液保持不变 反应后硫酸铜溶液中混有Zn2+等,Cu2+浓度减小
4.电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。
①冶炼钠
2NaCl(熔融)2Na+Cl2↑
电极反应——阳极:;阴极:。
②冶炼铝
2Al2O3(熔融)4Al+3O2↑
电极反应——阳极:;阴极:。
③冶炼Mg、Ca与钠相似都是电解氯化物,因AlCl3是共价化合物,故电解Al2O3制Al。
五、金属的腐蚀与防护
1.金属腐蚀的本质:金属原子失去电子变成阳离子而损耗。
2.金属腐蚀的类型
①化学腐蚀和电化学腐蚀
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的干燥气体或非电解质液体直接反应 不纯金属接触到电解质溶液发生原电池反应
本质 M-ne-===Mn+
现象 金属被腐蚀 较活泼金属被腐蚀
区别 无电流产生 有电流产生
联系 两者往往同时发生,_电化学_腐蚀更普遍
②析氢腐蚀和吸氧腐蚀
3.金属的防护
①电化学防护
a.牺牲阳极的阴极保护法——原电池原理
负极:比被保护金属活泼的金属;正极:被保护的金属设备。
b.外加电流的阴极保护法——电解原理
阴极:被保护的金属设备;阳极:惰性金属。
②改变金属的内部结构,如制成合金、不锈钢等。
③加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
一、原电池及其工作原理
1.原电池的概念和本质:把化学能转化为电能的装置,其反应本质是发生了氧化还原反应。
2.构成条件
①有两个活泼性不同的电极。
②将电极插入电解质溶液中并形成闭合回路 。
③能自发进行的氧化还原反应。
注意:构成条件可概括为“两极—液—线—反应”。
3.工作原理
①以铜锌原电池为例构建原电池的认知模型
②图解原电池工作原理
电极名称 负极 正极
电极材料 Zn Cu
电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu
反应类型 氧化反应 还原反应
电子流向 由负极沿导线流向正极
电流方向 由正极沿导线流向负极
离子移向 (内电路) 阴离子向负极移动,阳离子向正极移动;盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极
盐桥的作用 ①连接内电路形成闭合回路。 ②平衡电荷,使电池能持续提供电流。
二、三类常见的化学电源
1.一次电池
碱性锌锰干电池
负极材料: Zn ,电极反应式:Zn-2e-+2OH-===Zn(OH)2;
正极材料: MnO2 ,电极反应式:2MnO2+2H2O+2e-===2MnOOH+2OH-。
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
2.二次电池(可充电电池)
铅蓄电池是最常见的二次电池,总反应为
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
3.燃料电池
①氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
负极反应式 正极反应式
酸性 2H2-4e-===4H+ O2+4H++4e-===2H2O
碱性 2H2+4OH--4e-===4H2O O2+2H2O+4e-===4OH-
熔融的金属氧化物作介质传导O2- H2-2e-+O2-===H2O O2+4e-===2O2-
碳酸盐作介质 H2-2e-+C===CO2+H2O O2+4e-+2CO2===2C
②甲烷—氧气燃料电池(只写出负极反应式)
a.CH4 -8e-+10OH- = C+7H2O (碱性介质);
b.CH4 -8e-+2H2O = CO2+8H+ (酸性介质);
c.CH4 -8e-+4C = 5CO2+2H2O (碳酸盐作介质);
d.CH4 -8e-+4O2- = CO2+2H2O (熔融的金属氧化物作介质高温下能传导O2-)。
三、电解池及电解原理
1.电解池
①概念:电解池是将电能转化为化学能的装置。
②电解池构成的条件:有外接电源;有与电解质溶液或熔融电解质相接触的两个电极;
形成闭合回路。
2.电解原理示意图
3.电解池的阴极、阳极的判断方法
4.电解产物的判断方法
5.惰性电极电解电解质溶液的规律
类型 实例 电解质 特点 电极反应特点 电解质 浓度 pH值 电解质溶液复 原方法
阴极 阳极
电解 水型 NaOH 可溶性 强碱 4H++4e-=2H2↑ 4OH--4e-=2H2O+O2↑ 增大 增大 加水
H2SO4 含氧酸 增大 减小 加水
Na2SO4 活泼金属含氧酸盐 增大 不变 加水
电解 电解 质型 HCl 无氧酸 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ 减小 增大 通氯化氢
CuCl2 不活泼 金属无 氧酸盐 Cu2++2e-=Cu 减小 增大 加氯化铜
放H2 生碱 型 NaCl 活泼金 属无氧 酸盐 2H++2e-=H2↑ 生成新 电解质 增大 通氯化氢
放O2 生酸 型 CuSO4 不活泼 金属含 氧酸盐 Cu2++2e-=Cu 4OH--4e-=2H2O+O2↑ 生成新 电解质 减小 加氧化铜
四、电解原理的应用
1.电解饱和食盐水
【氯碱工业的生产过程】
【注意】交换膜的分类及应用
2.电镀
(1)电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
(2)电镀
阳极:镀层金属,电极本身发生氧化反应
阴极:待镀金属制品
电镀溶液:含有镀层金属离子的溶液
3.电解精炼铜
(1)粗铜作阳极,主要的电极反应为Cu-2e- = Cu2+;粗铜作阴极,电极反应为Cu2++2e- = Cu;电解质溶液为CuSO4溶液。
(2)活泼性较强的铁、锌等以离子形式进入溶液,活泼性较差的Ag、Au形成阳极泥。
【注意】电镀铜与精炼铜的比较
电镀铜 精炼铜
能量转变 电能转化为化学能 电能转化为化学能
阳极材料 纯铜 粗铜(含锌、银、金等杂质)
阴极材料 镀件 纯铜
阳极反应 Cu-2e-=Cu2+ Zn-2e-=Zn2+ Cu-2e-=Cu2+等
阴极反应 Cu2++2e-=Cu Cu2++2e-=Cu
电解质溶液及其变化 硫酸铜溶液保持不变 反应后硫酸铜溶液中混有Zn2+等,Cu2+浓度减小
4.电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。
①冶炼钠
2NaCl(熔融)2Na+Cl2↑
电极反应——阳极:;阴极:。
②冶炼铝
2Al2O3(熔融)4Al+3O2↑
电极反应——阳极:;阴极:。
③冶炼Mg、Ca与钠相似都是电解氯化物,因AlCl3是共价化合物,故电解Al2O3制Al。
五、金属的腐蚀与防护
1.金属腐蚀的本质:金属原子失去电子变成阳离子而损耗。
2.金属腐蚀的类型
①化学腐蚀和电化学腐蚀
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的干燥气体或非电解质液体直接反应 不纯金属接触到电解质溶液发生原电池反应
本质 M-ne-===Mn+
现象 金属被腐蚀 较活泼金属被腐蚀
区别 无电流产生 有电流产生
联系 两者往往同时发生,_电化学_腐蚀更普遍
②析氢腐蚀和吸氧腐蚀
3.金属的防护
①电化学防护
a.牺牲阳极的阴极保护法——原电池原理
负极:比被保护金属活泼的金属;正极:被保护的金属设备。
b.外加电流的阴极保护法——电解原理
阴极:被保护的金属设备;阳极:惰性金属。
②改变金属的内部结构,如制成合金、不锈钢等。
③加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
同课章节目录
