(5)物质结构元素周期律—高考化学一轮复习大单元知识清单
文档属性
| 名称 | (5)物质结构元素周期律—高考化学一轮复习大单元知识清单 |  | |
| 格式 | docx | ||
| 文件大小 | 800.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 14:33:00 | ||
图片预览




文档简介
(5)物质结构 元素周期律—高考化学一轮复习大单元知识清单
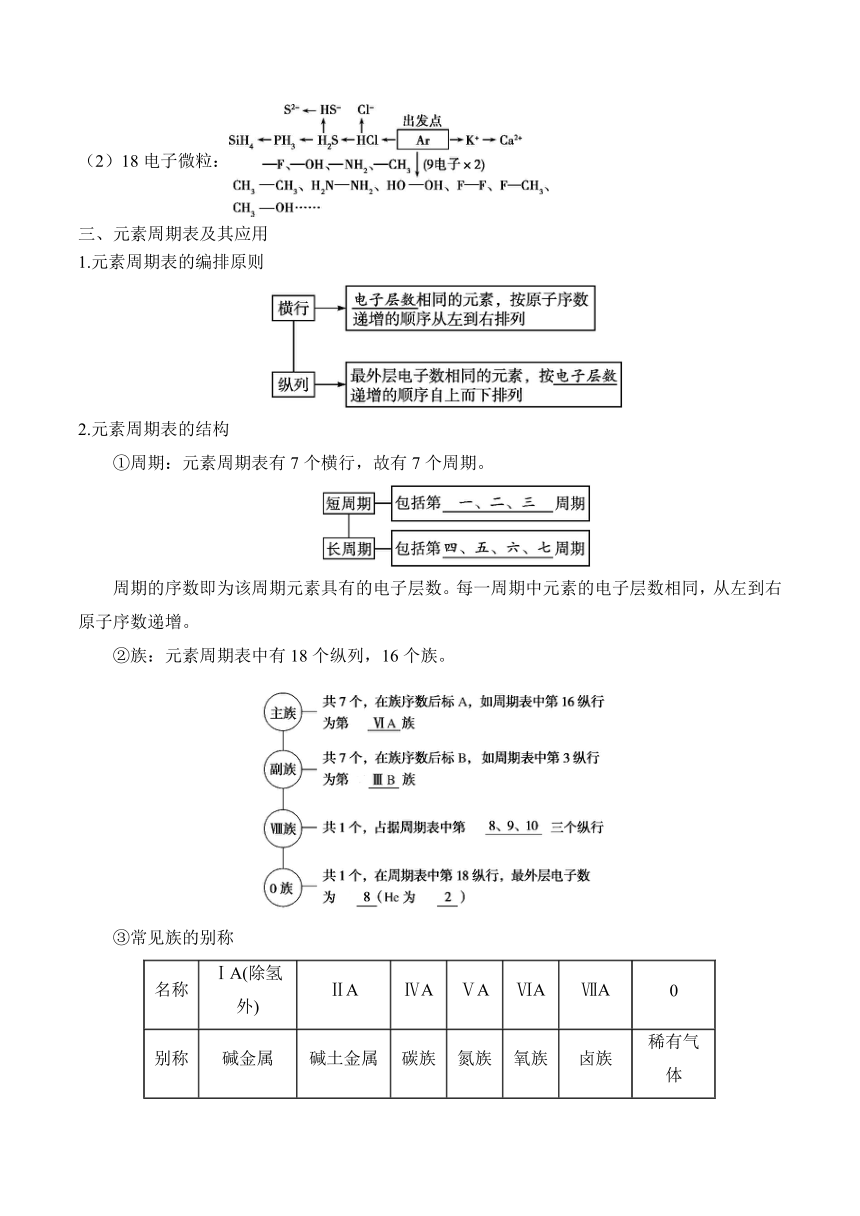
一、原子的构成
1.原子的构成
2.符号 X 中各数字的含义
3.元素、核素、同位素、同素异形体的联系
几种常见的重要核素及应用
【注意】“四同”比较
同位素 同素异形体 同分异构体 同系物
概念 质子数相同,中子数不同的同一种元素的不同原子之间互为同位素 同种元素组成的结构不同的单质之间互为同素异形体 分子式相同,结构不同的化合物互为同分异构体 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物
对象 原子之间 单质之间 一般为有机化合物之间 有机化合物之间
化学 性质 几乎完全相同 相似,一定条件下可以相互转变 可能相似也可能不同 相似
实例 金刚石与石墨、C60;红磷与白磷 CH3COOH 与HCOOCH3 甲烷、乙烷、丙烷;乙烯、丙烯;甲酸、乙酸
二、核外电子排布
1.原子核外电子排布规律
电子层的表示方法 1 2 3 4 5 6 7
K L M N O P Q
能量规律 电子能量由低到高
排布规律 ①每层最多容纳的电子数为2n2个; ②最外层电子数不超过8个(K层为最外层时电子数不超过2个); ③次外层电子数不超过18个。
2.原子结构示意图
【拓展】寻找10电子和18电子微粒的方法
(1)10电子微粒:
(2)18电子微粒:
三、元素周期表及其应用
1.元素周期表的编排原则
2.元素周期表的结构
①周期:元素周期表有7个横行,故有7个周期。
周期的序数即为该周期元素具有的电子层数。每一周期中元素的电子层数相同,从左到右原子序数递增。
②族:元素周期表中有18个纵列,16个族。
③常见族的别称
名称 ⅠA(除氢外) ⅡA ⅣA ⅤA ⅥA ⅦA 0
别称 碱金属 碱土金属 碳族 氮族 氧族 卤族 稀有气体
④过渡元素:元素周期表中从第ⅢB族到第ⅡB族共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。由于镧系和锕系位于第3列,所以元素种类最多的族是第ⅢB族。
3.元素周期表中的方格中的元素的信息
4.元素在周期表中的位置关系
①同周期第ⅡA族和第ⅢA族元素原子序数差
②同主族相邻两元素原子序数之差的情况
i. 若为第ⅠA、第ⅡA族元素,则原子序数之差等于上周期元素所在周期的元素种类数。
ii. 若为ⅢA族至0族元素,则原子序数之差等于下周期元素所在周期的元素种类数。
③同主族不相邻两元素的原子序数的差。
元素周期表中第一周期至第七周期的元素种类数分别是2,8,8,18,18,32,32,故同主族不相邻的两种元素的原子序数的差是这几个数的和或差,如1H和19K的原子序数差是2+8+8=18。
5.元素周期表按元素种类分区
①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现非金属元素的性质,又表现金属元素的性质。
④过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵行共六十多种元素,
这些元素都是金属元素。
⑤镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
⑥锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
⑦超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
6.元素周期表的应用
①进行科学预测:为新元素的发现及预测它们的原子结构和性质提供的线索。
②寻找新材料
③用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
四、元素周期律
1.主族元素的周期性变化规律
项目 同周期(左→右) 同主族(上→下)
原子结构 电子层数 相同 逐渐增多
核电荷数 逐渐增大 逐渐增大
原子半径 逐渐减小 逐渐增大
离子半径 阳离子逐渐减小 阴离子逐渐减小 r(阴离子)>r(阳离子) 逐渐增大
性质 化合价 最高正化合价由+1→+7(O、F除外),负化合价=主族序数-8 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强 非金属性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱 阴离子还原性逐渐增强
气态氢化物稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强 酸性逐渐减弱
2.元素周期律的应用
①比较不同周期、不同主族元素的性质
如金属性:Mg>Al,Ca>Mg,则碱性:Mg(OH)2>Al(OH)3,Ca(OH)2>Mg(OH)2(填“>”“<”或“=”)。
②推测未知元素的某些性质
如,已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶。又如,已知卤族元素的性质递变规律,可推知元素砹(At)应为黑色固体,与氢气难化合,HAt不稳定,水溶液呈酸性,AgAt难溶于水等。
3.元素金属性和非金属性强弱的判断方法
金属性比较 本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断 方法 ①在金属活动性顺序表中越靠前,金属性越强(极少数例外)
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置:左边或下方元素的金属性强
非金属性 比较 本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断 方法 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置:右边或上方元素的非金属性强
4.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的。例如:
五、化学键
1.构成原子的微粒及作用
键型 离子键 共价键
非极性键 极性键
概念 使阴、阳离子结合成化合物的静电作用 原子之间通过共用电子对所形成的相互作用(电子云重叠)
特点 阴、阳离子间相互作用 共用电子对不偏移 共用电子对偏向吸引电子能力强的一方
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种元素的原子 不同种元素的原子
存在 离子化合物 非金属单质(稀有气体除外),某些化合物 共价化合物,某些离子化合物
示例
2.离子化合物与共价化合物
比较项目 离子化合物 共价化合物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
3.化学键对物质性质的影响
①化学键对物质物理性质的影响
金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为这些物质中的共价键 很强,破坏时需消耗很多的能量。NaCl等部分离子化合物中有很强的离子键 ,故其熔点也较高。
②化学键对物质化学性质的影响
N2分子中有很强的共价键,故在通常状况下,N2很稳定;H2S、HI等分子中的共价键较弱,故它们受热时易分解。
4.分子间作用力和氢键
(1)分子间作用力
定义 把分子聚集在一起的作用力,又称范德华力
特点 ①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质; ②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力
变化规律 一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔、沸点也越高 。例如,熔、沸点:I2>Br2>Cl2>F2
2.氢键
定义 分子间存在的一种比分子间作用力稍强的相互作用
形成条件 除H外,形成氢键的原子通常是O、F、N
存在 氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点升高
一、原子的构成
1.原子的构成
2.符号 X 中各数字的含义
3.元素、核素、同位素、同素异形体的联系
几种常见的重要核素及应用
【注意】“四同”比较
同位素 同素异形体 同分异构体 同系物
概念 质子数相同,中子数不同的同一种元素的不同原子之间互为同位素 同种元素组成的结构不同的单质之间互为同素异形体 分子式相同,结构不同的化合物互为同分异构体 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物
对象 原子之间 单质之间 一般为有机化合物之间 有机化合物之间
化学 性质 几乎完全相同 相似,一定条件下可以相互转变 可能相似也可能不同 相似
实例 金刚石与石墨、C60;红磷与白磷 CH3COOH 与HCOOCH3 甲烷、乙烷、丙烷;乙烯、丙烯;甲酸、乙酸
二、核外电子排布
1.原子核外电子排布规律
电子层的表示方法 1 2 3 4 5 6 7
K L M N O P Q
能量规律 电子能量由低到高
排布规律 ①每层最多容纳的电子数为2n2个; ②最外层电子数不超过8个(K层为最外层时电子数不超过2个); ③次外层电子数不超过18个。
2.原子结构示意图
【拓展】寻找10电子和18电子微粒的方法
(1)10电子微粒:
(2)18电子微粒:
三、元素周期表及其应用
1.元素周期表的编排原则
2.元素周期表的结构
①周期:元素周期表有7个横行,故有7个周期。
周期的序数即为该周期元素具有的电子层数。每一周期中元素的电子层数相同,从左到右原子序数递增。
②族:元素周期表中有18个纵列,16个族。
③常见族的别称
名称 ⅠA(除氢外) ⅡA ⅣA ⅤA ⅥA ⅦA 0
别称 碱金属 碱土金属 碳族 氮族 氧族 卤族 稀有气体
④过渡元素:元素周期表中从第ⅢB族到第ⅡB族共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。由于镧系和锕系位于第3列,所以元素种类最多的族是第ⅢB族。
3.元素周期表中的方格中的元素的信息
4.元素在周期表中的位置关系
①同周期第ⅡA族和第ⅢA族元素原子序数差
②同主族相邻两元素原子序数之差的情况
i. 若为第ⅠA、第ⅡA族元素,则原子序数之差等于上周期元素所在周期的元素种类数。
ii. 若为ⅢA族至0族元素,则原子序数之差等于下周期元素所在周期的元素种类数。
③同主族不相邻两元素的原子序数的差。
元素周期表中第一周期至第七周期的元素种类数分别是2,8,8,18,18,32,32,故同主族不相邻的两种元素的原子序数的差是这几个数的和或差,如1H和19K的原子序数差是2+8+8=18。
5.元素周期表按元素种类分区
①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现非金属元素的性质,又表现金属元素的性质。
④过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵行共六十多种元素,
这些元素都是金属元素。
⑤镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
⑥锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
⑦超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
6.元素周期表的应用
①进行科学预测:为新元素的发现及预测它们的原子结构和性质提供的线索。
②寻找新材料
③用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
四、元素周期律
1.主族元素的周期性变化规律
项目 同周期(左→右) 同主族(上→下)
原子结构 电子层数 相同 逐渐增多
核电荷数 逐渐增大 逐渐增大
原子半径 逐渐减小 逐渐增大
离子半径 阳离子逐渐减小 阴离子逐渐减小 r(阴离子)>r(阳离子) 逐渐增大
性质 化合价 最高正化合价由+1→+7(O、F除外),负化合价=主族序数-8 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强 非金属性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强 阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱 阴离子还原性逐渐增强
气态氢化物稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强 酸性逐渐减弱
2.元素周期律的应用
①比较不同周期、不同主族元素的性质
如金属性:Mg>Al,Ca>Mg,则碱性:Mg(OH)2>Al(OH)3,Ca(OH)2>Mg(OH)2(填“>”“<”或“=”)。
②推测未知元素的某些性质
如,已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶。又如,已知卤族元素的性质递变规律,可推知元素砹(At)应为黑色固体,与氢气难化合,HAt不稳定,水溶液呈酸性,AgAt难溶于水等。
3.元素金属性和非金属性强弱的判断方法
金属性比较 本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断 方法 ①在金属活动性顺序表中越靠前,金属性越强(极少数例外)
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置:左边或下方元素的金属性强
非金属性 比较 本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断 方法 ①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置:右边或上方元素的非金属性强
4.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的。例如:
五、化学键
1.构成原子的微粒及作用
键型 离子键 共价键
非极性键 极性键
概念 使阴、阳离子结合成化合物的静电作用 原子之间通过共用电子对所形成的相互作用(电子云重叠)
特点 阴、阳离子间相互作用 共用电子对不偏移 共用电子对偏向吸引电子能力强的一方
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种元素的原子 不同种元素的原子
存在 离子化合物 非金属单质(稀有气体除外),某些化合物 共价化合物,某些离子化合物
示例
2.离子化合物与共价化合物
比较项目 离子化合物 共价化合物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
3.化学键对物质性质的影响
①化学键对物质物理性质的影响
金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为这些物质中的共价键 很强,破坏时需消耗很多的能量。NaCl等部分离子化合物中有很强的离子键 ,故其熔点也较高。
②化学键对物质化学性质的影响
N2分子中有很强的共价键,故在通常状况下,N2很稳定;H2S、HI等分子中的共价键较弱,故它们受热时易分解。
4.分子间作用力和氢键
(1)分子间作用力
定义 把分子聚集在一起的作用力,又称范德华力
特点 ①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质; ②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力
变化规律 一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔、沸点也越高 。例如,熔、沸点:I2>Br2>Cl2>F2
2.氢键
定义 分子间存在的一种比分子间作用力稍强的相互作用
形成条件 除H外,形成氢键的原子通常是O、F、N
存在 氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点升高
同课章节目录
