(8)化学反应速率与化学平衡—高考化学一轮复习大单元知识清单
文档属性
| 名称 | (8)化学反应速率与化学平衡—高考化学一轮复习大单元知识清单 |  | |
| 格式 | docx | ||
| 文件大小 | 668.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 14:33:27 | ||
图片预览

文档简介
(8)化学反应速率与化学平衡—高考化学一轮复习大单元知识清单
一、化学反应速率
1.化学反应速率的概念及表示方法
(1)化学反应速率一般指平均速率而不是某一时刻的瞬时速率,且无论用反应物还是用生成物表示均取正值;
(2)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同;
(3)不能用固体或纯液体物质表示化学反应速率,因为固体或纯液体物质的浓度视为常数。
2.与化学方程式中化学计量数的关系
对于已知反应mA(g)+nB(g) ==== pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于方程式中各物质的化学计量数之比,v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q。
二、影响化学反应速率的因素
1.内因:反应物本身的性质如Na、Mg、Al与水反应的速率由大到小的顺序为Na>Mg>Al。
2.外因
3.理论解释——有效碰撞
(1)活化分子、活化能、有效碰撞
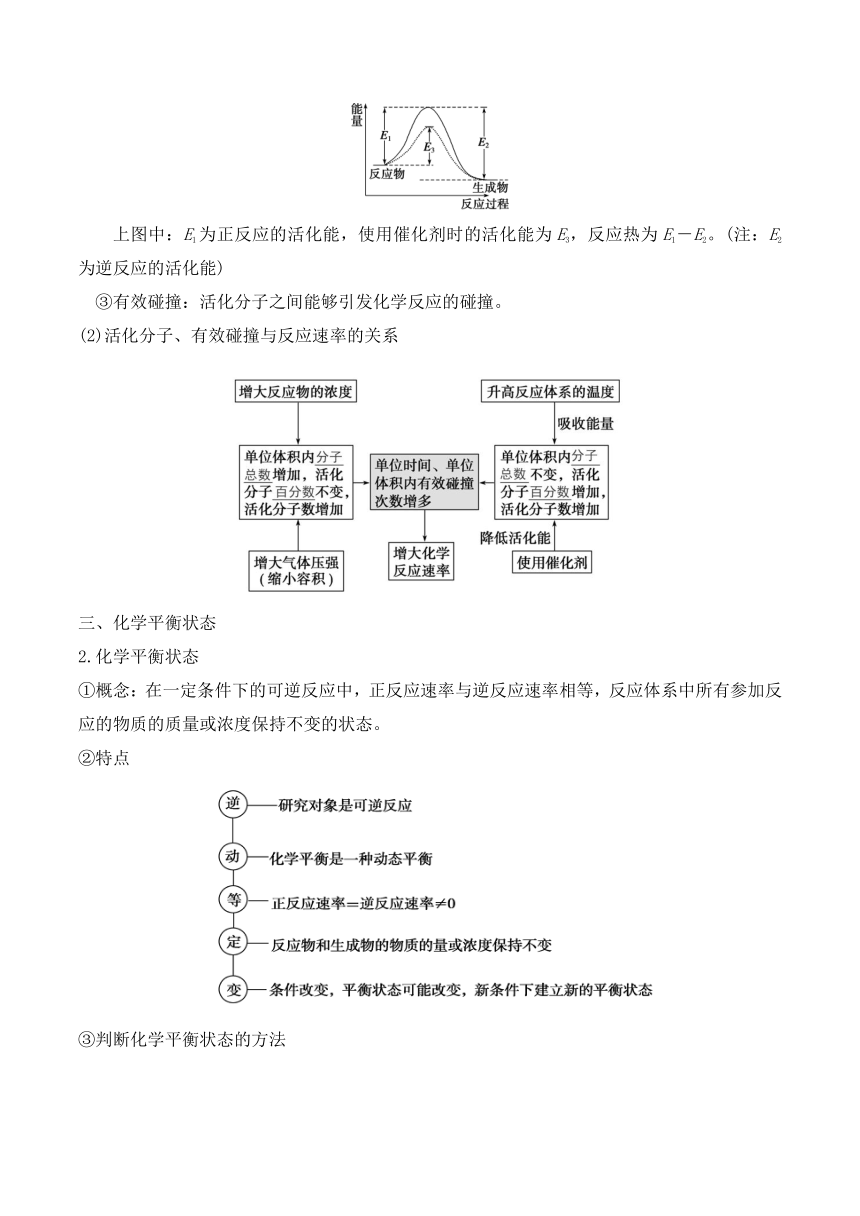
①活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
②活化能:活化分子的平均能量与所有分子的平均能量之差。
上图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
三、化学平衡状态
2.化学平衡状态
①概念:在一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。
②特点
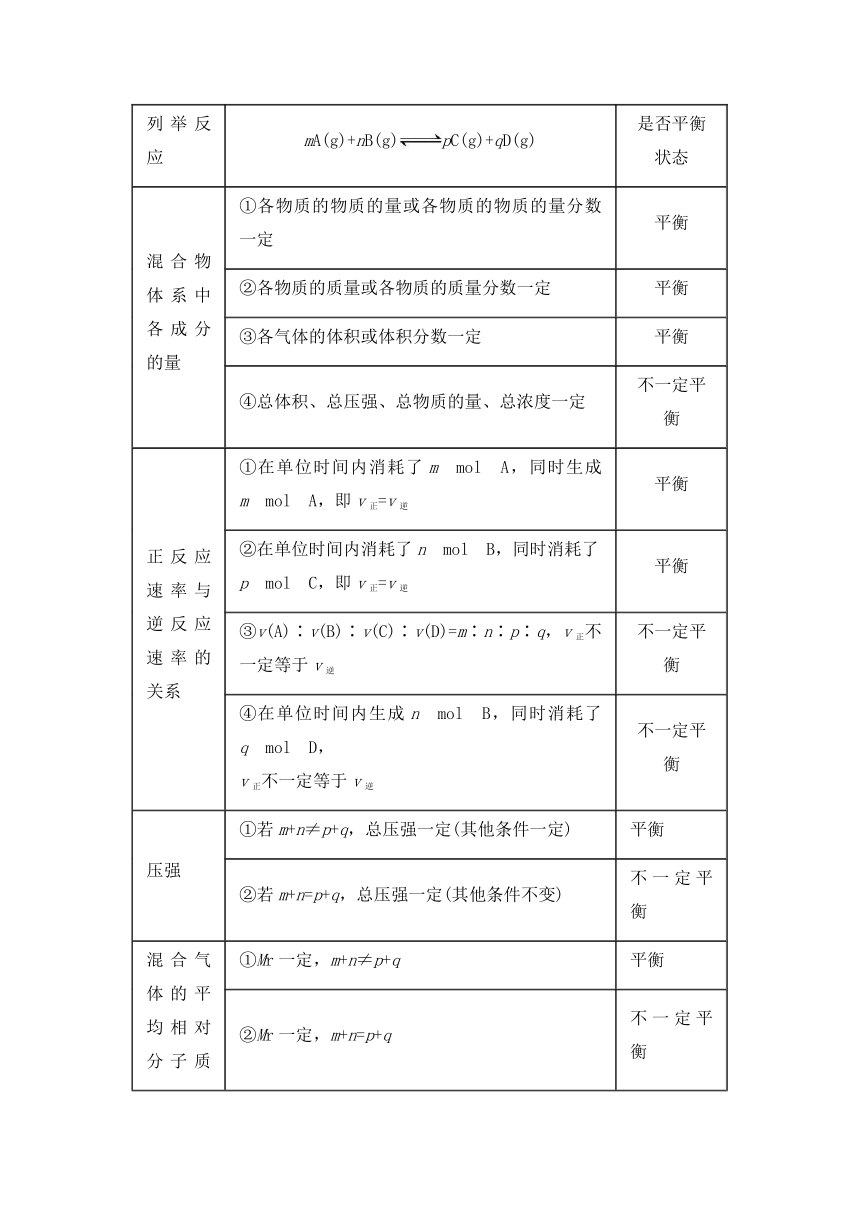
③判断化学平衡状态的方法
列举反应 mA(g)+nB(g)pC(g)+qD(g) 是否平衡状态
混合物体系中各成分的量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
③各气体的体积或体积分数一定 平衡
④总体积、总压强、总物质的量、总浓度一定 不一定平衡
正反应速率与逆反应速率的关系 ①在单位时间内消耗了m mol A,同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B,同时消耗了p mol C,即v正=v逆 平衡
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q,v正不一定等于v逆 不一定平衡
④在单位时间内生成n mol B,同时消耗了q mol D, v正不一定等于v逆 不一定平衡
压强 ①若m+n≠p+q,总压强一定(其他条件一定) 平衡
②若m+n=p+q,总压强一定(其他条件不变) 不一定平衡
混合气体的平均相对分子质量(Mr) ①Mr一定,m+n≠p+q 平衡
②Mr一定,m+n=p+q 不一定平衡
温度 任何化学反应都伴随着能量的变化,当体系温度一定时(其他条件不变) 平衡
颜色 颜色不再变化 平衡
体系的密度(ρ) 密度一定 不一定平衡
四、化学平衡移动
1.化学平衡移动与化学反应速率的关系
①v正>v逆:平衡向正反应方向移动。
②v正=v逆:反应达到平衡状态,平衡不发生移动。
③v正2.外界因素对化学平衡的影响
①勒夏特列原理:如果改变影响化学平衡的条件之一(温度、压强,以及参加反应的化学物质的浓度等),平衡将向着能够减弱这种改变的方向移动。
②影响化学平衡的外界因素
在一定条件下,aA(g)+bB(g)mC(g) ΔH<0 达到平衡后,若其他条件不变,改变一定条件,对平衡的影响如下:
改变的条件(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强(对气体存在的反应) a+b≠m 增大压强 向气体总体积减小的方向移动
减小压强 向气体总体积增大的方向移动
a+b=m 改变压强 平衡不移动
温度 升高温度 向吸热(逆反应)方向移动
降低温度 向放热(正反应)方向移动
催化剂 使用催化剂 平衡不移动
③几种特殊情况说明
A.改变固体或纯液体的量,对化学平衡没有影响。
B.“惰性气体”对化学平衡的影响
C.同等程度地改变反应混合物中各物质的浓度时,可视为压强的影响。
D.改变温度,平衡一定移动;对气体加压(缩小体积)无论平衡是否移动,各气体浓度均增大,反之亦然。
五、化学平衡常数
1.化学平衡常数
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂
之积的比值是一个常数,这个常数就是该反应的化学平衡常数,用符号K表示。对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下达到平衡时,。(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)
2.压强平衡常数
①对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下,达到平衡时,其压强平衡常数Kp可表示为:。(Kp只与温度有关)
②P(C)、P(D)、P(A)、P(B)表示生成物和反应物的分压:
。
3.意义
①K值越大,反应物的转化率越高,正反应进行的程度越大。
②K只受温度影响,与反应物或生成物的浓度(或压强)变化无关。
③化学平衡常数是指某一具体反应的平衡常数。
六、反应进行的方向
1.自发过程
①含义:在一定条件下,不用借助_外力_就可以自动进行的过程。
②特点
2.熵
①熵是量度体系混乱或无序程度的物理量,符号为S。
②影响熵大小的因素
相同条件下,物质不同,熵不同。 同一物质:S(g)> S(l)>S(s)。
③熵变(ΔS)=生成物的总熵-反应物的总熵。
3.化学反应方向的判据
一、化学反应速率
1.化学反应速率的概念及表示方法
(1)化学反应速率一般指平均速率而不是某一时刻的瞬时速率,且无论用反应物还是用生成物表示均取正值;
(2)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同;
(3)不能用固体或纯液体物质表示化学反应速率,因为固体或纯液体物质的浓度视为常数。
2.与化学方程式中化学计量数的关系
对于已知反应mA(g)+nB(g) ==== pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于方程式中各物质的化学计量数之比,v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q。
二、影响化学反应速率的因素
1.内因:反应物本身的性质如Na、Mg、Al与水反应的速率由大到小的顺序为Na>Mg>Al。
2.外因
3.理论解释——有效碰撞
(1)活化分子、活化能、有效碰撞
①活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
②活化能:活化分子的平均能量与所有分子的平均能量之差。
上图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
三、化学平衡状态
2.化学平衡状态
①概念:在一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。
②特点
③判断化学平衡状态的方法
列举反应 mA(g)+nB(g)pC(g)+qD(g) 是否平衡状态
混合物体系中各成分的量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
③各气体的体积或体积分数一定 平衡
④总体积、总压强、总物质的量、总浓度一定 不一定平衡
正反应速率与逆反应速率的关系 ①在单位时间内消耗了m mol A,同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B,同时消耗了p mol C,即v正=v逆 平衡
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q,v正不一定等于v逆 不一定平衡
④在单位时间内生成n mol B,同时消耗了q mol D, v正不一定等于v逆 不一定平衡
压强 ①若m+n≠p+q,总压强一定(其他条件一定) 平衡
②若m+n=p+q,总压强一定(其他条件不变) 不一定平衡
混合气体的平均相对分子质量(Mr) ①Mr一定,m+n≠p+q 平衡
②Mr一定,m+n=p+q 不一定平衡
温度 任何化学反应都伴随着能量的变化,当体系温度一定时(其他条件不变) 平衡
颜色 颜色不再变化 平衡
体系的密度(ρ) 密度一定 不一定平衡
四、化学平衡移动
1.化学平衡移动与化学反应速率的关系
①v正>v逆:平衡向正反应方向移动。
②v正=v逆:反应达到平衡状态,平衡不发生移动。
③v正
①勒夏特列原理:如果改变影响化学平衡的条件之一(温度、压强,以及参加反应的化学物质的浓度等),平衡将向着能够减弱这种改变的方向移动。
②影响化学平衡的外界因素
在一定条件下,aA(g)+bB(g)mC(g) ΔH<0 达到平衡后,若其他条件不变,改变一定条件,对平衡的影响如下:
改变的条件(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强(对气体存在的反应) a+b≠m 增大压强 向气体总体积减小的方向移动
减小压强 向气体总体积增大的方向移动
a+b=m 改变压强 平衡不移动
温度 升高温度 向吸热(逆反应)方向移动
降低温度 向放热(正反应)方向移动
催化剂 使用催化剂 平衡不移动
③几种特殊情况说明
A.改变固体或纯液体的量,对化学平衡没有影响。
B.“惰性气体”对化学平衡的影响
C.同等程度地改变反应混合物中各物质的浓度时,可视为压强的影响。
D.改变温度,平衡一定移动;对气体加压(缩小体积)无论平衡是否移动,各气体浓度均增大,反之亦然。
五、化学平衡常数
1.化学平衡常数
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂
之积的比值是一个常数,这个常数就是该反应的化学平衡常数,用符号K表示。对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下达到平衡时,。(固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中)
2.压强平衡常数
①对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下,达到平衡时,其压强平衡常数Kp可表示为:。(Kp只与温度有关)
②P(C)、P(D)、P(A)、P(B)表示生成物和反应物的分压:
。
3.意义
①K值越大,反应物的转化率越高,正反应进行的程度越大。
②K只受温度影响,与反应物或生成物的浓度(或压强)变化无关。
③化学平衡常数是指某一具体反应的平衡常数。
六、反应进行的方向
1.自发过程
①含义:在一定条件下,不用借助_外力_就可以自动进行的过程。
②特点
2.熵
①熵是量度体系混乱或无序程度的物理量,符号为S。
②影响熵大小的因素
相同条件下,物质不同,熵不同。 同一物质:S(g)> S(l)>S(s)。
③熵变(ΔS)=生成物的总熵-反应物的总熵。
3.化学反应方向的判据
同课章节目录
