(4)非金属及其化合物—高考化学一轮复习大单元知识清单
文档属性
| 名称 | (4)非金属及其化合物—高考化学一轮复习大单元知识清单 |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-03-17 14:33:48 | ||
图片预览


文档简介
(4)非金属及其化合物—高考化学一轮复习大单元知识清单
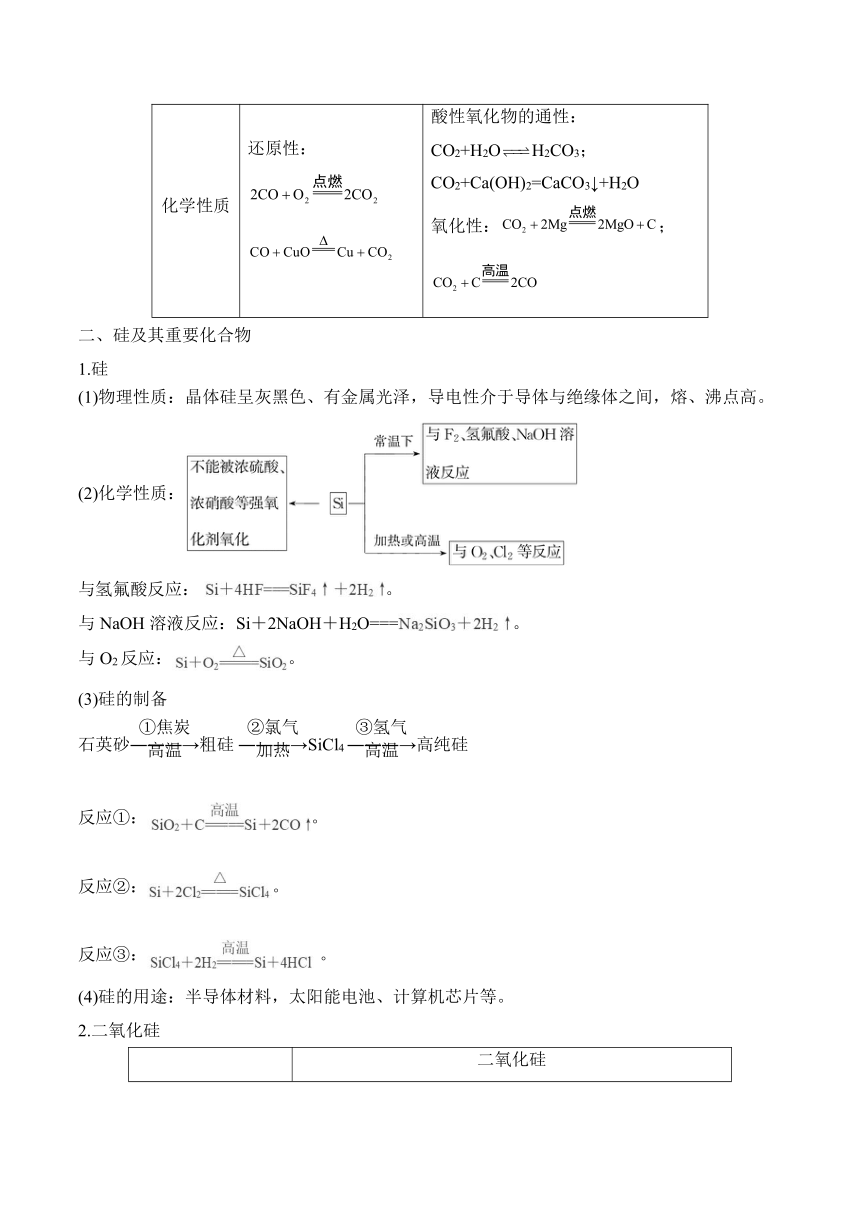
一、碳及其重要化合物
1. 碳单质
种类 主要有金刚石、石墨、C60、富勒烯等
结构 金刚石:正四面体空间网状结构;石墨:平面正六边层状结构
物理性质 金刚石:熔点高,硬度大、不导电;石墨:熔点高,质软、有滑腻感,能导电
化学性质 与O2反应 O2充足时: O2不足时:
与氧化物反应 CuO: SiO2: H2O:
与强氧化性酸反应 浓硫酸:
用途 金刚石:用作切削刀具、装饰品等;作电极、高温润滑剂、铅笔芯等
一氧化碳和二氧化碳
物质 CO CO2
物理性质 无色气体、有毒、难溶于水 无色无味的气体,能溶于水,固态CO2俗称干冰
化学性质 还原性: 酸性氧化物的通性:CO2+H2OH2CO3; CO2+Ca(OH)2=CaCO3↓+H2O 氧化性:;
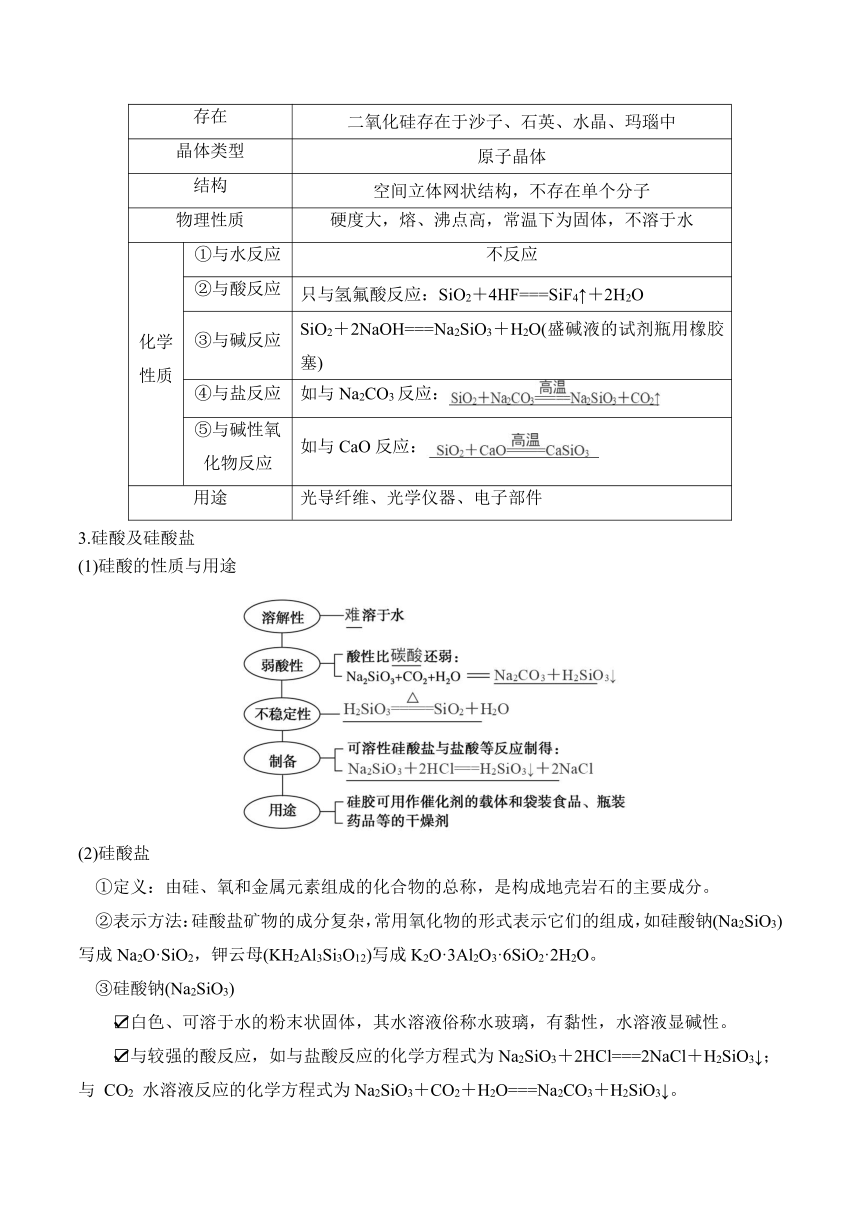
二、硅及其重要化合物
1.硅
(1)物理性质:晶体硅呈灰黑色、有金属光泽,导电性介于导体与绝缘体之间,熔、沸点高。
(2)化学性质:
与氢氟酸反应:。
与NaOH溶液反应:Si+2NaOH+H2O===。
与O2反应:。
(3)硅的制备
石英砂粗硅SiCl4高纯硅
反应①:。
反应②:。
反应③:。
(4)硅的用途:半导体材料,太阳能电池、计算机芯片等。
2.二氧化硅
二氧化硅
存在 二氧化硅存在于沙子、石英、水晶、玛瑙中
晶体类型 原子晶体
结构 空间立体网状结构,不存在单个分子
物理性质 硬度大,熔、沸点高,常温下为固体,不溶于水
化学性质 ①与水反应 不反应
②与酸反应 只与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O
③与碱反应 SiO2+2NaOH===Na2SiO3+H2O(盛碱液的试剂瓶用橡胶塞)
④与盐反应 如与Na2CO3反应:
⑤与碱性氧化物反应 如与CaO反应:
用途 光导纤维、光学仪器、电子部件
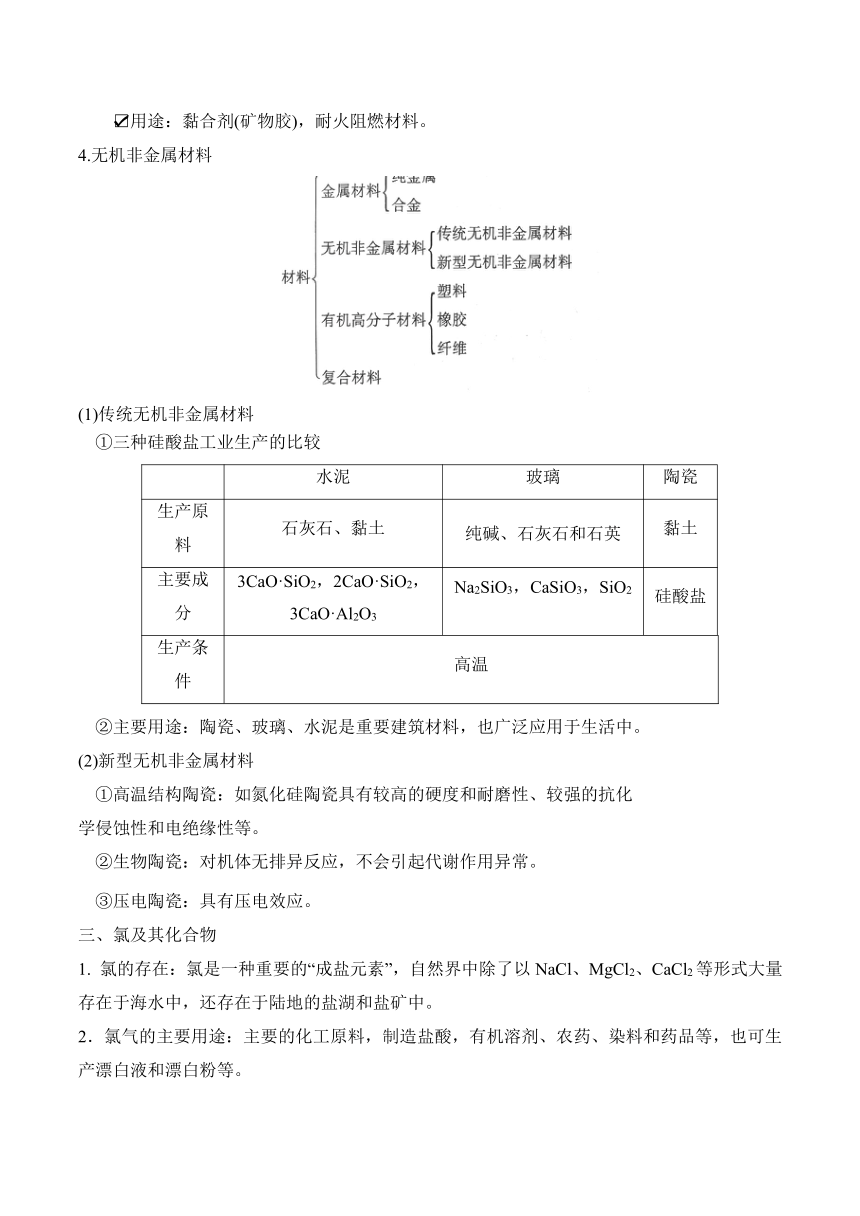
3.硅酸及硅酸盐
(1)硅酸的性质与用途
(2)硅酸盐
①定义:由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的主要成分。
②表示方法:硅酸盐矿物的成分复杂,常用氧化物的形式表示它们的组成,如硅酸钠(Na2SiO3)写成Na2O·SiO2,钾云母(KH2Al3Si3O12)写成K2O·3Al2O3·6SiO2·2H2O。
③硅酸钠(Na2SiO3)
白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
与较强的酸反应,如与盐酸反应的化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3↓;与 CO2 水溶液反应的化学方程式为Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
用途:黏合剂(矿物胶),耐火阻燃材料。
4.无机非金属材料
(1)传统无机非金属材料
①三种硅酸盐工业生产的比较
水泥 玻璃 陶瓷
生产原料 石灰石、黏土 纯碱、石灰石和石英 黏土
主要成分 3CaO·SiO2,2CaO·SiO2, 3CaO·Al2O3 Na2SiO3,CaSiO3,SiO2 硅酸盐
生产条件 高温
②主要用途:陶瓷、玻璃、水泥是重要建筑材料,也广泛应用于生活中。
(2)新型无机非金属材料
①高温结构陶瓷:如氮化硅陶瓷具有较高的硬度和耐磨性、较强的抗化
学侵蚀性和电绝缘性等。
②生物陶瓷:对机体无排异反应,不会引起代谢作用异常。
③压电陶瓷:具有压电效应。
三、氯及其化合物
1. 氯的存在:氯是一种重要的“成盐元素”,自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
2.氯气的主要用途:主要的化工原料,制造盐酸,有机溶剂、农药、染料和药品等,也可生产漂白液和漂白粉等。
3. 氯气的物理性质:Cl2是黄绿色、有刺激性气味的气体,有毒,熔点为-101℃,沸点为-34.6 ℃,密度为3.214 g·L-1,比空气的密度大。25 ℃时,1体积水可溶解2体积Cl2,其水溶液称为氯水。
4. 氯气的化学性质
(1)与金属单质的反应
化学方程式 反应现象
与钠反应 2Na+Cl22NaCl 产生大量白烟
与铁反应 2Fe+3Cl22FeCl3 产生大量棕褐色烟
与铜反应 Cu+Cl2CuCl2 产生大量棕黄色烟
(2)氯气与非金属单质的反应
在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中。
现象:氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
化学方程式:H2+Cl22HCl。
(3)氯气与水的反应
溶于水的氯气部分与水发生反应,化学方程式为Cl2+H2O═HCl+HClO。次氯酸具有强氧化性,能杀死水中的病菌,起到消毒的作用。
(4)氯气与碱的反应
与氢氧化钠溶液反应——制取漂白液
①制取反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O。
②漂白液的有效成分是次氯酸钠。
与石灰乳反应——制取漂白粉
①制取反应的化学方程式:2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
②漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2。
漂白液中的NaClO在空气中会与空气中的CO2作用生成HClO。HClO见光易分解为HCl和O2,因此漂白液最终会变成含有NaCl、HCl的溶液。漂白粉则会变成含有CaCl2和CaCO3的混合物。保存时应注意密封、避光。
新制氯水、久置氯水、液氯的比较
新制氯水 久置氯水 液氯
成分 (1)三种分子:Cl2、HClO、H2O (2)四种离子:H+、Cl-、ClO-、OH- H+、OH-、Cl-、H2O Cl2
颜色 浅黄绿色 无色 黄绿色
性质 酸性、氧化性、漂白性 酸性 Cl2的性质
保存 棕色瓶盛装,置于阴暗处 — 低温密封
氯气的实验室制法
(1)反应原理:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(2)由于氯气的密度大于空气的密度,所以可采用向上排空气法收集氯气。
(3)由于氯气有毒,所以应用NaOH溶液吸收尾气,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O。
【实验拓展】
常见的气体发生装置
常见的除杂装置——用于除去气体中的杂质气体
常见的气体收集装置
尾气处理装置
①点燃法:如CO、H2、CH4等易燃性气体,可用此法。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
③转化法:采用一定的方法,使有毒气体转化为无毒气体后再排放,如NO、NO2若能转化为N2,即可排放。
检验氯离子方法:取少量待测液加入试管中,先加入足量的稀硝酸酸化,再滴加硝酸 银溶液,有白色沉淀产生。
卤素单质及其化合物的特殊性
氟 ①无正价,氧化性最强,F-的还原性最弱 ②2F2+2H2O===4HF+O2,与H2反应在暗处即爆炸 ③HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;有毒;在HX中沸点最高(由于分子间存在氢键)
溴 ①Br2是深红棕色液体,易挥发 ②Br2易溶于有机溶剂 ③盛溴的试剂瓶中加水,进行水封,保存液溴时不能用橡胶塞
碘 ①I2遇淀粉变蓝色 ②I2加热时易升华 ③I2易溶于有机溶剂 ④食用盐中加入KIO3可防治甲状腺肿大 ⑤I2易与Na2S2O3溶液反应:I2+2S2O===2I-+S4O,可通过滴定(以淀粉为指示剂)来定量测定碘的含量
卤素离子的检验
(1)AgNO3 溶液和稀硝酸——沉淀法
(2)置换——萃取法
(3)氧化——淀粉法
四、硫及其化合物
1. 硫在元素周期表中的位置:第三周期 第Ⅵ A族
2. 硫的物理性质
颜色 状态 密度 熔点 沸点 溶解度
黄色 固体,质脆 2.06 g·cm-3 113 ℃ 445 ℃ 难溶于水 微溶于酒精 易溶于CS2
【应用】因为硫易溶于CS2,常用CS2清洗试管内壁上附着的硫单质。
硫的化学性质
二氧化硫的物理性质
状态 颜色 气味 沸点 毒性 密度 溶解度
气体 无色 有刺激性 -10℃ 有毒 比空气大 易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2
二氧化硫的化学性质
(1)与水反应:SO2+H2O H2SO3
(2)与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O;CaSO3+SO2+H2O=Ca(HSO3)2
(3)与NaOH反应:SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3
(4)还原性:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O=H2SO4+2HBr
(5)氧化性: SO2+2H2S=3S↓+2H2O
6. 二氧化硫的特性——漂白性
向品红溶液中通入SO2气体,品红溶液褪色,加热后恢复原色。
【拓展】常见漂白剂的漂白原理比较
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
7. SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2=CaSO3↓+H2O CaSO3+SO2+H2O=Ca(HSO3)2 Ca(OH)2+CO2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
稀硫酸具有酸的通性,溶于水完全电离: H2SO4=2H++SO42-。
浓硫酸的物理性质:无色、黏稠的液体,易溶于水且溶于水时放出大量的热。
【应用】稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
浓硫酸的特性
(1)吸水性:浓硫酸能吸收存在于周围环境中的水分,故常用作干燥剂。
(2)脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元素按水的组成比脱去。
【深化辨析】浓硫酸吸水性、脱水性的区别
→
→
由此看出:二者的根本区别在于物质本身是否存在水分子。
强氧化性:能氧化大多数金属单质和部分非金属单质。
①常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸浓度变小后,生成的气体为H2。
②与较不活泼金属反应:金属+浓硫酸高价态硫酸盐+SO2↑+H2O
a.反应需要加热(否则不反应);
b.浓硫酸的还原产物是SO2。
③与非金属反应:非金属单质+浓硫酸高价态氧化物+SO2↑+H2O
④与还原性物质反应:浓硫酸具有强氧化性,能将还原性物质(如H2S、HI、HBr)氧化。
【应用】浓硫酸不能干燥碱性气体(如NH3等)和强还原性的气体(如H2S等)。但CO、H2等还原性气体不与浓硫酸反应,可以用浓硫酸干燥。
【拓展】浓、稀硫酸的鉴别方法
现象
浓H2SO4 稀H2SO4
物理性质 加入水中 放出大量热 无明显现象
观察状态 黏稠状液体 黏稠度较小的液体
密度 浓H2SO4密度较大,相同体积时,浓H2SO4质量大
化学性质 铁片 因铁被钝化而无明显现象 产生大量气泡
铜片(加热) 有气泡产生,溶液变蓝 无明显现象
白纸 立即变黑 无明显现象
胆矾 蓝色变为白色 无颜色变化
硫酸根离子的检验:先将溶液用盐酸酸化,然后加入BaCl2溶液,若产生白色沉淀,则存在硫酸根离子。
自然界中不同价态硫元素间的转化
硫的化合价与性质的关系
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
五、氮及其化合物
1.氮元素的存在与氮的固定
2.氮气结构、性质及用途
N2的电子式为,结构式N≡N。
①N2+3MgMg3N2,N2表现氧化性。
②N2+3H22NH3,N2表现氧化性。
③N2+O22NO,N2表现还原性。
氮气的用途:合成氨;制硝酸;用作保护气;保存农副产品;液氮可作冷冻剂。
3.NO与NO2
(1)物理性质
物质 颜色、状态 气味 毒性 水溶性
NO 无色气体 无味 有毒 不溶于水
NO2 红棕色气体 有刺激性气味 有毒 易溶于水
(2)化学性质
①NO在空气中易转化为红棕色的NO2,反应方程式为2NO+O2==2NO2。
②NO2与H2O反应生成HNO3和NO,反应方程式为3NO2+H2O==2HNO3+NO。
【拓展】氮的氧化物溶于水的计算方法
(1)NO2和O2的混合气体溶于水时涉及反应:4NO2+O2+2H2O==4HNO3,计算如下表:
(2)NO和O2的混合气体溶于水时涉及反应:4NO+3O2+2H2O==4HNO3,计算如下表:
4.氨的结构和物理性质
电子式 密度 气味 水溶性
比空气小 强烈刺激性气味 极易溶于水(1∶700)
5.氨的化学性质:
(1)与水反应:NH3+H2ONH3·H2O+OH-。
①氨水:氨气溶于水得氨水。
②氨水中含有的微粒有:NH3·H2O、NH3、H2O、、OH-、H+。
③NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝。
④氨水不稳定,易分解,化学方程式为NH3·H2ONH3↑+H2O
(2)与酸反应:
①浓氨水挥发出的NH3与浓盐酸挥发出的HCl相遇形成白烟,即NH4Cl晶体小颗粒,其反应的方程式为NH3+HCl==NH4Cl。
②氨通入稀硫酸中反应的离子方程式为NH3+H+===NH。
(3)与盐溶液反应
盐溶液 现象 离子方程式
FeCl3溶液 生成红褐色沉淀 Fe3++3NH3·H2O===Fe(OH)3↓+3
AlCl3溶液 生成白色沉淀 Cu2++2NH3·H2O===Cu(OH)2↓+2
(4)氨的催化氧化
氨催化氧化制HNO3的系列反应方程式依次为4NH3+5O24NO+6H2O,2NO+O2===2NO2,3NO2+H2O===2HNO3+NO。
6.实验室制氨气
【注意】氨气实验室制法的注意事项
(1)实验室用固体铵盐与碱共热制NH3时 , 不能使用NH4HCO3、NH4NO3 及NaOH固体,因为NH4HCO3受热分解产生CO2,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。
(2)干燥氨气时不能选用酸性干燥剂,如浓硫酸、P2O5 等,也不能选用无水CaCl2,因为它们均能与NH3发生反应,通常选用碱石灰。
(3)吸收氨气(或 HCl)时要注意防止倒吸。可用于吸收氨气(或 HCl)并能防倒吸的常用装置为:
【拓展】实验室制取氨气的其他方法
7.铵盐
(1)铵盐的物理性质:铵盐都是易溶于水的白色晶体。
(2)铵盐的化学性质:
(3)检验NH:待测液中加NaOH溶液并加热,用湿润的红色石蕊试纸放置于试管口,若试纸变蓝,说明溶液中含NH。
8.硝酸
(1)物理性质:硝酸是无色挥发的液体,有刺激性气味。
(2)化学性质
①不稳定性反应:4HNO32H2O+4NO2↑+O2↑。
②强氧化性:硝酸有强氧化性,而且浓度越大,氧化性越强。
a.与金属反应
稀硝酸与铜反应:;
浓硝酸与铜反应:。
b.与非金属反应
浓硝酸与C的反应:。
c.与还原性物质反应:
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。稀硝酸与FeSO4溶液反应的离子方程式:。
(3)与有机物反应
①硝化反应(与反应):。
②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
一、碳及其重要化合物
1. 碳单质
种类 主要有金刚石、石墨、C60、富勒烯等
结构 金刚石:正四面体空间网状结构;石墨:平面正六边层状结构
物理性质 金刚石:熔点高,硬度大、不导电;石墨:熔点高,质软、有滑腻感,能导电
化学性质 与O2反应 O2充足时: O2不足时:
与氧化物反应 CuO: SiO2: H2O:
与强氧化性酸反应 浓硫酸:
用途 金刚石:用作切削刀具、装饰品等;作电极、高温润滑剂、铅笔芯等
一氧化碳和二氧化碳
物质 CO CO2
物理性质 无色气体、有毒、难溶于水 无色无味的气体,能溶于水,固态CO2俗称干冰
化学性质 还原性: 酸性氧化物的通性:CO2+H2OH2CO3; CO2+Ca(OH)2=CaCO3↓+H2O 氧化性:;
二、硅及其重要化合物
1.硅
(1)物理性质:晶体硅呈灰黑色、有金属光泽,导电性介于导体与绝缘体之间,熔、沸点高。
(2)化学性质:
与氢氟酸反应:。
与NaOH溶液反应:Si+2NaOH+H2O===。
与O2反应:。
(3)硅的制备
石英砂粗硅SiCl4高纯硅
反应①:。
反应②:。
反应③:。
(4)硅的用途:半导体材料,太阳能电池、计算机芯片等。
2.二氧化硅
二氧化硅
存在 二氧化硅存在于沙子、石英、水晶、玛瑙中
晶体类型 原子晶体
结构 空间立体网状结构,不存在单个分子
物理性质 硬度大,熔、沸点高,常温下为固体,不溶于水
化学性质 ①与水反应 不反应
②与酸反应 只与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O
③与碱反应 SiO2+2NaOH===Na2SiO3+H2O(盛碱液的试剂瓶用橡胶塞)
④与盐反应 如与Na2CO3反应:
⑤与碱性氧化物反应 如与CaO反应:
用途 光导纤维、光学仪器、电子部件
3.硅酸及硅酸盐
(1)硅酸的性质与用途
(2)硅酸盐
①定义:由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的主要成分。
②表示方法:硅酸盐矿物的成分复杂,常用氧化物的形式表示它们的组成,如硅酸钠(Na2SiO3)写成Na2O·SiO2,钾云母(KH2Al3Si3O12)写成K2O·3Al2O3·6SiO2·2H2O。
③硅酸钠(Na2SiO3)
白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
与较强的酸反应,如与盐酸反应的化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3↓;与 CO2 水溶液反应的化学方程式为Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
用途:黏合剂(矿物胶),耐火阻燃材料。
4.无机非金属材料
(1)传统无机非金属材料
①三种硅酸盐工业生产的比较
水泥 玻璃 陶瓷
生产原料 石灰石、黏土 纯碱、石灰石和石英 黏土
主要成分 3CaO·SiO2,2CaO·SiO2, 3CaO·Al2O3 Na2SiO3,CaSiO3,SiO2 硅酸盐
生产条件 高温
②主要用途:陶瓷、玻璃、水泥是重要建筑材料,也广泛应用于生活中。
(2)新型无机非金属材料
①高温结构陶瓷:如氮化硅陶瓷具有较高的硬度和耐磨性、较强的抗化
学侵蚀性和电绝缘性等。
②生物陶瓷:对机体无排异反应,不会引起代谢作用异常。
③压电陶瓷:具有压电效应。
三、氯及其化合物
1. 氯的存在:氯是一种重要的“成盐元素”,自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
2.氯气的主要用途:主要的化工原料,制造盐酸,有机溶剂、农药、染料和药品等,也可生产漂白液和漂白粉等。
3. 氯气的物理性质:Cl2是黄绿色、有刺激性气味的气体,有毒,熔点为-101℃,沸点为-34.6 ℃,密度为3.214 g·L-1,比空气的密度大。25 ℃时,1体积水可溶解2体积Cl2,其水溶液称为氯水。
4. 氯气的化学性质
(1)与金属单质的反应
化学方程式 反应现象
与钠反应 2Na+Cl22NaCl 产生大量白烟
与铁反应 2Fe+3Cl22FeCl3 产生大量棕褐色烟
与铜反应 Cu+Cl2CuCl2 产生大量棕黄色烟
(2)氯气与非金属单质的反应
在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中。
现象:氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
化学方程式:H2+Cl22HCl。
(3)氯气与水的反应
溶于水的氯气部分与水发生反应,化学方程式为Cl2+H2O═HCl+HClO。次氯酸具有强氧化性,能杀死水中的病菌,起到消毒的作用。
(4)氯气与碱的反应
与氢氧化钠溶液反应——制取漂白液
①制取反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O。
②漂白液的有效成分是次氯酸钠。
与石灰乳反应——制取漂白粉
①制取反应的化学方程式:2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
②漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2。
漂白液中的NaClO在空气中会与空气中的CO2作用生成HClO。HClO见光易分解为HCl和O2,因此漂白液最终会变成含有NaCl、HCl的溶液。漂白粉则会变成含有CaCl2和CaCO3的混合物。保存时应注意密封、避光。
新制氯水、久置氯水、液氯的比较
新制氯水 久置氯水 液氯
成分 (1)三种分子:Cl2、HClO、H2O (2)四种离子:H+、Cl-、ClO-、OH- H+、OH-、Cl-、H2O Cl2
颜色 浅黄绿色 无色 黄绿色
性质 酸性、氧化性、漂白性 酸性 Cl2的性质
保存 棕色瓶盛装,置于阴暗处 — 低温密封
氯气的实验室制法
(1)反应原理:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(2)由于氯气的密度大于空气的密度,所以可采用向上排空气法收集氯气。
(3)由于氯气有毒,所以应用NaOH溶液吸收尾气,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O。
【实验拓展】
常见的气体发生装置
常见的除杂装置——用于除去气体中的杂质气体
常见的气体收集装置
尾气处理装置
①点燃法:如CO、H2、CH4等易燃性气体,可用此法。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
③转化法:采用一定的方法,使有毒气体转化为无毒气体后再排放,如NO、NO2若能转化为N2,即可排放。
检验氯离子方法:取少量待测液加入试管中,先加入足量的稀硝酸酸化,再滴加硝酸 银溶液,有白色沉淀产生。
卤素单质及其化合物的特殊性
氟 ①无正价,氧化性最强,F-的还原性最弱 ②2F2+2H2O===4HF+O2,与H2反应在暗处即爆炸 ③HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;有毒;在HX中沸点最高(由于分子间存在氢键)
溴 ①Br2是深红棕色液体,易挥发 ②Br2易溶于有机溶剂 ③盛溴的试剂瓶中加水,进行水封,保存液溴时不能用橡胶塞
碘 ①I2遇淀粉变蓝色 ②I2加热时易升华 ③I2易溶于有机溶剂 ④食用盐中加入KIO3可防治甲状腺肿大 ⑤I2易与Na2S2O3溶液反应:I2+2S2O===2I-+S4O,可通过滴定(以淀粉为指示剂)来定量测定碘的含量
卤素离子的检验
(1)AgNO3 溶液和稀硝酸——沉淀法
(2)置换——萃取法
(3)氧化——淀粉法
四、硫及其化合物
1. 硫在元素周期表中的位置:第三周期 第Ⅵ A族
2. 硫的物理性质
颜色 状态 密度 熔点 沸点 溶解度
黄色 固体,质脆 2.06 g·cm-3 113 ℃ 445 ℃ 难溶于水 微溶于酒精 易溶于CS2
【应用】因为硫易溶于CS2,常用CS2清洗试管内壁上附着的硫单质。
硫的化学性质
二氧化硫的物理性质
状态 颜色 气味 沸点 毒性 密度 溶解度
气体 无色 有刺激性 -10℃ 有毒 比空气大 易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2
二氧化硫的化学性质
(1)与水反应:SO2+H2O H2SO3
(2)与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O;CaSO3+SO2+H2O=Ca(HSO3)2
(3)与NaOH反应:SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3
(4)还原性:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O=H2SO4+2HBr
(5)氧化性: SO2+2H2S=3S↓+2H2O
6. 二氧化硫的特性——漂白性
向品红溶液中通入SO2气体,品红溶液褪色,加热后恢复原色。
【拓展】常见漂白剂的漂白原理比较
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
7. SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2=CaSO3↓+H2O CaSO3+SO2+H2O=Ca(HSO3)2 Ca(OH)2+CO2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
稀硫酸具有酸的通性,溶于水完全电离: H2SO4=2H++SO42-。
浓硫酸的物理性质:无色、黏稠的液体,易溶于水且溶于水时放出大量的热。
【应用】稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
浓硫酸的特性
(1)吸水性:浓硫酸能吸收存在于周围环境中的水分,故常用作干燥剂。
(2)脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢元素和氧元素按水的组成比脱去。
【深化辨析】浓硫酸吸水性、脱水性的区别
→
→
由此看出:二者的根本区别在于物质本身是否存在水分子。
强氧化性:能氧化大多数金属单质和部分非金属单质。
①常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸浓度变小后,生成的气体为H2。
②与较不活泼金属反应:金属+浓硫酸高价态硫酸盐+SO2↑+H2O
a.反应需要加热(否则不反应);
b.浓硫酸的还原产物是SO2。
③与非金属反应:非金属单质+浓硫酸高价态氧化物+SO2↑+H2O
④与还原性物质反应:浓硫酸具有强氧化性,能将还原性物质(如H2S、HI、HBr)氧化。
【应用】浓硫酸不能干燥碱性气体(如NH3等)和强还原性的气体(如H2S等)。但CO、H2等还原性气体不与浓硫酸反应,可以用浓硫酸干燥。
【拓展】浓、稀硫酸的鉴别方法
现象
浓H2SO4 稀H2SO4
物理性质 加入水中 放出大量热 无明显现象
观察状态 黏稠状液体 黏稠度较小的液体
密度 浓H2SO4密度较大,相同体积时,浓H2SO4质量大
化学性质 铁片 因铁被钝化而无明显现象 产生大量气泡
铜片(加热) 有气泡产生,溶液变蓝 无明显现象
白纸 立即变黑 无明显现象
胆矾 蓝色变为白色 无颜色变化
硫酸根离子的检验:先将溶液用盐酸酸化,然后加入BaCl2溶液,若产生白色沉淀,则存在硫酸根离子。
自然界中不同价态硫元素间的转化
硫的化合价与性质的关系
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
五、氮及其化合物
1.氮元素的存在与氮的固定
2.氮气结构、性质及用途
N2的电子式为,结构式N≡N。
①N2+3MgMg3N2,N2表现氧化性。
②N2+3H22NH3,N2表现氧化性。
③N2+O22NO,N2表现还原性。
氮气的用途:合成氨;制硝酸;用作保护气;保存农副产品;液氮可作冷冻剂。
3.NO与NO2
(1)物理性质
物质 颜色、状态 气味 毒性 水溶性
NO 无色气体 无味 有毒 不溶于水
NO2 红棕色气体 有刺激性气味 有毒 易溶于水
(2)化学性质
①NO在空气中易转化为红棕色的NO2,反应方程式为2NO+O2==2NO2。
②NO2与H2O反应生成HNO3和NO,反应方程式为3NO2+H2O==2HNO3+NO。
【拓展】氮的氧化物溶于水的计算方法
(1)NO2和O2的混合气体溶于水时涉及反应:4NO2+O2+2H2O==4HNO3,计算如下表:
(2)NO和O2的混合气体溶于水时涉及反应:4NO+3O2+2H2O==4HNO3,计算如下表:
4.氨的结构和物理性质
电子式 密度 气味 水溶性
比空气小 强烈刺激性气味 极易溶于水(1∶700)
5.氨的化学性质:
(1)与水反应:NH3+H2ONH3·H2O+OH-。
①氨水:氨气溶于水得氨水。
②氨水中含有的微粒有:NH3·H2O、NH3、H2O、、OH-、H+。
③NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝。
④氨水不稳定,易分解,化学方程式为NH3·H2ONH3↑+H2O
(2)与酸反应:
①浓氨水挥发出的NH3与浓盐酸挥发出的HCl相遇形成白烟,即NH4Cl晶体小颗粒,其反应的方程式为NH3+HCl==NH4Cl。
②氨通入稀硫酸中反应的离子方程式为NH3+H+===NH。
(3)与盐溶液反应
盐溶液 现象 离子方程式
FeCl3溶液 生成红褐色沉淀 Fe3++3NH3·H2O===Fe(OH)3↓+3
AlCl3溶液 生成白色沉淀 Cu2++2NH3·H2O===Cu(OH)2↓+2
(4)氨的催化氧化
氨催化氧化制HNO3的系列反应方程式依次为4NH3+5O24NO+6H2O,2NO+O2===2NO2,3NO2+H2O===2HNO3+NO。
6.实验室制氨气
【注意】氨气实验室制法的注意事项
(1)实验室用固体铵盐与碱共热制NH3时 , 不能使用NH4HCO3、NH4NO3 及NaOH固体,因为NH4HCO3受热分解产生CO2,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。
(2)干燥氨气时不能选用酸性干燥剂,如浓硫酸、P2O5 等,也不能选用无水CaCl2,因为它们均能与NH3发生反应,通常选用碱石灰。
(3)吸收氨气(或 HCl)时要注意防止倒吸。可用于吸收氨气(或 HCl)并能防倒吸的常用装置为:
【拓展】实验室制取氨气的其他方法
7.铵盐
(1)铵盐的物理性质:铵盐都是易溶于水的白色晶体。
(2)铵盐的化学性质:
(3)检验NH:待测液中加NaOH溶液并加热,用湿润的红色石蕊试纸放置于试管口,若试纸变蓝,说明溶液中含NH。
8.硝酸
(1)物理性质:硝酸是无色挥发的液体,有刺激性气味。
(2)化学性质
①不稳定性反应:4HNO32H2O+4NO2↑+O2↑。
②强氧化性:硝酸有强氧化性,而且浓度越大,氧化性越强。
a.与金属反应
稀硝酸与铜反应:;
浓硝酸与铜反应:。
b.与非金属反应
浓硝酸与C的反应:。
c.与还原性物质反应:
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。稀硝酸与FeSO4溶液反应的离子方程式:。
(3)与有机物反应
①硝化反应(与反应):。
②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
同课章节目录
