7.1.1 认识有机化合物 课件 (共26张PPT)人教版(2019)必修二
文档属性
| 名称 | 7.1.1 认识有机化合物 课件 (共26张PPT)人教版(2019)必修二 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 16:09:54 | ||
图片预览



文档简介
(共26张PPT)
人教版高中化学必修二
第七章 有机化合物
第一节 认识有机化合物 第一课时
新知探究
目前,人们在自然界发现和人工合成的物质已经超过1亿种,其中绝大多数是有机物。
为什么有机物如此繁多?
1.定义:
有机化合物:
大多数含碳的化合物,简称有机物。
注意:CO2、CO、碳酸及其盐、硫氰化物、氰化物、碳化物(SiC)、碳的金属化合物等属于无机物。
2.组成:
除C外,还含有H、O、N、S、P、X(卤素)等
温故而知新:
新知探究
一、有机化合物中碳原子的成键特点
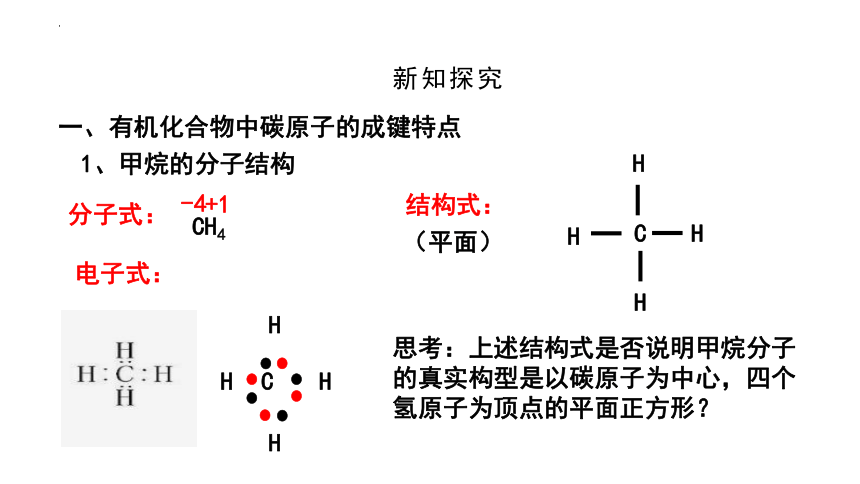
分子式:
CH4
电子式:
H
H
H
C
H
结构式:
C
H
H
H
H
+1
-4
(平面)
思考:上述结构式是否说明甲烷分子的真实构型是以碳原子为中心,四个氢原子为顶点的平面正方形?
1、甲烷的分子结构
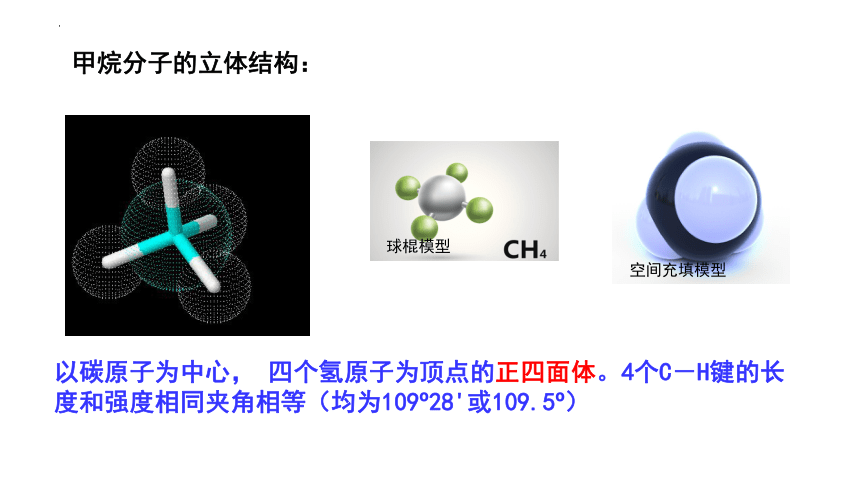
甲烷分子的立体结构:
以碳原子为中心, 四个氢原子为顶点的正四面体。4个C-H键的长度和强度相同夹角相等(均为109 28'或109.5 )
球棍模型
空间充填模型
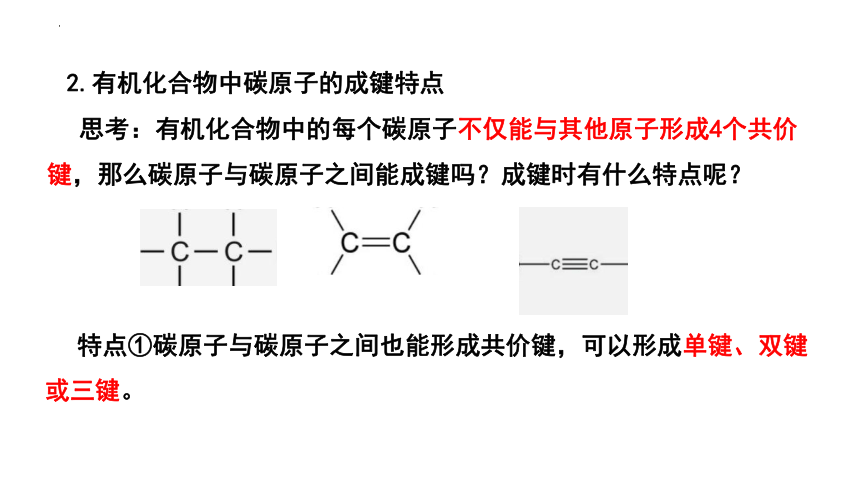
2.有机化合物中碳原子的成键特点
思考:有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,那么碳原子与碳原子之间能成键吗?成键时有什么特点呢?
特点①碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
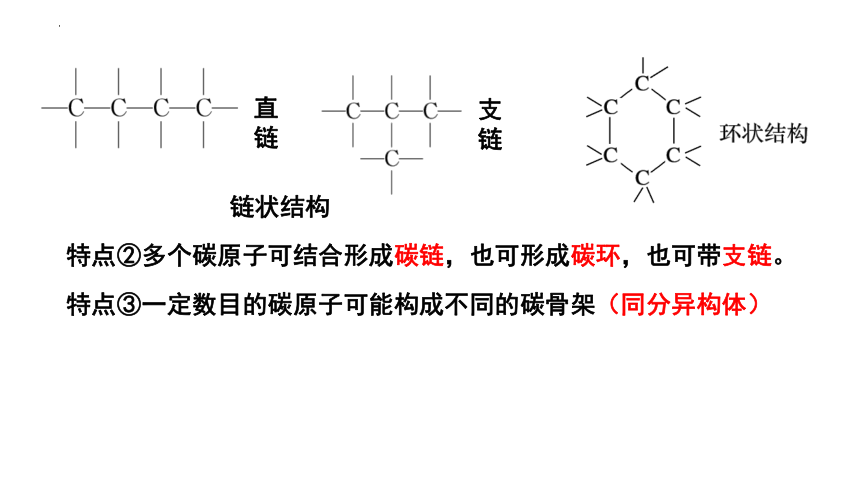
直链
支链
链状结构
特点②多个碳原子可结合形成碳链,也可形成碳环,也可带支链。
特点③一定数目的碳原子可能构成不同的碳骨架(同分异构体)
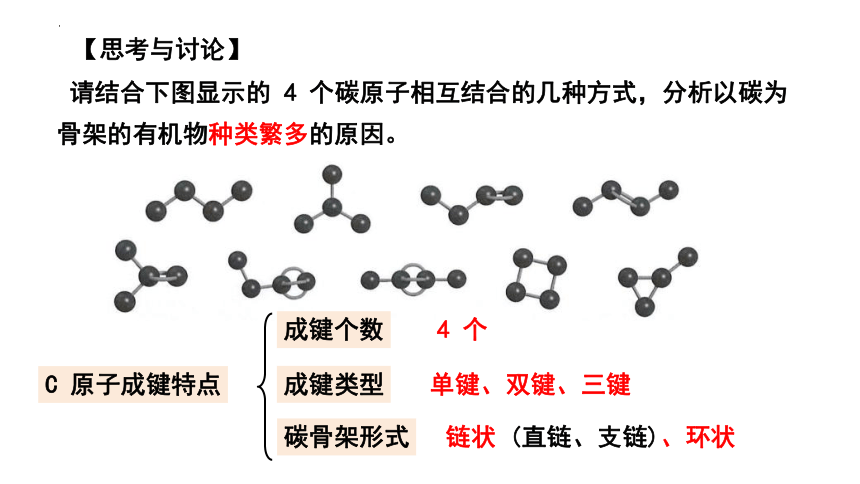
请结合下图显示的 4 个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因。
C 原子成键特点
成键类型
碳骨架形式
单键、双键、三键
链状 (直链、支链)、环状
成键个数
4 个
【思考与讨论】
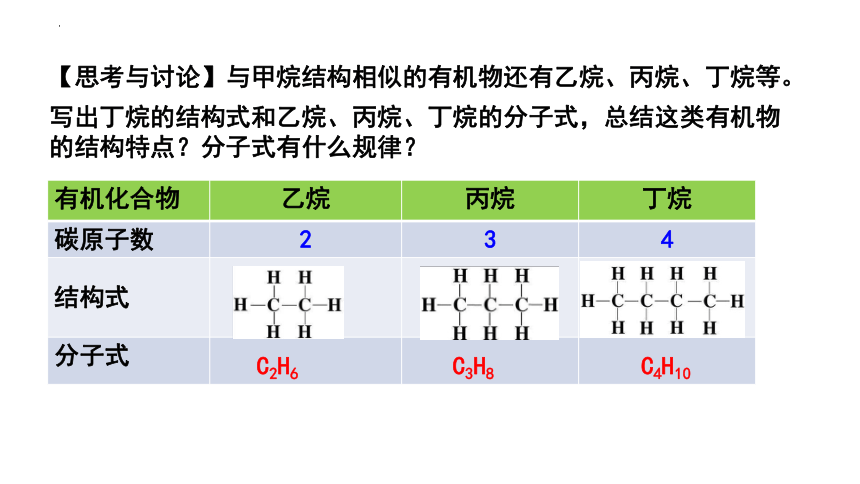
【思考与讨论】与甲烷结构相似的有机物还有乙烷、丙烷、丁烷等。
写出丁烷的结构式和乙烷、丙烷、丁烷的分子式,总结这类有机物的结构特点?分子式有什么规律?
有机化合物 乙烷 丙烷 丁烷
碳原子数 2 3 4
结构式
分子式
C2H6
C3H8
C4H10
仅含碳和氢两种元素的有机物,称为碳氢化合物,也称为烃。
烃,读音ting,碳的声母和氢的韵母的组合。
烃(通式:CxHy)
碳
tàn
氢
qīng
烃
tīng
1、定义:只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样一类有机化合物叫做饱和烃,又叫烷烃。
2、链状烷烃通式:CnH2n+2 (n≥1,n∈N)
二、烷烃:
注:①分子里碳原子均以单键结合成锯齿形链状
②碳原子成四根共价键
③只有C-C和C-H键,C-H单键和C-C单键都可以旋转。
④ 键角109°28’
3、结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体,否则就不是正四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
①分子式:
④结构式:
4、烷烃的表示方法
用元素符号和数字的组合表示物质分子组成的式子。
用短线来表示原子间的共用电子对
②最简式:
组成物质的各元素原子最简整数比。
如CH4、C2H6、C3H8、C4H10 ……
如CH4、CH3、C3H8、C2H5 ……
③电子式:
用“·”或“×”表示原子最外层电子成键情况。
⑤结构简式
书写原则:省略C-H键和直链上的 C-C 键;不能省略支链上的 C-C 键。
为了书写方便,有机物通常用结构简式表示
名称 甲烷 乙烷 丙烷 新戊烷
分子式 CH4 C2H6 C3H8 C5H12
结构式
结构 简式
CH4
CH3-CH3
CH3CH3
CH3-CH2-CH3
CH3CH2CH3
CH3
CH3CCH3
CH3
思考:根据下列有机分子的碳骨架,写出对应的结构简式。
注意:碳碳双键、三键不能省
CH3-C≡C-CH2-CH3
CH3
CH3-CH-CH2-CH3
CH3
CH3-CH-CH-CH3
CH3
CH3-C = C-CH3
CH3 CH3
5、烷烃的命名——习惯命名法
① 1-10 个 C 原子的直链烷烃:
称为 甲、乙、丙、丁、戊、己、庚、辛、壬、癸 烷
戊烷
C5H12
C8H18
辛烷
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
正戊烷
异戊烷
新戊烷
CH3
CH3 C CH3
CH3
无支链
带一支链
带二支链
② 11 个 C 原子及以上的直链烷烃:如: C11H24 称为 十一烷
③带支链的烷烃:用正、异、新表示
6、同系物:结构相似,在分子组成上相差一个或若干个 CH2 原子团的化合物互称为同系物。
属于同一类物质,具有相同的通式
分子式不同
思考:判断下列物质是否属于同系物
CH4 与 CH3(CH2)8CH3
CH2=CH2 与
CH2
CH2 CH2
CH2
CH3CH2CH2CH2CH3 与
CH3CHCH2CH3
CH3
是
是
否
否
注意:具有相同的通式不一定是同系物
CH3CH2CH3 与 CH3-CH2-CH-CH3
CH3
7、同分异构体:化合物具有相同的分子式,但具有不同结构的现
象称为同分异构体现象
具有同分异构体现象的化合物互称为同分异构体
如:正戊烷、异戊烷、新戊烷互称为同分异构体
不一定是同类物质
分子组成相同、分子量相同
分子式相同 C4H10 ,但结构不同,所以性质上存在差异。
规律:支链越多,熔沸点 、密度越低
正戊烷>异戊烷>新戊烷
CH2=CH2 与
CH2
CH2 CH2
CH2
CH3CH2CH2CH3 与
CH3CHCH3
CH3
与 CH3CHCH2CH3
CH3
CH3CH2CHCH3
CH3
CH3(CH2)3CH3 与 CH3CH2CH3
思考:判断下列物质是否属于同分异构体:
H2SO4与H3PO4
否
否
是
否
是
注意:分子量相同不一定是同分异构体
化学“四同”的比较
内容 同位素 同素异形体 同系物 同分异构体
定义 质子数相同、中子数不同的原子(核素) 由一种元素组成的不同单质 结构相似,分子组成上相差一个或若干个CH2原子团的物质 分子式相、
结构不同的化合物
对象 原子 单质 化合物 化合物
性质 化学性质几乎一样,物理性质有差异 化学性质相似,物理性质差别较大 化学性质相似,熔、沸点,密度呈规律性变化 化学性质可能相似也可能不同,物理性质不同。
实例 H、D、T 金刚石与石墨 甲烷与丙烷 正戊烷与新戊烷
思考:写出己烷C6H14所有同分异构体的结构简式
CH3CH2CH2CH2CH2CH3
烷烃同分异构体的书写原则:
主链由长到短,支链由整到散;
位置由心到边,排列由邻到间。
思考:给出一种物质,你能书写它所有的同分异构体吗?
降碳对称法
练习:写出C7H16所有的同分异构体
C-C-C-C-C-C-C
C
∣
C-C-C-C-C-C
C-C-C-C-C-C
C
∣
C
∣
C
∣
C-C-C-C-C
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C
C
∣
C
∣
C
∣
1
2
3
4
5
6
7
8
9
①定义:
烃分子失去一个氢原子的剩余基团
② 烷基: 烷烃失去一个氢原子剩余基团
常用-R表示
③烷基的通式:
CnH2n+1
乙烷
丙烷
甲烷
思考:那么乙基、丙基都有几种结构?写出其结构简式
④常见烷基的结构简式:
甲 基
-CH3
H3C-
乙 基
-C2H5
-CH2CH3
丙 基
分子式 -C3H7
-CHCH3
CH3
-CH2CH2CH3
正丙基
异丙基
补充:烃基
①同一个碳原子上的氢是等效氢
②同一碳原子上所连的甲基上的氢原子的是等效的;
同一碳原子上所连的乙基上对称位置上的氢原子的是
等效的
③处于分子中对称位置的碳上的氢原子是等效氢
判断“等效氢”的三条原则是:
补充:烃的一元取代产物同分异构体数目的判断---等效氢法
-C-
H
H
H
H
-C-
CH3
CH3
CH3
CH3
C
-C-
H
H
H
H
H
H
CH3—CH—CH—CH—CH3
l l l
CH3 CH3 CH3
4
CH3CH2CH2CH2CH3
CH3
CH3 –C – CH2- CH3
CH3
练习:下面烷烃的等效H有多少种?
3
3
CH3— C —CH3
CH3
CH3
CH3 — C — C—CH3
CH3
CH3
CH3
CH3
1
1
课堂小结
一、有机化合物中碳原子的成键特点
1、甲烷的分子结构
2.有机化合物中碳原子的成键特点
1、定义:
二、烷烃:
2、链状烷烃通式:CnH2n+2 (n≥1,n∈N)
3、结构特点:
4、烷烃的表示方法
5、烷烃的命名——习惯命名法
6、同系物:
7、同分异构体:
补充:烃基、等效氢
人教版高中化学必修二
第七章 有机化合物
第一节 认识有机化合物 第一课时
新知探究
目前,人们在自然界发现和人工合成的物质已经超过1亿种,其中绝大多数是有机物。
为什么有机物如此繁多?
1.定义:
有机化合物:
大多数含碳的化合物,简称有机物。
注意:CO2、CO、碳酸及其盐、硫氰化物、氰化物、碳化物(SiC)、碳的金属化合物等属于无机物。
2.组成:
除C外,还含有H、O、N、S、P、X(卤素)等
温故而知新:
新知探究
一、有机化合物中碳原子的成键特点
分子式:
CH4
电子式:
H
H
H
C
H
结构式:
C
H
H
H
H
+1
-4
(平面)
思考:上述结构式是否说明甲烷分子的真实构型是以碳原子为中心,四个氢原子为顶点的平面正方形?
1、甲烷的分子结构
甲烷分子的立体结构:
以碳原子为中心, 四个氢原子为顶点的正四面体。4个C-H键的长度和强度相同夹角相等(均为109 28'或109.5 )
球棍模型
空间充填模型
2.有机化合物中碳原子的成键特点
思考:有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,那么碳原子与碳原子之间能成键吗?成键时有什么特点呢?
特点①碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
直链
支链
链状结构
特点②多个碳原子可结合形成碳链,也可形成碳环,也可带支链。
特点③一定数目的碳原子可能构成不同的碳骨架(同分异构体)
请结合下图显示的 4 个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因。
C 原子成键特点
成键类型
碳骨架形式
单键、双键、三键
链状 (直链、支链)、环状
成键个数
4 个
【思考与讨论】
【思考与讨论】与甲烷结构相似的有机物还有乙烷、丙烷、丁烷等。
写出丁烷的结构式和乙烷、丙烷、丁烷的分子式,总结这类有机物的结构特点?分子式有什么规律?
有机化合物 乙烷 丙烷 丁烷
碳原子数 2 3 4
结构式
分子式
C2H6
C3H8
C4H10
仅含碳和氢两种元素的有机物,称为碳氢化合物,也称为烃。
烃,读音ting,碳的声母和氢的韵母的组合。
烃(通式:CxHy)
碳
tàn
氢
qīng
烃
tīng
1、定义:只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样一类有机化合物叫做饱和烃,又叫烷烃。
2、链状烷烃通式:CnH2n+2 (n≥1,n∈N)
二、烷烃:
注:①分子里碳原子均以单键结合成锯齿形链状
②碳原子成四根共价键
③只有C-C和C-H键,C-H单键和C-C单键都可以旋转。
④ 键角109°28’
3、结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体,否则就不是正四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
①分子式:
④结构式:
4、烷烃的表示方法
用元素符号和数字的组合表示物质分子组成的式子。
用短线来表示原子间的共用电子对
②最简式:
组成物质的各元素原子最简整数比。
如CH4、C2H6、C3H8、C4H10 ……
如CH4、CH3、C3H8、C2H5 ……
③电子式:
用“·”或“×”表示原子最外层电子成键情况。
⑤结构简式
书写原则:省略C-H键和直链上的 C-C 键;不能省略支链上的 C-C 键。
为了书写方便,有机物通常用结构简式表示
名称 甲烷 乙烷 丙烷 新戊烷
分子式 CH4 C2H6 C3H8 C5H12
结构式
结构 简式
CH4
CH3-CH3
CH3CH3
CH3-CH2-CH3
CH3CH2CH3
CH3
CH3CCH3
CH3
思考:根据下列有机分子的碳骨架,写出对应的结构简式。
注意:碳碳双键、三键不能省
CH3-C≡C-CH2-CH3
CH3
CH3-CH-CH2-CH3
CH3
CH3-CH-CH-CH3
CH3
CH3-C = C-CH3
CH3 CH3
5、烷烃的命名——习惯命名法
① 1-10 个 C 原子的直链烷烃:
称为 甲、乙、丙、丁、戊、己、庚、辛、壬、癸 烷
戊烷
C5H12
C8H18
辛烷
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
正戊烷
异戊烷
新戊烷
CH3
CH3 C CH3
CH3
无支链
带一支链
带二支链
② 11 个 C 原子及以上的直链烷烃:如: C11H24 称为 十一烷
③带支链的烷烃:用正、异、新表示
6、同系物:结构相似,在分子组成上相差一个或若干个 CH2 原子团的化合物互称为同系物。
属于同一类物质,具有相同的通式
分子式不同
思考:判断下列物质是否属于同系物
CH4 与 CH3(CH2)8CH3
CH2=CH2 与
CH2
CH2 CH2
CH2
CH3CH2CH2CH2CH3 与
CH3CHCH2CH3
CH3
是
是
否
否
注意:具有相同的通式不一定是同系物
CH3CH2CH3 与 CH3-CH2-CH-CH3
CH3
7、同分异构体:化合物具有相同的分子式,但具有不同结构的现
象称为同分异构体现象
具有同分异构体现象的化合物互称为同分异构体
如:正戊烷、异戊烷、新戊烷互称为同分异构体
不一定是同类物质
分子组成相同、分子量相同
分子式相同 C4H10 ,但结构不同,所以性质上存在差异。
规律:支链越多,熔沸点 、密度越低
正戊烷>异戊烷>新戊烷
CH2=CH2 与
CH2
CH2 CH2
CH2
CH3CH2CH2CH3 与
CH3CHCH3
CH3
与 CH3CHCH2CH3
CH3
CH3CH2CHCH3
CH3
CH3(CH2)3CH3 与 CH3CH2CH3
思考:判断下列物质是否属于同分异构体:
H2SO4与H3PO4
否
否
是
否
是
注意:分子量相同不一定是同分异构体
化学“四同”的比较
内容 同位素 同素异形体 同系物 同分异构体
定义 质子数相同、中子数不同的原子(核素) 由一种元素组成的不同单质 结构相似,分子组成上相差一个或若干个CH2原子团的物质 分子式相、
结构不同的化合物
对象 原子 单质 化合物 化合物
性质 化学性质几乎一样,物理性质有差异 化学性质相似,物理性质差别较大 化学性质相似,熔、沸点,密度呈规律性变化 化学性质可能相似也可能不同,物理性质不同。
实例 H、D、T 金刚石与石墨 甲烷与丙烷 正戊烷与新戊烷
思考:写出己烷C6H14所有同分异构体的结构简式
CH3CH2CH2CH2CH2CH3
烷烃同分异构体的书写原则:
主链由长到短,支链由整到散;
位置由心到边,排列由邻到间。
思考:给出一种物质,你能书写它所有的同分异构体吗?
降碳对称法
练习:写出C7H16所有的同分异构体
C-C-C-C-C-C-C
C
∣
C-C-C-C-C-C
C-C-C-C-C-C
C
∣
C
∣
C
∣
C-C-C-C-C
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C-C
C
∣
C
∣
C-C-C-C
C
∣
C
∣
C
∣
1
2
3
4
5
6
7
8
9
①定义:
烃分子失去一个氢原子的剩余基团
② 烷基: 烷烃失去一个氢原子剩余基团
常用-R表示
③烷基的通式:
CnH2n+1
乙烷
丙烷
甲烷
思考:那么乙基、丙基都有几种结构?写出其结构简式
④常见烷基的结构简式:
甲 基
-CH3
H3C-
乙 基
-C2H5
-CH2CH3
丙 基
分子式 -C3H7
-CHCH3
CH3
-CH2CH2CH3
正丙基
异丙基
补充:烃基
①同一个碳原子上的氢是等效氢
②同一碳原子上所连的甲基上的氢原子的是等效的;
同一碳原子上所连的乙基上对称位置上的氢原子的是
等效的
③处于分子中对称位置的碳上的氢原子是等效氢
判断“等效氢”的三条原则是:
补充:烃的一元取代产物同分异构体数目的判断---等效氢法
-C-
H
H
H
H
-C-
CH3
CH3
CH3
CH3
C
-C-
H
H
H
H
H
H
CH3—CH—CH—CH—CH3
l l l
CH3 CH3 CH3
4
CH3CH2CH2CH2CH3
CH3
CH3 –C – CH2- CH3
CH3
练习:下面烷烃的等效H有多少种?
3
3
CH3— C —CH3
CH3
CH3
CH3 — C — C—CH3
CH3
CH3
CH3
CH3
1
1
课堂小结
一、有机化合物中碳原子的成键特点
1、甲烷的分子结构
2.有机化合物中碳原子的成键特点
1、定义:
二、烷烃:
2、链状烷烃通式:CnH2n+2 (n≥1,n∈N)
3、结构特点:
4、烷烃的表示方法
5、烷烃的命名——习惯命名法
6、同系物:
7、同分异构体:
补充:烃基、等效氢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
