7.4 配合物与超分子 课件(共33张ppt)高中化学人教版(2019)必修二
文档属性
| 名称 | 7.4 配合物与超分子 课件(共33张ppt)高中化学人教版(2019)必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 13.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 15:45:37 | ||
图片预览









文档简介
(共33张PPT)
课时1
配合物
第四节 配合物与超分子
01
学习目标
CONTENT
配位键
02
配合物
03
配合物的应用
实验证明,氨分子能H+结合生成NH4+其反应式可用下列式子表示: NH3+H+=NH4+,那么NH3 是怎样与H+结合的呢?这种结合力与离子键、共价键有何异同?
1s有空轨道 氨分子有孤对电子
(一)配位键
1、定义:
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予一接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或离子,提供孤电子对的原子对应的分子或离子称为配体或配位体。
2、形成条件
中心原子或离子要有空轨道,配体中的原子要有孤电子对。
说明:
(1)孤电子对:分子或离子中,没有跟其他原子共用的电子
对就是孤电子对。如 分子中中心原子分别有1、2、3个孤电子对。含有孤电子对的微粒有哪些呢?
(2)含有空轨道的微粒:可以是阳离子或原子。你能想到哪些?
如:H+ Fe、Ni、Fe3+、Cu2+、Al3+ 、Zn2+、Ag+、Co3+、Cr3+等。过渡金属离子原子为主。
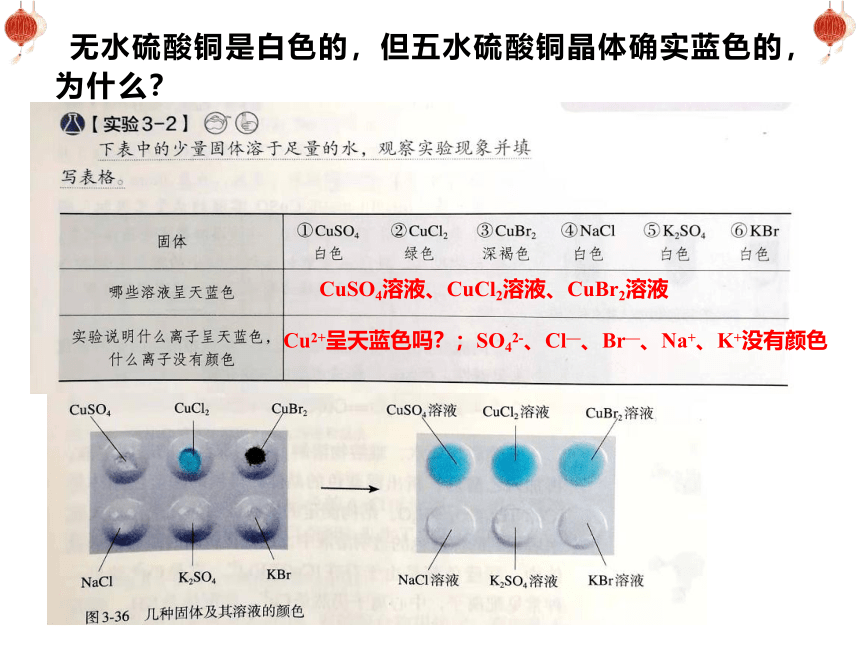
无水硫酸铜是白色的,但五水硫酸铜晶体确实蓝色的,为什么?
CuSO4溶液、CuCl2溶液、CuBr2溶液
Cu2+呈天蓝色吗?;SO42-、Cl—、Br—、Na+、K+没有颜色
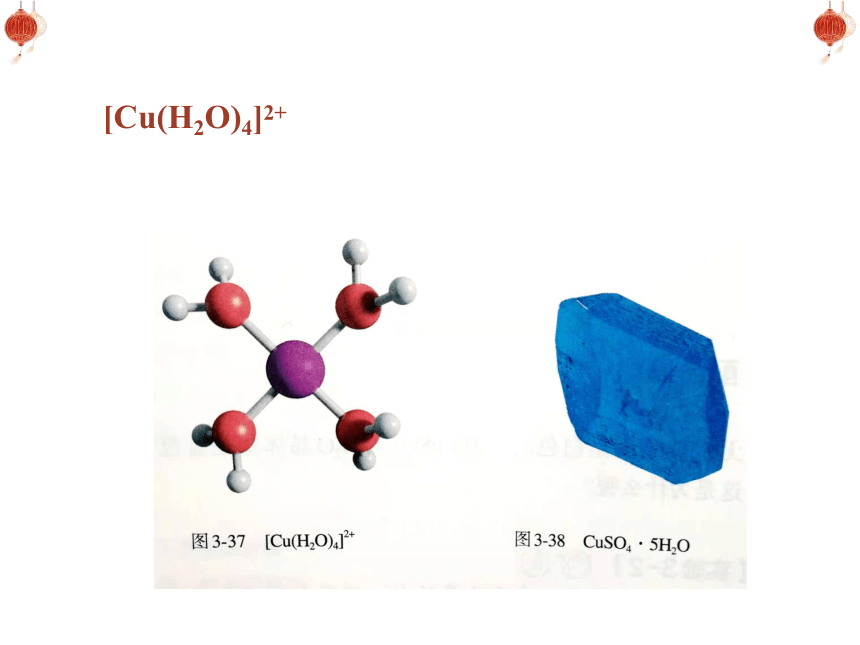
[Cu(H2O)4]2+
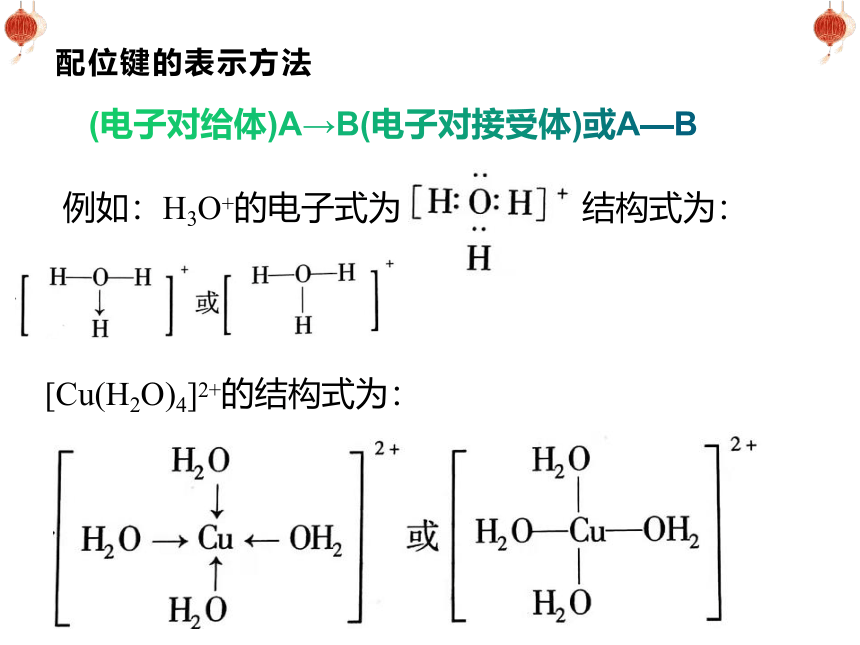
配位键的表示方法
(电子对给体)A→B(电子对接受体)或A—B
例如:H3O+的电子式为
结构式为:
[Cu(H2O)4]2+的结构式为:
说明
(1)配位键实质上是一种特殊的共价键,孤电子对是由成键原子一方提供,另一原子只提供空轨道;而普通共价键中的共用电子对是由两个成键原子共同提供的
(2)与普通共价键相似,配位键具有饱和性和方向性。
(3)与普通共价键一样,配位键可以存在于分子中[如Ni(CO)4],也可以存在于离子中(如NH4+)。
(4)相同原子间形成的配位键与它们之间形成的共价单键相同,如
中的4个N-H(键能、键长和键角)完全相同,故其结
构式也可表示为
NH4+的空间结构是正四面体形
(5)配位键一般是共价单键,属于σ键。
(二)配位化合物(简称配合物)——自学概念
1、定义
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子 (称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
如氢氧化二氨合银{[Ag(NH3)2]OH}、
硫酸四氨合铜[Cu(NH3)4]SO4}等
2、组成
配合物由中心离子或原子(提供空轨道)和配体(提供孤电子对)组成,分内界和外界。
以[Cu(NH3)4]SO4为例:
(1)中心原子(离子):提供空轨道,接受孤电子对。
(2)配体:提供孤电子对的离子或分子
(3)配位数:直接同中心原子(离子)配位的分子或离子的数目叫中心原子(离子)的配位数。如[Fe(CN)6]3—中Fe3+的配位数为6。配位数的多少和中心的电荷、半径及配体的电荷、半径有关。 (宋天佑P.365)
(4)内界和外界:配合物分为内界和外界,其中配离子称为内界,与内界发生电性匹配的离子称为外界,外界和内界以离子键相结合。
(5)配离子的电荷数:配离子的电荷数等于中心原子或离子与配体总电荷的代数和。如[Co(NH3)5Cl]n+中,中心离子为Co3+,n=2
说明:
①配合物在水溶液中电离成内界和外界两部分,如 [Co(NH3)5Cl]Cl2=[Co(NH3)5C1]2++2C1—,而内界微粒很难电离(电离程度很小),因此,配合物[Co(NH3)5C1]Cl2内界中的C1—不能被Ag+沉淀,只有外界的C1—才能与AgNO3溶液反应产生沉淀。
②有些配合物没有外界,如Ni(CO)4就无外界
(1)[Cu(NH3)4](OH)2
实验现象
反应原理
3、常见的配合物及其制取
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验3-3
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验3-3
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
实验3-4
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
实验3-5
4、配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH—、Cl—、Br—、I—、CN—的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH—
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN—形成硫氰化铁配离子,其溶液显红色。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
配合物的应用
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
二、超分子
(一)定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
(二)存在形式
超分子定义中的分子是广义的,包括离子。
(三)形成方式
说法很纷繁,有人将其概括为非共价键,有人则将其限于分子间作用力。
有的是有限的 有的是无限伸展的
超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
(四)超分子大小
(五)超分子特征
1、分子识别
2、自组装
认识“杯酚”
超分子
重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
超分子
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
b. 冠醚识别碱金属离子
重要特征及其应用——分子识别:
超分子
冠醚环的大小与金属离子匹配,才能识别
4. 重要特征及其应用——分子识别:
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) 例如:冠醚识别钾离子
超分子
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
4. 重要特征及其应用——分子识别:
超分子
4. 重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
超分子
碱金属离子或大或小,猜想冠醚是如何识别它们的?
冠醚环的大小与金属离子匹配,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
冠醚 冠醚空腔 直径/pm 适合的粒子 (直径/pm)
15-冠-5 18-冠-6 21-冠-7 170~220 260~320 340~430 Na+(204) 思考: K+ 直径为276 pm,应该选择哪种冠醚呢?
【思考与讨论】
KMnO4水溶液对烯烃氧化效果差,在烯烃中加入冠醚时,
冠醚通过与K+结合而将高锰酸根也带入烯烃中;而冠醚不与
高锰酸根结合,使游离的高锰酸根反应活性很高,从而快速
发生反应。
实例分析:高锰酸钾氧化烯烃
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子方面的诺贝尔奖
课时1
配合物
第四节 配合物与超分子
01
学习目标
CONTENT
配位键
02
配合物
03
配合物的应用
实验证明,氨分子能H+结合生成NH4+其反应式可用下列式子表示: NH3+H+=NH4+,那么NH3 是怎样与H+结合的呢?这种结合力与离子键、共价键有何异同?
1s有空轨道 氨分子有孤对电子
(一)配位键
1、定义:
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予一接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或离子,提供孤电子对的原子对应的分子或离子称为配体或配位体。
2、形成条件
中心原子或离子要有空轨道,配体中的原子要有孤电子对。
说明:
(1)孤电子对:分子或离子中,没有跟其他原子共用的电子
对就是孤电子对。如 分子中中心原子分别有1、2、3个孤电子对。含有孤电子对的微粒有哪些呢?
(2)含有空轨道的微粒:可以是阳离子或原子。你能想到哪些?
如:H+ Fe、Ni、Fe3+、Cu2+、Al3+ 、Zn2+、Ag+、Co3+、Cr3+等。过渡金属离子原子为主。
无水硫酸铜是白色的,但五水硫酸铜晶体确实蓝色的,为什么?
CuSO4溶液、CuCl2溶液、CuBr2溶液
Cu2+呈天蓝色吗?;SO42-、Cl—、Br—、Na+、K+没有颜色
[Cu(H2O)4]2+
配位键的表示方法
(电子对给体)A→B(电子对接受体)或A—B
例如:H3O+的电子式为
结构式为:
[Cu(H2O)4]2+的结构式为:
说明
(1)配位键实质上是一种特殊的共价键,孤电子对是由成键原子一方提供,另一原子只提供空轨道;而普通共价键中的共用电子对是由两个成键原子共同提供的
(2)与普通共价键相似,配位键具有饱和性和方向性。
(3)与普通共价键一样,配位键可以存在于分子中[如Ni(CO)4],也可以存在于离子中(如NH4+)。
(4)相同原子间形成的配位键与它们之间形成的共价单键相同,如
中的4个N-H(键能、键长和键角)完全相同,故其结
构式也可表示为
NH4+的空间结构是正四面体形
(5)配位键一般是共价单键,属于σ键。
(二)配位化合物(简称配合物)——自学概念
1、定义
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子 (称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
如氢氧化二氨合银{[Ag(NH3)2]OH}、
硫酸四氨合铜[Cu(NH3)4]SO4}等
2、组成
配合物由中心离子或原子(提供空轨道)和配体(提供孤电子对)组成,分内界和外界。
以[Cu(NH3)4]SO4为例:
(1)中心原子(离子):提供空轨道,接受孤电子对。
(2)配体:提供孤电子对的离子或分子
(3)配位数:直接同中心原子(离子)配位的分子或离子的数目叫中心原子(离子)的配位数。如[Fe(CN)6]3—中Fe3+的配位数为6。配位数的多少和中心的电荷、半径及配体的电荷、半径有关。 (宋天佑P.365)
(4)内界和外界:配合物分为内界和外界,其中配离子称为内界,与内界发生电性匹配的离子称为外界,外界和内界以离子键相结合。
(5)配离子的电荷数:配离子的电荷数等于中心原子或离子与配体总电荷的代数和。如[Co(NH3)5Cl]n+中,中心离子为Co3+,n=2
说明:
①配合物在水溶液中电离成内界和外界两部分,如 [Co(NH3)5Cl]Cl2=[Co(NH3)5C1]2++2C1—,而内界微粒很难电离(电离程度很小),因此,配合物[Co(NH3)5C1]Cl2内界中的C1—不能被Ag+沉淀,只有外界的C1—才能与AgNO3溶液反应产生沉淀。
②有些配合物没有外界,如Ni(CO)4就无外界
(1)[Cu(NH3)4](OH)2
实验现象
反应原理
3、常见的配合物及其制取
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
难溶物溶解,得到深蓝色的透明溶液
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
析出深蓝色晶体
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验3-3
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验3-3
实验操作 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。
实验现象
实验原理
溶液变为红色
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
配位数可为1—6
实验3-4
实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。
实验现象
实验原理
AgCl+2NH3=== [Ag(NH3)2]Cl
Ag++Cl-===AgCl↓
先产生白色沉淀,滴加氨水后白色沉淀溶解
实验3-5
4、配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH—、Cl—、Br—、I—、CN—的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH—
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN—形成硫氰化铁配离子,其溶液显红色。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒
(1) 在生命体中的应用
(2)在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
(3) 配合物与生物固氮
固氮酶
(4)在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
配合物的应用
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
二、超分子
(一)定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
(二)存在形式
超分子定义中的分子是广义的,包括离子。
(三)形成方式
说法很纷繁,有人将其概括为非共价键,有人则将其限于分子间作用力。
有的是有限的 有的是无限伸展的
超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
(四)超分子大小
(五)超分子特征
1、分子识别
2、自组装
认识“杯酚”
超分子
重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
超分子
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
b. 冠醚识别碱金属离子
重要特征及其应用——分子识别:
超分子
冠醚环的大小与金属离子匹配,才能识别
4. 重要特征及其应用——分子识别:
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) 例如:冠醚识别钾离子
超分子
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
4. 重要特征及其应用——分子识别:
超分子
4. 重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
超分子
碱金属离子或大或小,猜想冠醚是如何识别它们的?
冠醚环的大小与金属离子匹配,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
冠醚 冠醚空腔 直径/pm 适合的粒子 (直径/pm)
15-冠-5 18-冠-6 21-冠-7 170~220 260~320 340~430 Na+(204) 思考: K+ 直径为276 pm,应该选择哪种冠醚呢?
【思考与讨论】
KMnO4水溶液对烯烃氧化效果差,在烯烃中加入冠醚时,
冠醚通过与K+结合而将高锰酸根也带入烯烃中;而冠醚不与
高锰酸根结合,使游离的高锰酸根反应活性很高,从而快速
发生反应。
实例分析:高锰酸钾氧化烯烃
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子方面的诺贝尔奖
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
