1.1.1 物质的分类 课件(共23张PPT) 化学 人教版(2019)必修一
文档属性
| 名称 | 1.1.1 物质的分类 课件(共23张PPT) 化学 人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 23:04:35 | ||
图片预览






文档简介
(共23张PPT)
世界是由物质构成的,目前人类发现和合成的物质已超过 1 亿种。
对于这么多的物质和更为丰富的化学变化,人们是怎样认识和研究的呢?
物质的分类
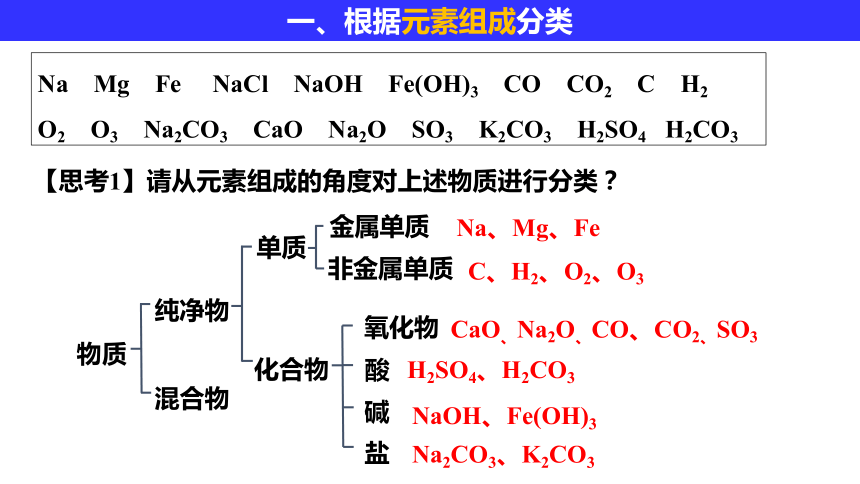
一、根据元素组成分类
网
物质
混合物
纯净物
单质
化合物
金属单质
非金属单质
Na、Mg、Fe
C、H2、O2、O3
CaO、Na2O、CO、CO2、SO3
H2SO4、H2CO3
NaOH、Fe(OH)3
Na2CO3、K2CO3
碱
盐
酸
氧化物
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
【思考1】请从元素组成的角度对上述物质进行分类?
网
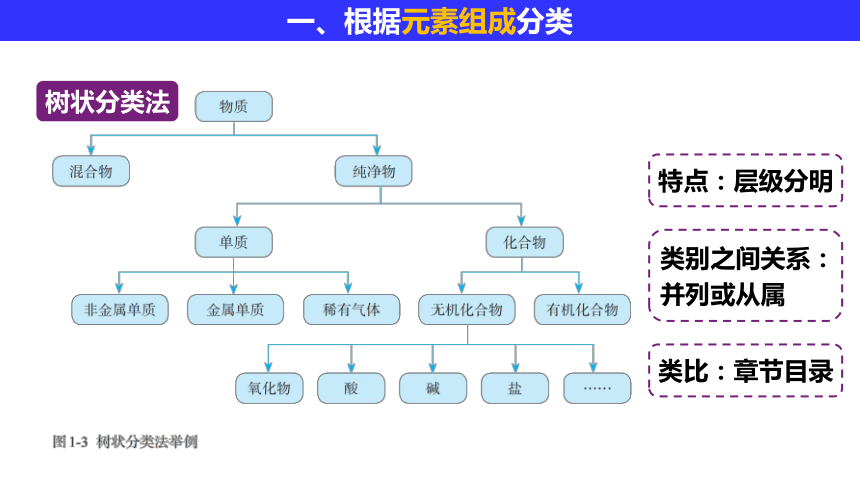
树状分类法
特点:层级分明
类别之间关系:
并列或从属
类比:章节目录
一、根据元素组成分类
网
【练习1】
⑨⑩
⑤
③
④
⑥⑦
一、根据元素组成分类
书P12
网
网
【思考2】对于上述含碳元素的物质,请根据其物质类别进行分类
单质
氧化物
酸
碱
盐
C
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
一、根据元素组成分类
网
网
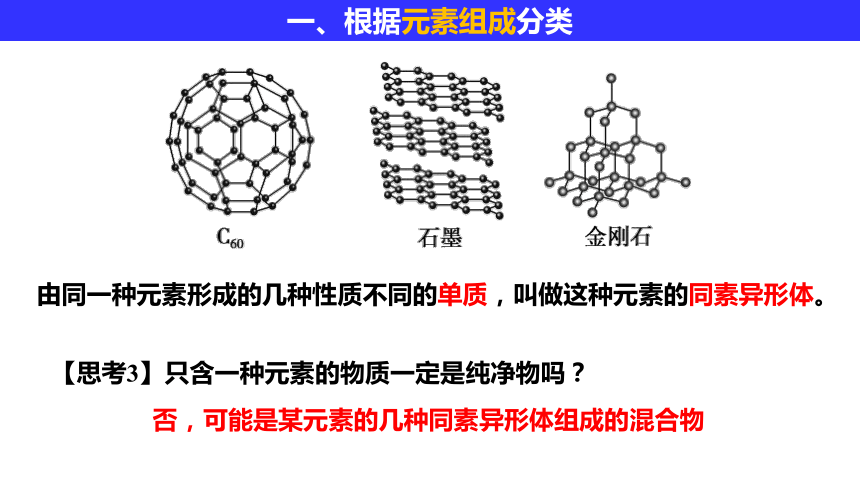
由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
【思考3】只含一种元素的物质一定是纯净物吗?
否,可能是某元素的几种同素异形体组成的混合物
一、根据元素组成分类
单质
氧化物
酸
碱
盐
C
CO
CO2
H2CO3
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
Na2CO3
K2CO3
钾盐
钠盐
碳酸盐
交叉分类法
同素异形体
【思考4】对于上述含碳元素的物质,请根据其物质类别进行分类
一、根据元素组成分类
交叉分类法
特点:交错联系
类别之间关系:
并列或交叉
可从不同的角度对物质进行分类。例如,从组成来看,Na2CO3属于盐。从其组成的阳离子来看,属于钠盐;而从其组成的阴离子来看,则属于碳酸盐
一、根据元素组成分类
【思考5】如何从元素组成的角度对氧化物进行分类?
金属氧化物
CaO Fe2O3
非金属氧化物
CO CO2 H2O
【思考6】你还可以想到其他分类依据吗?
一、根据元素组成分类
CO CO2 CaO Fe2O3 SO2
CO CO2 CaO Fe2O3 SO2
【思考7】判断上述氧化物能否和酸或碱反应
二、根据物质性质分类
CO2、SO2等能与碱反应生成盐和水,这类氧化物称为酸性氧化物
CaO、Fe2O3等能与酸反应生成盐和水,这类氧化物称为碱性氧化物
CO2 + Ca(OH)2 = CaCO3↓+ H2O
SO2 + Ca(OH)2 = CaSO3↓+ H2O
CaO + 2HCl = CaCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
酸性氧化物的通性
酸性氧化物
多数能与水反应生成酸
CO2 + H2O H2CO3
SO2 + H2O H2SO3
特例:SiO2(玻璃的主要成分)
均能与碱反应生成盐和水
CO2 + Ca(OH)2 = CaCO3↓+ H2O
SO2 + Ca(OH)2 = CaSO3↓+ H2O
能与某些碱性氧化物化合成盐
CO2+CaO = CaCO3
SO2+CaO = CaSO3
CO2
SO2
同类物质性质相似
二、根据物质性质分类
碱性氧化物的通性
碱性氧化物
少数能与水反应生成碱
均能与酸反应生成盐和水
能与某些酸性氧化物化合成盐
CaO
CaO + H2O = Ca(OH)2
CaO + 2HCl = CaCl2 + H2O
CaO + CO2 = CaCO3
K、Ca、Na的氧化物
【思考8】Al2O3既能与酸反应又能与碱反应,且都生成盐和水,
它属于哪一类氧化物?
两性氧化物
不成盐氧化物
【思考9】金属/非金属氧化物与碱性/酸性氧化物,有无必然联系?为什么?
无必然联系,因为分类依据不同
二、根据物质性质分类
CO、NO既不能与酸反应,也不能与碱反应生成盐和水,
他们又属于哪一类?
【练习2】判断下列说法正误
(1)酸性氧化物肯定是非金属氧化物
(2)非金属氧化物肯定是酸性氧化物
(3)碱性氧化物肯定是金属氧化物
(4)金属氧化物都是碱性氧化物
(5)酸性氧化物均可与水反应生成相应的酸
(6)不能跟酸反应的氧化物一定能跟碱反应
×
×
√
×
×
—— Mn2O7,金属氧化物&酸性氧化物
—— CO,不成盐氧化物
——Mn2O7、Al2O3
×
——SiO2
——CO、NO
二、根据物质性质分类
此外,物质的结构和用途也是对物质进行分类的重要依据,我们在今后的学习中将进一步探讨。
【思考10】它们有什么共同特点?从物质组成看属于哪类物质?
盐水、糖水、硫酸铜溶液、泥水、石灰浆、牛奶
三、分散系及其分类
一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物。
分散质分散在分散剂里形成分散系
分散系:
分散质:被分散的物质
分散剂:容纳分散质的物质
9种分散系
实例
根据分散剂和分散质的状态
空 气
云、雾
灰尘、烟
泡 沫
牛奶、酒精的水溶液
盐水、泥水、河水
泡沫塑料
珍珠(包含着水的CaCO3)
合 金
气
液
液
固
固
分散质
气
分散剂
三、分散系及其分类
根据分散质粒子直径的大小
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
三、分散系及其分类
提示:1nm=10-9m
胶体:分散质微粒的直径大小在1-100nm之间的分散系。
依据分散剂的状态分:
气溶胶:如_____________
液溶胶:如____________________________
固溶胶:如________玻璃
有色
Fe(OH)3胶体、稀牛奶、淀粉胶体
烟、云、雾
三、胶体及其分类
Fe(OH)3胶体的制备:
【思考11】有些液溶胶是透明的,肉眼很难与溶液相区分,怎么办呢?
四、胶体的制备及鉴别
CuSO4 溶液
Fe(OH)3 胶体
形成一条光亮的通路
没有光亮的通路现象产生
四、胶体的制备及性质
丁达尔效应是来区分胶体和溶液是一种常用的
物理方法
光亮的“通路”是由于胶体粒子对光线散射形成
——丁达尔效应
四、胶体的制备及性质
生活中的丁达尔效应
B
【练习3】
【练习4】
C
世界是由物质构成的,目前人类发现和合成的物质已超过 1 亿种。
对于这么多的物质和更为丰富的化学变化,人们是怎样认识和研究的呢?
物质的分类
一、根据元素组成分类
网
物质
混合物
纯净物
单质
化合物
金属单质
非金属单质
Na、Mg、Fe
C、H2、O2、O3
CaO、Na2O、CO、CO2、SO3
H2SO4、H2CO3
NaOH、Fe(OH)3
Na2CO3、K2CO3
碱
盐
酸
氧化物
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
【思考1】请从元素组成的角度对上述物质进行分类?
网
树状分类法
特点:层级分明
类别之间关系:
并列或从属
类比:章节目录
一、根据元素组成分类
网
【练习1】
⑨⑩
⑤
③
④
⑥⑦
一、根据元素组成分类
书P12
网
网
【思考2】对于上述含碳元素的物质,请根据其物质类别进行分类
单质
氧化物
酸
碱
盐
C
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
一、根据元素组成分类
网
网
由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
【思考3】只含一种元素的物质一定是纯净物吗?
否,可能是某元素的几种同素异形体组成的混合物
一、根据元素组成分类
单质
氧化物
酸
碱
盐
C
CO
CO2
H2CO3
Na Mg Fe NaCl NaOH Fe(OH)3 CO CO2 C H2 O2 O3 Na2CO3 CaO Na2O SO3 K2CO3 H2SO4 H2CO3
Na2CO3
K2CO3
钾盐
钠盐
碳酸盐
交叉分类法
同素异形体
【思考4】对于上述含碳元素的物质,请根据其物质类别进行分类
一、根据元素组成分类
交叉分类法
特点:交错联系
类别之间关系:
并列或交叉
可从不同的角度对物质进行分类。例如,从组成来看,Na2CO3属于盐。从其组成的阳离子来看,属于钠盐;而从其组成的阴离子来看,则属于碳酸盐
一、根据元素组成分类
【思考5】如何从元素组成的角度对氧化物进行分类?
金属氧化物
CaO Fe2O3
非金属氧化物
CO CO2 H2O
【思考6】你还可以想到其他分类依据吗?
一、根据元素组成分类
CO CO2 CaO Fe2O3 SO2
CO CO2 CaO Fe2O3 SO2
【思考7】判断上述氧化物能否和酸或碱反应
二、根据物质性质分类
CO2、SO2等能与碱反应生成盐和水,这类氧化物称为酸性氧化物
CaO、Fe2O3等能与酸反应生成盐和水,这类氧化物称为碱性氧化物
CO2 + Ca(OH)2 = CaCO3↓+ H2O
SO2 + Ca(OH)2 = CaSO3↓+ H2O
CaO + 2HCl = CaCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
酸性氧化物的通性
酸性氧化物
多数能与水反应生成酸
CO2 + H2O H2CO3
SO2 + H2O H2SO3
特例:SiO2(玻璃的主要成分)
均能与碱反应生成盐和水
CO2 + Ca(OH)2 = CaCO3↓+ H2O
SO2 + Ca(OH)2 = CaSO3↓+ H2O
能与某些碱性氧化物化合成盐
CO2+CaO = CaCO3
SO2+CaO = CaSO3
CO2
SO2
同类物质性质相似
二、根据物质性质分类
碱性氧化物的通性
碱性氧化物
少数能与水反应生成碱
均能与酸反应生成盐和水
能与某些酸性氧化物化合成盐
CaO
CaO + H2O = Ca(OH)2
CaO + 2HCl = CaCl2 + H2O
CaO + CO2 = CaCO3
K、Ca、Na的氧化物
【思考8】Al2O3既能与酸反应又能与碱反应,且都生成盐和水,
它属于哪一类氧化物?
两性氧化物
不成盐氧化物
【思考9】金属/非金属氧化物与碱性/酸性氧化物,有无必然联系?为什么?
无必然联系,因为分类依据不同
二、根据物质性质分类
CO、NO既不能与酸反应,也不能与碱反应生成盐和水,
他们又属于哪一类?
【练习2】判断下列说法正误
(1)酸性氧化物肯定是非金属氧化物
(2)非金属氧化物肯定是酸性氧化物
(3)碱性氧化物肯定是金属氧化物
(4)金属氧化物都是碱性氧化物
(5)酸性氧化物均可与水反应生成相应的酸
(6)不能跟酸反应的氧化物一定能跟碱反应
×
×
√
×
×
—— Mn2O7,金属氧化物&酸性氧化物
—— CO,不成盐氧化物
——Mn2O7、Al2O3
×
——SiO2
——CO、NO
二、根据物质性质分类
此外,物质的结构和用途也是对物质进行分类的重要依据,我们在今后的学习中将进一步探讨。
【思考10】它们有什么共同特点?从物质组成看属于哪类物质?
盐水、糖水、硫酸铜溶液、泥水、石灰浆、牛奶
三、分散系及其分类
一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物。
分散质分散在分散剂里形成分散系
分散系:
分散质:被分散的物质
分散剂:容纳分散质的物质
9种分散系
实例
根据分散剂和分散质的状态
空 气
云、雾
灰尘、烟
泡 沫
牛奶、酒精的水溶液
盐水、泥水、河水
泡沫塑料
珍珠(包含着水的CaCO3)
合 金
气
液
液
固
固
分散质
气
分散剂
三、分散系及其分类
根据分散质粒子直径的大小
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
三、分散系及其分类
提示:1nm=10-9m
胶体:分散质微粒的直径大小在1-100nm之间的分散系。
依据分散剂的状态分:
气溶胶:如_____________
液溶胶:如____________________________
固溶胶:如________玻璃
有色
Fe(OH)3胶体、稀牛奶、淀粉胶体
烟、云、雾
三、胶体及其分类
Fe(OH)3胶体的制备:
【思考11】有些液溶胶是透明的,肉眼很难与溶液相区分,怎么办呢?
四、胶体的制备及鉴别
CuSO4 溶液
Fe(OH)3 胶体
形成一条光亮的通路
没有光亮的通路现象产生
四、胶体的制备及性质
丁达尔效应是来区分胶体和溶液是一种常用的
物理方法
光亮的“通路”是由于胶体粒子对光线散射形成
——丁达尔效应
四、胶体的制备及性质
生活中的丁达尔效应
B
【练习3】
【练习4】
C
