2.3 物质的量浓度 课件(共46张PPT) 人教版(2019)必修一
文档属性
| 名称 | 2.3 物质的量浓度 课件(共46张PPT) 人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 23:09:36 | ||
图片预览










文档简介
(共46张PPT)
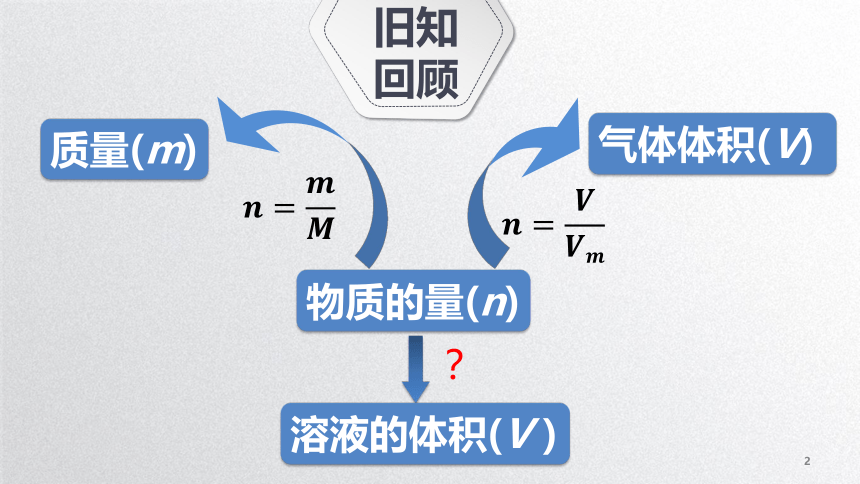
物质的量浓度旧知回顾物质的量(n)质量(m)气体体积(V)溶液的体积(V)?1物质的量浓度物质的量浓度定义:单位体积溶液中所含溶质B的物质的量。单位与符号:单位:mol/L符号:cB计算公式:nBVcB=物质的量浓度判断下列说法是否正确。(1)将1gNaCl溶于水制成1L溶液,则c=1mol·L-1()(2)将1molNaCl溶于1L水中,则c=1mol·L-1()(3)若从1L 1 mol·L-1的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol·L-1()(4)同体积、同物质的量浓度的不同溶液中,含溶质的物质的量相等()×√√【提示】注意1L是溶液的体积,不是水的体积。×(1)体积是溶液的体积,不是溶剂的体积。(2)溶质用物质的量表示,不是用质量表示。(3)溶液的物质的量浓度是个定值,不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。物质的量浓度从1L 1mol·L-1NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的密度、溶质的质量分数、物质的量浓度是否相等?所含溶质是否相等?想一想因为溶液具有均一、稳定的特征,所以:从同一溶液中取出任意体积的溶液,其浓度(包括质量分数、物质的量浓度)、密度不变;所含溶质的质量(物质的量)不相等。2物质的量浓度的相关计算物质的量浓度的相关计算基本运算例1:将53.0gNa2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是多少?解:n(Na2CO3) =m(Na2CO3) /M(Na2CO3)= 53.0g/106g mol-1= 0.500molc(Na2CO3) =n(Na2CO3) /V[Na2CO3(aq)]=0.500mol/0.500L= 1.00 mol·L-1c(Na+)= 2.配制250mL0.2mol·L-1NaCl溶液,需要NaCl的质量是多少克?解:n(NaCl)=c(NaCl)V(NaCl溶液)= 0.2mol·L-1× 0.25L=0.05molm(NaCl)= n(NaCl) M(NaCl)= 0.05mol × 58.5g·mol-1=2.925g答:2.925g物质的量浓度的相关计算物质的量浓度的相关计算有关溶液稀释(浓缩)的计算例:将10毫升2 mol·L-1的硫酸溶液加水稀释到0.5mol·L-1,其体积为多少毫升?结论:浓溶液配制成稀溶液,稀释前后溶质的物质的量不变c1V1= c2V2物质的量浓度的相关计算c与w的换算例:已知一溶液的密度为ρg/ml,溶液体积为VL,所含溶质的质量百分含量为W,溶质的摩尔质量为M g/mol,求该溶液的物质的量浓度?ρg/ml×1000ml/L×VL×WMg/mol×VL=解:nBVcB=mBMBV=1000ρwM=(mol/L)注意:密度的单位是:g/ml浓度的单位是mol/L
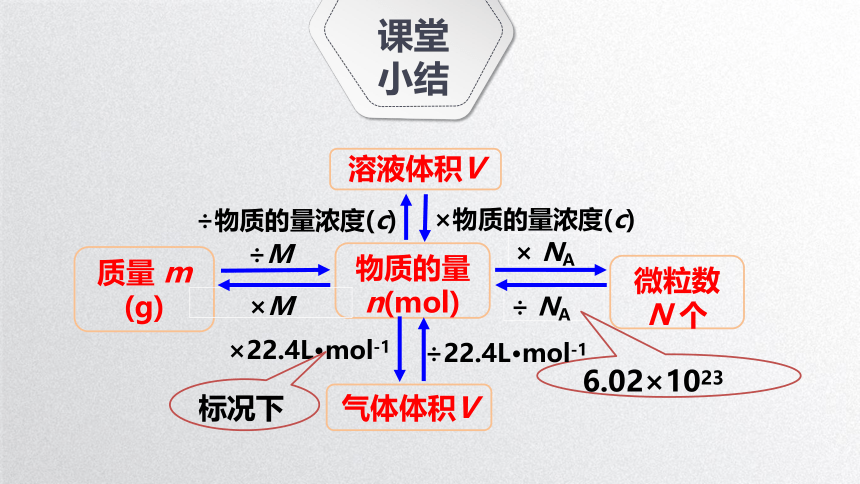
课堂小结
质量 m
(g)
微粒数
N 个
÷M
物质的量
n(mol)
×M
× NA
÷ NA
气体体积V
×22.4L·mol-1
6.02×1023
溶液体积V
×物质的量浓度(c)
÷物质的量浓度(c)
÷22.4L·mol-1
标况下
练习01032molNaOH配成200mL溶液,其物质的量浓度为__ __mol/L。0204标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为_ _mol/L。物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol。10molHCl能配成____L物质的量浓度为2mol/L的盐酸 ?10215练习050.5mol/L H2SO4溶液, H+的物质的量浓度为_______mol/L , SO42-的物质的量浓度为_______mol/L1.00.506含有Na+的物质的量浓度为0.5mol/L的Na2CO3溶液的物质的量浓度为_______mol/L,CO32-的物质的量浓度为_______mol/L0.250.25练一练已知某浓度氨水中氨气的物质的量浓度为18.0mol·L-1,溶液的密度为0.900 g·mL-1,则该溶液中溶质的质量分数为( )A.0.458 B.34%C.71.6% D.不能确定B
实验室的试剂
实验室中多种化学试剂只能从化学药品店买到纯的固体或液体,实验室中使用的1.00mol/L氯化钠等溶液的是怎么来的呢?
溶液的配制
一定物质的量浓度溶液的配制思考问题一如何准确确定溶质的物质的量?问题二如何准确确定溶液的体积?问题三可能需要用到哪些仪器?如何配制100mL1.00mol/LNaCl溶液?认识容量瓶01刻度线02容积03温度05瓶口磨砂04瓶塞专用容量瓶的使用注意事项(1)不能溶解固体(2)不能稀释溶液(3)不能加热(4)不能作反应容器(5)不能长贮存溶液1计算配制100mL1.00mol/L的NaCl溶液的步骤计算解:n(NaCl)=c(NaCl)·V[NaCl(aq)]=1.00mol/L×0.1L=0.1molm(NaCl)=n(NaCl)·M(NaCl)= 0.1mol×58.5g/mol=5.85g2称量配制100mL1.00mol/L的NaCl溶液的步骤称量注意事项:(1)使用前要调零(2)两个托盘上各放一张大小相同的称量纸(3)称量时遵循左物右码的原则(4)用镊子夹取砝码时应按照从大到小的顺序夹取(5)称量完毕后应将砝码放回盒中,游码归零提示:托盘天平只能准确到0.1g,所以称取氯化钠5.9g。3溶解配制100mL1.00mol/L的NaCl溶液的步骤溶解注意事项:(1)应在烧杯中溶解,不能在容量瓶中溶解(2)搅拌时用到玻璃棒(3)冷却至室温4转移、洗涤配制100mL1.00mol/L的NaCl溶液的步骤转移由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。玻璃棒下端要插入容量瓶刻度线以下。用少量蒸馏水洗涤2次~3次,洗涤液要全部转移到容量瓶中。如果用量筒量取液体药品,量筒则无需洗涤洗涤5定容配制100mL1.00mol/L的NaCl溶液的步骤定容向容量瓶中加入蒸馏水,在距离刻度线1cm~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。100mL6摇匀配制100mL1.00mol/L的NaCl溶液的步骤摇匀将容量瓶盖好塞子,然后倒转和摇动容量瓶几次,使得溶液混合均匀。思考:摇匀放置后发现液面低于刻度线,能否补充水?不能。因为这是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。7装瓶配制100mL1.00mol/L的NaCl溶液的步骤装瓶容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。交流与讨论做完实验,用到了哪些仪器?托盘天平,烧杯,玻璃棒,100mL容量瓶,胶头滴管,试剂瓶等。
练习与巩固
欲配制1000mL浓度为0.12 mol·L-1的NaOH溶液,
按操作先后顺序编号,正确顺序为_____________
1.用适量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶。
2.用胶头滴管滴加蒸馏水使溶液凹液面与刻度相切。
3.在托盘天平上用洁净干燥的烧杯称取4.8g NaOH。
4.将容量瓶瓶塞盖紧,反复摇匀。
5.向烧杯中加适量蒸馏水,用玻璃棒搅拌,使其溶解,并使其恢复室温。
6.将溶液沿玻璃棒注入1000mL容量瓶。
356124
分析并归纳配制一定物质的量浓度的溶液的注意事项(1)使用前检漏(2)称量固体时精确到0.1g(3)不能配制任意体积的溶液(比如950mL某浓度溶液应选1 000mL的容量瓶,确定溶质时,不能按照950mL计算,要按照1 000mL计算)(4)溶解后稀释不能用容量瓶(5)溶液需冷却后才能移入容量瓶(6)引流时,玻璃棒下端应伸到刻度线以下(7)滴加蒸馏水时超过刻度线必须重新配制(8)摇匀后发现液面低于刻度线不能再加水(9)容量瓶不能长期存放溶液或进行反应8溶液配制的误差分析溶液配制的误差分析的基本方法根据c=n/V=m/MV判断:凡是能使n增加或V减少的因素,都会使c偏大;凡是能使n减少或V增大的因素,都会使c偏小。定容时俯视或仰视刻度线,对溶液的浓度有影响吗?定容时:视线与刻度线相平;凹液面与刻度线相切溶液配制的误差分析的基本方法俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大俯视仰视仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减
练习与巩固
根据c=n/V分析(以配制某浓度NaOH溶液为例,请同学们将c的结果填入表中)
引起误差的操作 m V c
称取时间过长 或用滤纸盛放
向容量瓶转移溶液时有少量流到外面
未洗涤烧杯或玻璃棒
未冷却至室温而定容
减小
不变
减小
减小
不变
减小
减小
不变
减小
不变
减小
增大
引起误差的操作 m V c
定容时加水过量,用吸管吸出溶液
定容时仰视刻度线
定容时俯视刻度线
定容摇匀后液面下降又加水
减小
不变
减小
不变
增大
减小
不变
减小
增大
不变
增大
减小
9小结
课堂
小结
一、容量瓶的使用
(1)不能溶解固体(2)不能稀释溶液 (3)不能加热
(4)不能作反应容器(5)不能长贮存溶液
二、配制步骤
(1)计算(2)称量 (3)溶解 (4)转移
(5)洗涤(6)定容(7)摇匀 (8)装瓶
三、误差分析
根据 c== 分析
练习与巩固
配制100mL 1.0mol·L-1Na2CO3溶液,下列操作正确的是( )
A.称取28.6 g Na2CO3·10H2O,加100mL容量瓶中,加水溶解、定容
B.称取 28.6 g Na2CO3·10H2O,加100mL蒸馏水,搅拌、溶解
C.转移时将烧杯中溶液直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
D
练习与巩固
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时,未倒入洗涤液
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
D
谢谢观看
物质的量浓度旧知回顾物质的量(n)质量(m)气体体积(V)溶液的体积(V)?1物质的量浓度物质的量浓度定义:单位体积溶液中所含溶质B的物质的量。单位与符号:单位:mol/L符号:cB计算公式:nBVcB=物质的量浓度判断下列说法是否正确。(1)将1gNaCl溶于水制成1L溶液,则c=1mol·L-1()(2)将1molNaCl溶于1L水中,则c=1mol·L-1()(3)若从1L 1 mol·L-1的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol·L-1()(4)同体积、同物质的量浓度的不同溶液中,含溶质的物质的量相等()×√√【提示】注意1L是溶液的体积,不是水的体积。×(1)体积是溶液的体积,不是溶剂的体积。(2)溶质用物质的量表示,不是用质量表示。(3)溶液的物质的量浓度是个定值,不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。物质的量浓度从1L 1mol·L-1NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的密度、溶质的质量分数、物质的量浓度是否相等?所含溶质是否相等?想一想因为溶液具有均一、稳定的特征,所以:从同一溶液中取出任意体积的溶液,其浓度(包括质量分数、物质的量浓度)、密度不变;所含溶质的质量(物质的量)不相等。2物质的量浓度的相关计算物质的量浓度的相关计算基本运算例1:将53.0gNa2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是多少?解:n(Na2CO3) =m(Na2CO3) /M(Na2CO3)= 53.0g/106g mol-1= 0.500molc(Na2CO3) =n(Na2CO3) /V[Na2CO3(aq)]=0.500mol/0.500L= 1.00 mol·L-1c(Na+)= 2.配制250mL0.2mol·L-1NaCl溶液,需要NaCl的质量是多少克?解:n(NaCl)=c(NaCl)V(NaCl溶液)= 0.2mol·L-1× 0.25L=0.05molm(NaCl)= n(NaCl) M(NaCl)= 0.05mol × 58.5g·mol-1=2.925g答:2.925g物质的量浓度的相关计算物质的量浓度的相关计算有关溶液稀释(浓缩)的计算例:将10毫升2 mol·L-1的硫酸溶液加水稀释到0.5mol·L-1,其体积为多少毫升?结论:浓溶液配制成稀溶液,稀释前后溶质的物质的量不变c1V1= c2V2物质的量浓度的相关计算c与w的换算例:已知一溶液的密度为ρg/ml,溶液体积为VL,所含溶质的质量百分含量为W,溶质的摩尔质量为M g/mol,求该溶液的物质的量浓度?ρg/ml×1000ml/L×VL×WMg/mol×VL=解:nBVcB=mBMBV=1000ρwM=(mol/L)注意:密度的单位是:g/ml浓度的单位是mol/L
课堂小结
质量 m
(g)
微粒数
N 个
÷M
物质的量
n(mol)
×M
× NA
÷ NA
气体体积V
×22.4L·mol-1
6.02×1023
溶液体积V
×物质的量浓度(c)
÷物质的量浓度(c)
÷22.4L·mol-1
标况下
练习01032molNaOH配成200mL溶液,其物质的量浓度为__ __mol/L。0204标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为_ _mol/L。物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol。10molHCl能配成____L物质的量浓度为2mol/L的盐酸 ?10215练习050.5mol/L H2SO4溶液, H+的物质的量浓度为_______mol/L , SO42-的物质的量浓度为_______mol/L1.00.506含有Na+的物质的量浓度为0.5mol/L的Na2CO3溶液的物质的量浓度为_______mol/L,CO32-的物质的量浓度为_______mol/L0.250.25练一练已知某浓度氨水中氨气的物质的量浓度为18.0mol·L-1,溶液的密度为0.900 g·mL-1,则该溶液中溶质的质量分数为( )A.0.458 B.34%C.71.6% D.不能确定B
实验室的试剂
实验室中多种化学试剂只能从化学药品店买到纯的固体或液体,实验室中使用的1.00mol/L氯化钠等溶液的是怎么来的呢?
溶液的配制
一定物质的量浓度溶液的配制思考问题一如何准确确定溶质的物质的量?问题二如何准确确定溶液的体积?问题三可能需要用到哪些仪器?如何配制100mL1.00mol/LNaCl溶液?认识容量瓶01刻度线02容积03温度05瓶口磨砂04瓶塞专用容量瓶的使用注意事项(1)不能溶解固体(2)不能稀释溶液(3)不能加热(4)不能作反应容器(5)不能长贮存溶液1计算配制100mL1.00mol/L的NaCl溶液的步骤计算解:n(NaCl)=c(NaCl)·V[NaCl(aq)]=1.00mol/L×0.1L=0.1molm(NaCl)=n(NaCl)·M(NaCl)= 0.1mol×58.5g/mol=5.85g2称量配制100mL1.00mol/L的NaCl溶液的步骤称量注意事项:(1)使用前要调零(2)两个托盘上各放一张大小相同的称量纸(3)称量时遵循左物右码的原则(4)用镊子夹取砝码时应按照从大到小的顺序夹取(5)称量完毕后应将砝码放回盒中,游码归零提示:托盘天平只能准确到0.1g,所以称取氯化钠5.9g。3溶解配制100mL1.00mol/L的NaCl溶液的步骤溶解注意事项:(1)应在烧杯中溶解,不能在容量瓶中溶解(2)搅拌时用到玻璃棒(3)冷却至室温4转移、洗涤配制100mL1.00mol/L的NaCl溶液的步骤转移由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。玻璃棒下端要插入容量瓶刻度线以下。用少量蒸馏水洗涤2次~3次,洗涤液要全部转移到容量瓶中。如果用量筒量取液体药品,量筒则无需洗涤洗涤5定容配制100mL1.00mol/L的NaCl溶液的步骤定容向容量瓶中加入蒸馏水,在距离刻度线1cm~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。100mL6摇匀配制100mL1.00mol/L的NaCl溶液的步骤摇匀将容量瓶盖好塞子,然后倒转和摇动容量瓶几次,使得溶液混合均匀。思考:摇匀放置后发现液面低于刻度线,能否补充水?不能。因为这是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。7装瓶配制100mL1.00mol/L的NaCl溶液的步骤装瓶容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。交流与讨论做完实验,用到了哪些仪器?托盘天平,烧杯,玻璃棒,100mL容量瓶,胶头滴管,试剂瓶等。
练习与巩固
欲配制1000mL浓度为0.12 mol·L-1的NaOH溶液,
按操作先后顺序编号,正确顺序为_____________
1.用适量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶。
2.用胶头滴管滴加蒸馏水使溶液凹液面与刻度相切。
3.在托盘天平上用洁净干燥的烧杯称取4.8g NaOH。
4.将容量瓶瓶塞盖紧,反复摇匀。
5.向烧杯中加适量蒸馏水,用玻璃棒搅拌,使其溶解,并使其恢复室温。
6.将溶液沿玻璃棒注入1000mL容量瓶。
356124
分析并归纳配制一定物质的量浓度的溶液的注意事项(1)使用前检漏(2)称量固体时精确到0.1g(3)不能配制任意体积的溶液(比如950mL某浓度溶液应选1 000mL的容量瓶,确定溶质时,不能按照950mL计算,要按照1 000mL计算)(4)溶解后稀释不能用容量瓶(5)溶液需冷却后才能移入容量瓶(6)引流时,玻璃棒下端应伸到刻度线以下(7)滴加蒸馏水时超过刻度线必须重新配制(8)摇匀后发现液面低于刻度线不能再加水(9)容量瓶不能长期存放溶液或进行反应8溶液配制的误差分析溶液配制的误差分析的基本方法根据c=n/V=m/MV判断:凡是能使n增加或V减少的因素,都会使c偏大;凡是能使n减少或V增大的因素,都会使c偏小。定容时俯视或仰视刻度线,对溶液的浓度有影响吗?定容时:视线与刻度线相平;凹液面与刻度线相切溶液配制的误差分析的基本方法俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大俯视仰视仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减
练习与巩固
根据c=n/V分析(以配制某浓度NaOH溶液为例,请同学们将c的结果填入表中)
引起误差的操作 m V c
称取时间过长 或用滤纸盛放
向容量瓶转移溶液时有少量流到外面
未洗涤烧杯或玻璃棒
未冷却至室温而定容
减小
不变
减小
减小
不变
减小
减小
不变
减小
不变
减小
增大
引起误差的操作 m V c
定容时加水过量,用吸管吸出溶液
定容时仰视刻度线
定容时俯视刻度线
定容摇匀后液面下降又加水
减小
不变
减小
不变
增大
减小
不变
减小
增大
不变
增大
减小
9小结
课堂
小结
一、容量瓶的使用
(1)不能溶解固体(2)不能稀释溶液 (3)不能加热
(4)不能作反应容器(5)不能长贮存溶液
二、配制步骤
(1)计算(2)称量 (3)溶解 (4)转移
(5)洗涤(6)定容(7)摇匀 (8)装瓶
三、误差分析
根据 c== 分析
练习与巩固
配制100mL 1.0mol·L-1Na2CO3溶液,下列操作正确的是( )
A.称取28.6 g Na2CO3·10H2O,加100mL容量瓶中,加水溶解、定容
B.称取 28.6 g Na2CO3·10H2O,加100mL蒸馏水,搅拌、溶解
C.转移时将烧杯中溶液直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
D
练习与巩固
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时,未倒入洗涤液
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
D
谢谢观看
