1.2.1 电解质的电离 课件(共22张PPT)人教版(2019)必修一
文档属性
| 名称 | 1.2.1 电解质的电离 课件(共22张PPT)人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 23:23:13 | ||
图片预览





文档简介
(共22张PPT)
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第一课时 电解质的电离
核心素养发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
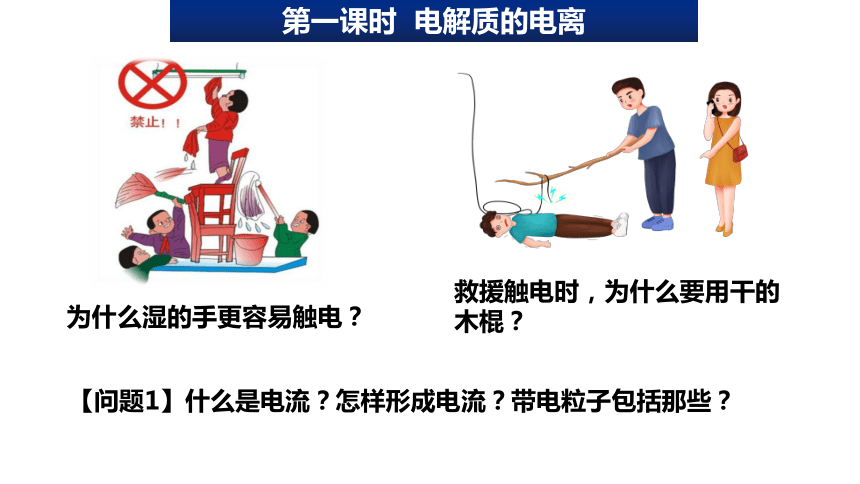
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
第一课时 电解质的电离
【问题1】什么是电流?怎样形成电流?带电粒子包括那些?
设计实验证明NaCl溶液能导电
物质 实验现象 导电性
NaCl溶液 灯泡亮 能够导电
NaCl
固体
NaCl
溶液
加水溶解
能够导电
微观
宏观
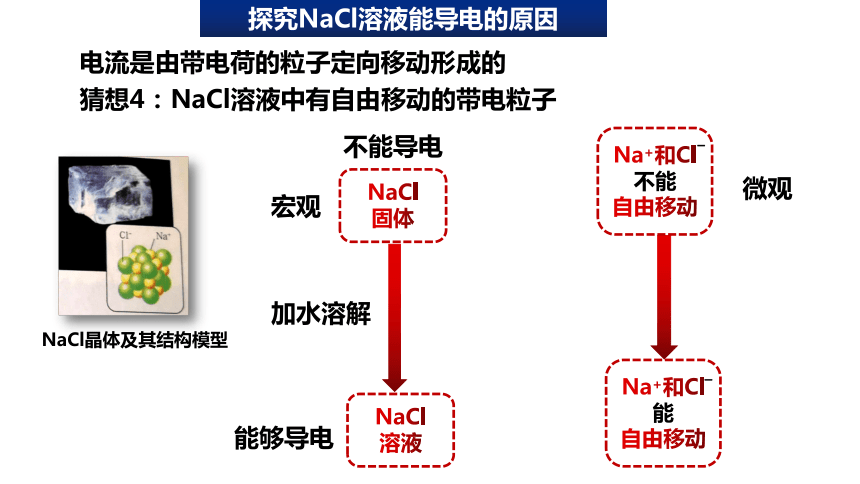
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
探究NaCl溶液能导电的原因
电流是由带电荷的粒子定向移动形成的
猜想4:NaCl溶液中有自由移动的带电粒子
NaCl晶体及其结构模型
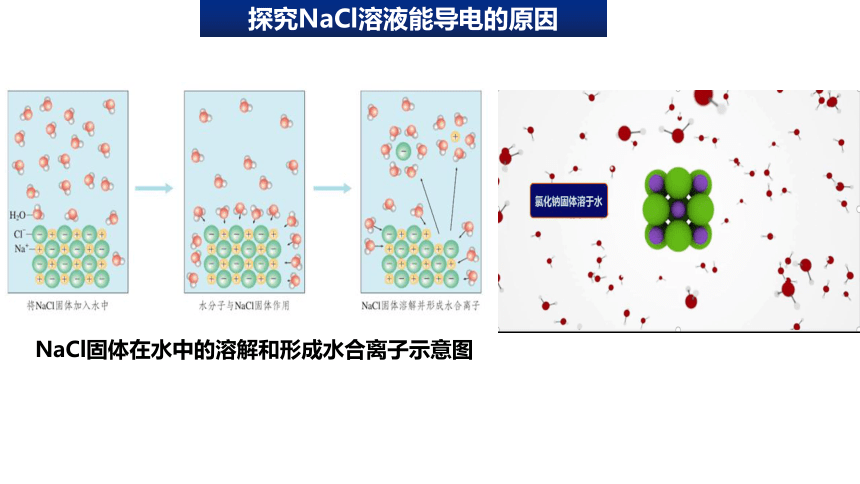
探究NaCl溶液能导电的原因
NaCl固体在水中的溶解和形成水合离子示意图
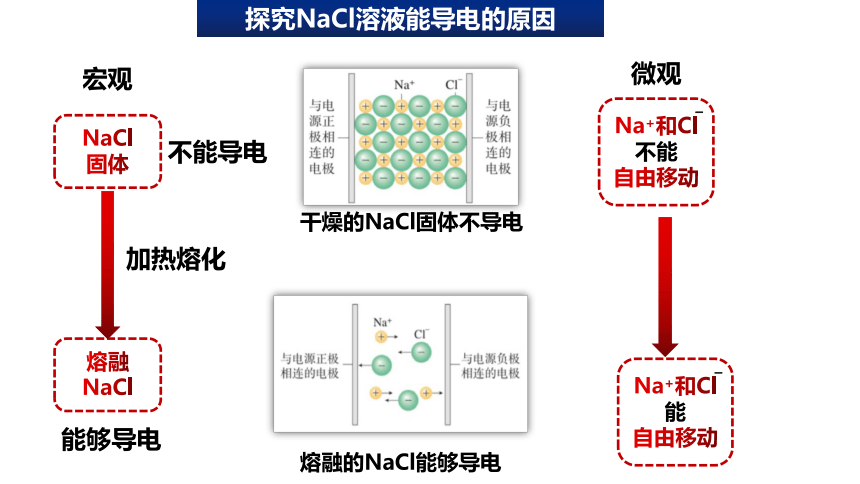
熔融NaCl
加热熔化
能够导电
微观
宏观
NaCl
固体
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
探究NaCl溶液能导电的原因
干燥的NaCl固体不导电
熔融的NaCl能够导电
实验序号 物质 实验现象 导电性 微观解释
1 NaCl 溶液 灯泡亮 能够导电 有自由移动的
带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl 固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电 有自由移动的
带电粒子
湿手不要摸电器
干燥绝缘要牢记
探究NaCl溶液能导电的原因
无大量
带电粒子
有带电粒子,
不能自由移动
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
电离方程式
NaCl = Na+ + Cl-
化学式
阳离子
阴离子
离子符号(代表水合离子)
用化学用语表示NaCl的电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
分类标准:水溶液或熔融状态能否导电
电解质与非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
电解质:
非电解质:
能导电:
②④⑧ ⑩
⑨
①⑤⑦ ⑧
注意:
(1)电解质或非电解质必须是化合物。单质及混合物既不是电解质,也不是非电解质。(如:金属单质、盐酸——电解质溶液)
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
导电性关键看有无自由移动的离子或自由电子
电解质与非电解质
(2)电解质与非电解质的本质区别是看化合物自身在熔融状态下或在水溶液中能否发生电离,而溶液的导电只是一个表面现象。
CO2、SO2
SO3、NH3
自身不能电离出阴、阳离子
非电解质
加水
H2CO3、H2SO3
H2SO4、NH3·H2O
自身能电离出自由移动的阴、阳离子
电解质
电解质与非电解质
(4)溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强。
(3)BaSO4、 AgCl虽然不溶于水但是熔融状态能导电,它们仍然是电解质
强电解质:在水溶液中能完全电离的电解质。
弱电解质:在水溶液中部分电离的电解质。
拓展:强电解质和弱电解质
强酸:(六大强酸)HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:(四大强碱)NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数的盐:NaCl、AgCl、BaSO4……
金属氧化物也是强电解质,熔融状态下都能完全电离
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4
弱碱:所有难溶性碱、 NH3 H2O
极少数盐: (CH3COO)2Pb等
水是极弱的电解质
在下列给出的物质中,按要求填写下列空白
①HCl ②CuO ③CuSO4·5H2O ④Ca(OH)2 ⑤ H2O
⑥ Cu ⑦ Cl2 ⑧盐酸 ⑨ Na2CO3 ⑩ CH3COOH
在上述给出的物质中,其中属于强电解质的是_____________;
属于弱电解质的是_____________。
①②③④⑨
⑤⑩
注意:(1)电解质强弱与溶解度无关,如BaSO4是强电解质;
(2)溶液导电性强弱由取决于溶液中自由移动的离子浓度和所带的电荷(即自由移动的电荷浓度),与电解质强弱无关,BaSO4溶液导电能力弱于1mol·L-1的CH3COOH溶液。
拓展:强电解质和弱电解质
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
书写步骤:
(1)阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。
例:Al2 (SO4)3=2Al3+ +3SO42-
HCl = H+ + Cl-
H2SO4 =2H+ + SO42-
HNO3 = H+ + NO3-
酸:电离时生成的阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K++ OH-
Ba(OH)2 = Ba2++ 2OH-
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO42-
电离时生成的阴离子全部是OH-的化合物。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一步:
第二步:
H+ + HCO3-
H2CO3
难电离
HCO3-
H+ + CO32-
很难电离
A、一元弱酸难电离,使用可逆符号
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
C、一元难电离使用可逆符号:
NH3·H2O
NH4+ + OH-
D、多元弱碱的电离相当复杂,高中阶段只须一步写出;
Cu(OH)2
Cu2+ + 2OH-
弱电解质在水中只有部分电离
从电离的角度理解酸、碱、盐的分类,书写电离方程式
已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。(1)NaHCO3 (2)NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
写出NaHSO4熔融的电离方程式
NaHSO4 = Na+ +HSO4-
从电离的角度理解酸、碱、盐的分类,书写电离方程式
D
随堂演练
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
A
随堂演练
2.下列电离方程式不正确的是( )
A.NaHCO3在溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.Ba(OH)2的电离方程式为Ba(OH)2=Ba2++2OH-
C.NaHSO4在熔融状态下的电离方程式为
NaHSO4(熔融)=Na++HSO4-
D.CH3COONH4电离方程式为CH3COONH4=NH4++CH3COO-
3.下列物质分类正确的组合是( )
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
B
随堂演练
4、以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH
⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1)属于电解质的是 .
(2)属于非电解质的是 .
(3)属于酸的是 .
(4)属于碱的是 .
(5)属于盐的是 .
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第一课时 电解质的电离
核心素养发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
第一课时 电解质的电离
【问题1】什么是电流?怎样形成电流?带电粒子包括那些?
设计实验证明NaCl溶液能导电
物质 实验现象 导电性
NaCl溶液 灯泡亮 能够导电
NaCl
固体
NaCl
溶液
加水溶解
能够导电
微观
宏观
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
探究NaCl溶液能导电的原因
电流是由带电荷的粒子定向移动形成的
猜想4:NaCl溶液中有自由移动的带电粒子
NaCl晶体及其结构模型
探究NaCl溶液能导电的原因
NaCl固体在水中的溶解和形成水合离子示意图
熔融NaCl
加热熔化
能够导电
微观
宏观
NaCl
固体
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
探究NaCl溶液能导电的原因
干燥的NaCl固体不导电
熔融的NaCl能够导电
实验序号 物质 实验现象 导电性 微观解释
1 NaCl 溶液 灯泡亮 能够导电 有自由移动的
带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl 固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电 有自由移动的
带电粒子
湿手不要摸电器
干燥绝缘要牢记
探究NaCl溶液能导电的原因
无大量
带电粒子
有带电粒子,
不能自由移动
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
电离方程式
NaCl = Na+ + Cl-
化学式
阳离子
阴离子
离子符号(代表水合离子)
用化学用语表示NaCl的电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
分类标准:水溶液或熔融状态能否导电
电解质与非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
电解质:
非电解质:
能导电:
②④⑧ ⑩
⑨
①⑤⑦ ⑧
注意:
(1)电解质或非电解质必须是化合物。单质及混合物既不是电解质,也不是非电解质。(如:金属单质、盐酸——电解质溶液)
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
导电性关键看有无自由移动的离子或自由电子
电解质与非电解质
(2)电解质与非电解质的本质区别是看化合物自身在熔融状态下或在水溶液中能否发生电离,而溶液的导电只是一个表面现象。
CO2、SO2
SO3、NH3
自身不能电离出阴、阳离子
非电解质
加水
H2CO3、H2SO3
H2SO4、NH3·H2O
自身能电离出自由移动的阴、阳离子
电解质
电解质与非电解质
(4)溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强。
(3)BaSO4、 AgCl虽然不溶于水但是熔融状态能导电,它们仍然是电解质
强电解质:在水溶液中能完全电离的电解质。
弱电解质:在水溶液中部分电离的电解质。
拓展:强电解质和弱电解质
强酸:(六大强酸)HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:(四大强碱)NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数的盐:NaCl、AgCl、BaSO4……
金属氧化物也是强电解质,熔融状态下都能完全电离
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4
弱碱:所有难溶性碱、 NH3 H2O
极少数盐: (CH3COO)2Pb等
水是极弱的电解质
在下列给出的物质中,按要求填写下列空白
①HCl ②CuO ③CuSO4·5H2O ④Ca(OH)2 ⑤ H2O
⑥ Cu ⑦ Cl2 ⑧盐酸 ⑨ Na2CO3 ⑩ CH3COOH
在上述给出的物质中,其中属于强电解质的是_____________;
属于弱电解质的是_____________。
①②③④⑨
⑤⑩
注意:(1)电解质强弱与溶解度无关,如BaSO4是强电解质;
(2)溶液导电性强弱由取决于溶液中自由移动的离子浓度和所带的电荷(即自由移动的电荷浓度),与电解质强弱无关,BaSO4溶液导电能力弱于1mol·L-1的CH3COOH溶液。
拓展:强电解质和弱电解质
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
书写步骤:
(1)阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。
例:Al2 (SO4)3=2Al3+ +3SO42-
HCl = H+ + Cl-
H2SO4 =2H+ + SO42-
HNO3 = H+ + NO3-
酸:电离时生成的阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K++ OH-
Ba(OH)2 = Ba2++ 2OH-
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO42-
电离时生成的阴离子全部是OH-的化合物。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一步:
第二步:
H+ + HCO3-
H2CO3
难电离
HCO3-
H+ + CO32-
很难电离
A、一元弱酸难电离,使用可逆符号
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
C、一元难电离使用可逆符号:
NH3·H2O
NH4+ + OH-
D、多元弱碱的电离相当复杂,高中阶段只须一步写出;
Cu(OH)2
Cu2+ + 2OH-
弱电解质在水中只有部分电离
从电离的角度理解酸、碱、盐的分类,书写电离方程式
已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。(1)NaHCO3 (2)NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
写出NaHSO4熔融的电离方程式
NaHSO4 = Na+ +HSO4-
从电离的角度理解酸、碱、盐的分类,书写电离方程式
D
随堂演练
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
A
随堂演练
2.下列电离方程式不正确的是( )
A.NaHCO3在溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.Ba(OH)2的电离方程式为Ba(OH)2=Ba2++2OH-
C.NaHSO4在熔融状态下的电离方程式为
NaHSO4(熔融)=Na++HSO4-
D.CH3COONH4电离方程式为CH3COONH4=NH4++CH3COO-
3.下列物质分类正确的组合是( )
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
B
随堂演练
4、以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH
⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1)属于电解质的是 .
(2)属于非电解质的是 .
(3)属于酸的是 .
(4)属于碱的是 .
(5)属于盐的是 .
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
