2.1 钠及其化合物 课件(共34张PPT)人教版(2019)必修一
文档属性
| 名称 | 2.1 钠及其化合物 课件(共34张PPT)人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 45.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-14 23:25:22 | ||
图片预览






文档简介
(共34张PPT)
人教版必修一
第二章海水中重要的元素——钠和氯
第一节 钠及其化合物
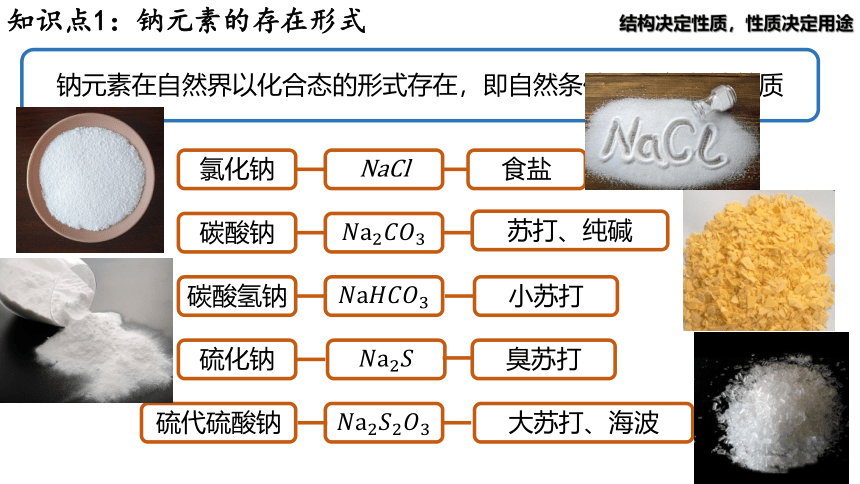
知识点1:钠元素的存在形式
钠元素在自然界以化合态的形式存在,即自然条件下不存在钠单质
氯化钠
NaCl
食盐
碳酸钠
苏打、纯碱
碳酸氢钠
小苏打
硫代硫酸钠
大苏打、海波
硫化钠
臭苏打
结构决定性质,性质决定用途
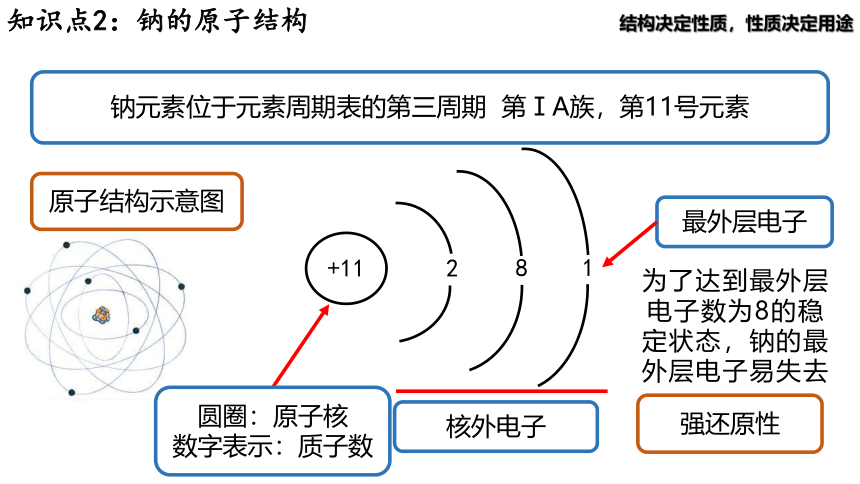
知识点2:钠的原子结构
钠元素位于元素周期表的第三周期 第ⅠA族,第11号元素
+11
原子结构示意图
2
8
圆圈:原子核
数字表示:质子数
1
核外电子
最外层电子
强还原性
为了达到最外层电子数为8的稳定状态,钠的最外层电子易失去
结构决定性质,性质决定用途
知识点3:钠的物理性质
钠的保存方式:
钠单质通常保存于装有煤油或石蜡油的试剂瓶中,密封避光
通体为暗灰色
结构决定性质,性质决定用途
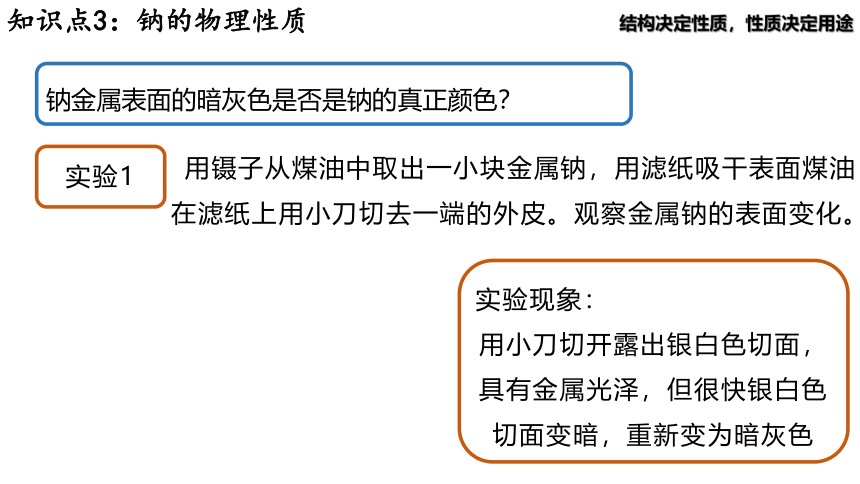
钠金属表面的暗灰色是否是钠的真正颜色?
知识点3:钠的物理性质
实验1
用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油
在滤纸上用小刀切去一端的外皮。观察金属钠的表面变化。
实验现象:
用小刀切开露出银白色切面,具有金属光泽,但很快银白色切面变暗,重新变为暗灰色
结构决定性质,性质决定用途
知识点3:钠的物理性质
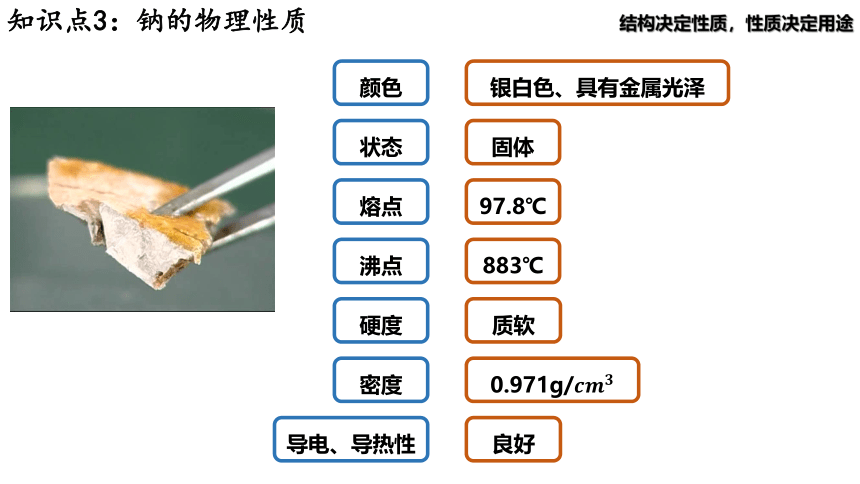
颜色
状态
熔点
沸点
硬度
密度
导电、导热性
银白色、具有金属光泽
固体
97.8℃
883℃
质软
0.971g/
良好
结构决定性质,性质决定用途
知识点4:钠的化学性质
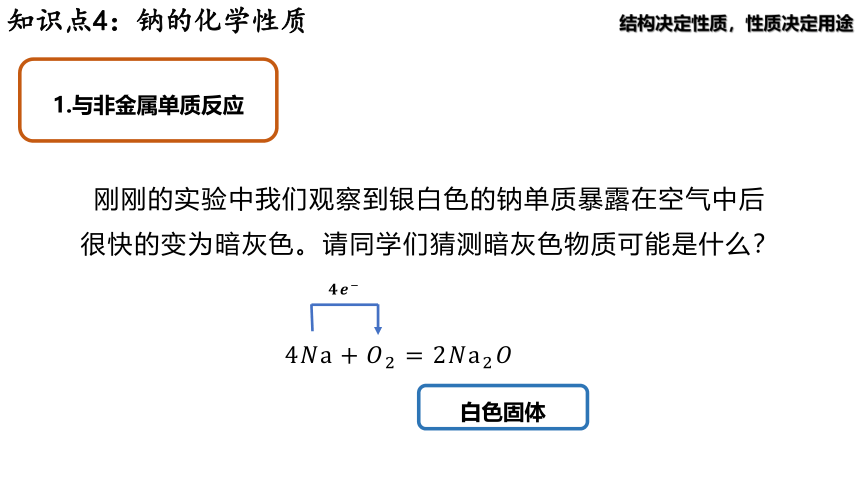
1.与非金属单质反应
刚刚的实验中我们观察到银白色的钠单质暴露在空气中后很快的变为暗灰色。请同学们猜测暗灰色物质可能是什么?
白色固体
结构决定性质,性质决定用途
实验2
在加热条件下,钠与氧气会发生什么样的反应?
知识点4:钠的化学性质
实验步骤:在干燥的坩埚中加热,同时切取一块绿豆大小的钠,迅速投到热的坩埚中,继续加热至钠熔化后撤掉酒精灯。
实验现象:钠受热后先熔化,然后与氧气剧烈反应并放出
大量的热量,发出黄色火焰,生成一种淡黄色固体
2
淡黄色固体
结构决定性质,性质决定用途
注意:①-1价的氧不能单独存在,一定是以过氧根的形式存在;
②中阴阳离子个数比都是2:1
知识点4:钠的化学性质
归纳:Na 与 在不同条件下的反应产物不同
常温:
加热:
在特殊条件下也可以实现、 的转化
结构决定性质,性质决定用途
高温
高压
知识点4:钠的化学性质
常温
加热
特殊条件:高温高压
结构决定性质,性质决定用途
知识点4:钠的化学性质
1.与非金属单质反应
钠与其他非金属单质反应
点燃
点燃
结构决定性质,性质决定用途
知识点4:钠的化学性质
2.与化合物反应
实验预测:请同学们从氧化还原反应的角度预测钠与水反应会生成什么样的物质?
Na具有强还原性,已失去电子,化学价升高,生成+1价的
那么若能不能作为氧化剂呢?又是谁来得电子?
的氧已经达到最低价态-2价,不能再获得电子,只能由+1价的氢获取电子,最终生成氢气,同时剩余部分结合生成NaOH
结构决定性质,性质决定用途
知识点4:钠的化学性质
设计实验:①如何检验生成了?
②如何检验生成了NaOH?
产生气泡;收集一定量产生的气体,在玻璃尖嘴处点燃气体,罩一个干冷的小烧杯,观察杯壁是否有水滴产生;然后气体再通入澄清石灰水中,且不变浑浊。
酚酞溶液,利用碱使酸碱指示剂变色的原理
结构决定性质,性质决定用途
知识点4:钠的化学性质
实验现象:
①钠浮在水面上
②小球在水面上迅速游动
③钠熔成闪亮的小球
④发出“丝丝”的响声
⑤反应后溶液变红
现象解释:
①钠的密度比水小
②钠的熔点低,且反应放热
③反应产生气体
④反应剧烈
⑤反应产生了碱性物质
结构决定性质,性质决定用途
知识点4:钠的化学性质
实验现象:
①钠浮在水面上
②小球在水面上迅速游动
③钠熔成闪亮的小球
④发出“丝丝”的响声
⑤反应后溶液变红
实验结论:
预测是正确的,产生了与NaOH
结构决定性质,性质决定用途
失
得
知识点4:钠的化学性质
应用
①金属钠该如何保存?
②当储备有钠的实验室起火时该如何扑灭
钠能与和,因此金属钠的保存原则应该隔绝空气,保存在煤油或石蜡油中。
不能使用水或常规灭火器,只能用沙土灭火
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
Na与反应的实质是与部分电离出来的反应
水是弱电解质
(1)钠与酸溶液反应
酸溶液中存在大量的,钠金属投入酸中优先与酸电离的反应
如果钠过量,酸消耗殆尽后,再与水反应
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
(2)钠与碱溶液反应
反应实质就是钠与水的反应
若钠投入到饱和澄清石灰水中,会观察到什么实验现象?
1.反应产生气体,放出大量的热量
2.由于的溶解度随温度的升高而减小,因此还能观察到溶液变浑浊,有沉淀生成
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
(3)钠与盐溶液反应
1.若盐溶液中的溶质不与NaOH反应,则反应停止,仅Na与水反应
2.若盐溶液中的溶质与NaOH反应
以溶液为例,则进行第二过程的反应:
总反应:
3.若盐溶液是溶液,,反应实质与酸相同
结构决定性质,性质决定用途
元素化学部分的学习方法
存在形式
生活中常见的物质
原子结构
物质性质
物质用途
物理性质与化学性质
核心思路
结构决定性质
性质决定用途
最外层电子
能力提升2:钠与水反应的实验拓展
结构决定性质,性质决定用途
能力提升2:钠与水反应的实验拓展
结构决定性质,性质决定用途
知识点5:钠的氧化物
第二部分:钠的化合物
、的异同点
同:1.都是由钠元素、氧元素组成,同属于氧化物
2.阴阳离子个数比为1:2
异:1. 是白色固体, 是淡黄色固体
2. 中阴离子为
从物质类别的角度预测、与水的反应
知识点5:钠的氧化物
第二部分:钠的化合物
设计实验
取同等、分别投入到试管中,用胶头滴管分别滴入2~3mL蒸馏水,观察实验现象。反应结束后再滴入适量酚酞溶液,观察实验现象。
加入的试管现象
①固体物质再滴入水后逐渐消融
②试管变烫(类比氧化钙与水的反应)
③滴入酚酞试剂后,溶液变红
知识点5:钠的氧化物
第二部分:钠的化合物
与水的实验现象
①固体物质消融,反应放热
②产生可以让带火星小木条复燃的气体
③滴入酚酞后溶液变红,且一段时间后褪色
知识点5:钠的氧化物
是碱性氧化物
是过氧化物
第一步
第二步
总
知识点5:钠的氧化物
失
得
1
歧化反应
归中反应
高温
4
2
失
得
知识点5:钠的氧化物
失
得
1
5
1
4
化合价不交叉原则
知识点5:钠的氧化物
二氧化碳的反应
不需要打气体符号
知识点5:钠的氧化物
归纳
性质异同 物质
组成结构 2:1 2:1
氧元素化合价 -2 -1
类别 碱性氧化物 过氧化物
颜色、状态 白色固体 淡黄色固体
与反应
与反应
转化反应 应用用途 用于制备NaOH 可作为漂白剂、供氧剂
知识点5:钠的盐
最常见的钠盐:
:白色粉末(颗粒较大)
:细小的白色晶体
知识点5:钠的盐
的性质探究实验
实验现象
操作 1g 1g
①观察外观 白色粉末 细小的白色晶体
②向两支分别装有的试管中滴入几滴水,振荡 加水结块,变成晶体,7、10) 加水,部分溶解
③插入温度计 示数上升明显,说明溶解放热 示数略下降,说明溶解吸热
④继续向②的试管中分别加入5mL水,用力振荡 完全溶解 固体量减少,部分溶解
⑤分别向③所得溶液中滴入1~2滴酚酞溶液 溶液呈红色 溶液呈粉红色
知识点5:钠的盐
的性质探究实验
实验现象
①装有固体的试管,滴入几滴水后,固体结块变成晶体, 7、10);
观察温度计,温度上升,说明溶解过程放热;
加入大量蒸馏水后,固体物质完全溶解,溶液无色透明,说明可溶于水。
②
人教版必修一
第二章海水中重要的元素——钠和氯
第一节 钠及其化合物
知识点1:钠元素的存在形式
钠元素在自然界以化合态的形式存在,即自然条件下不存在钠单质
氯化钠
NaCl
食盐
碳酸钠
苏打、纯碱
碳酸氢钠
小苏打
硫代硫酸钠
大苏打、海波
硫化钠
臭苏打
结构决定性质,性质决定用途
知识点2:钠的原子结构
钠元素位于元素周期表的第三周期 第ⅠA族,第11号元素
+11
原子结构示意图
2
8
圆圈:原子核
数字表示:质子数
1
核外电子
最外层电子
强还原性
为了达到最外层电子数为8的稳定状态,钠的最外层电子易失去
结构决定性质,性质决定用途
知识点3:钠的物理性质
钠的保存方式:
钠单质通常保存于装有煤油或石蜡油的试剂瓶中,密封避光
通体为暗灰色
结构决定性质,性质决定用途
钠金属表面的暗灰色是否是钠的真正颜色?
知识点3:钠的物理性质
实验1
用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油
在滤纸上用小刀切去一端的外皮。观察金属钠的表面变化。
实验现象:
用小刀切开露出银白色切面,具有金属光泽,但很快银白色切面变暗,重新变为暗灰色
结构决定性质,性质决定用途
知识点3:钠的物理性质
颜色
状态
熔点
沸点
硬度
密度
导电、导热性
银白色、具有金属光泽
固体
97.8℃
883℃
质软
0.971g/
良好
结构决定性质,性质决定用途
知识点4:钠的化学性质
1.与非金属单质反应
刚刚的实验中我们观察到银白色的钠单质暴露在空气中后很快的变为暗灰色。请同学们猜测暗灰色物质可能是什么?
白色固体
结构决定性质,性质决定用途
实验2
在加热条件下,钠与氧气会发生什么样的反应?
知识点4:钠的化学性质
实验步骤:在干燥的坩埚中加热,同时切取一块绿豆大小的钠,迅速投到热的坩埚中,继续加热至钠熔化后撤掉酒精灯。
实验现象:钠受热后先熔化,然后与氧气剧烈反应并放出
大量的热量,发出黄色火焰,生成一种淡黄色固体
2
淡黄色固体
结构决定性质,性质决定用途
注意:①-1价的氧不能单独存在,一定是以过氧根的形式存在;
②中阴阳离子个数比都是2:1
知识点4:钠的化学性质
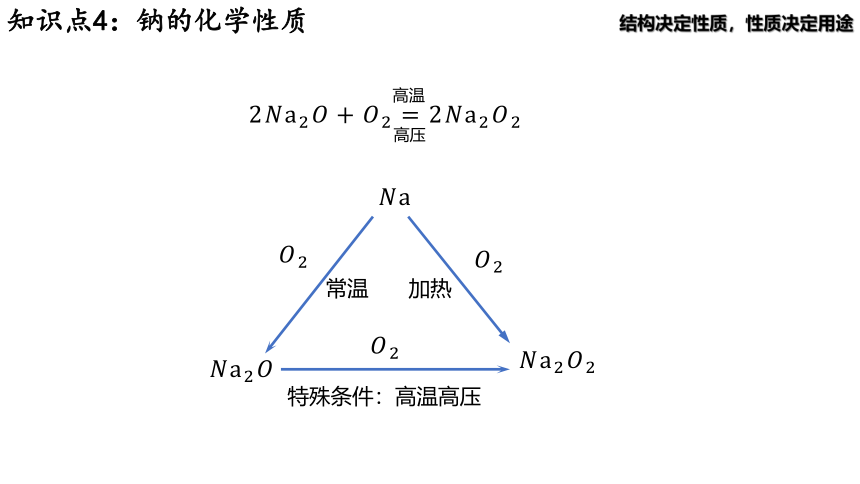
归纳:Na 与 在不同条件下的反应产物不同
常温:
加热:
在特殊条件下也可以实现、 的转化
结构决定性质,性质决定用途
高温
高压
知识点4:钠的化学性质
常温
加热
特殊条件:高温高压
结构决定性质,性质决定用途
知识点4:钠的化学性质
1.与非金属单质反应
钠与其他非金属单质反应
点燃
点燃
结构决定性质,性质决定用途
知识点4:钠的化学性质
2.与化合物反应
实验预测:请同学们从氧化还原反应的角度预测钠与水反应会生成什么样的物质?
Na具有强还原性,已失去电子,化学价升高,生成+1价的
那么若能不能作为氧化剂呢?又是谁来得电子?
的氧已经达到最低价态-2价,不能再获得电子,只能由+1价的氢获取电子,最终生成氢气,同时剩余部分结合生成NaOH
结构决定性质,性质决定用途
知识点4:钠的化学性质
设计实验:①如何检验生成了?
②如何检验生成了NaOH?
产生气泡;收集一定量产生的气体,在玻璃尖嘴处点燃气体,罩一个干冷的小烧杯,观察杯壁是否有水滴产生;然后气体再通入澄清石灰水中,且不变浑浊。
酚酞溶液,利用碱使酸碱指示剂变色的原理
结构决定性质,性质决定用途
知识点4:钠的化学性质
实验现象:
①钠浮在水面上
②小球在水面上迅速游动
③钠熔成闪亮的小球
④发出“丝丝”的响声
⑤反应后溶液变红
现象解释:
①钠的密度比水小
②钠的熔点低,且反应放热
③反应产生气体
④反应剧烈
⑤反应产生了碱性物质
结构决定性质,性质决定用途
知识点4:钠的化学性质
实验现象:
①钠浮在水面上
②小球在水面上迅速游动
③钠熔成闪亮的小球
④发出“丝丝”的响声
⑤反应后溶液变红
实验结论:
预测是正确的,产生了与NaOH
结构决定性质,性质决定用途
失
得
知识点4:钠的化学性质
应用
①金属钠该如何保存?
②当储备有钠的实验室起火时该如何扑灭
钠能与和,因此金属钠的保存原则应该隔绝空气,保存在煤油或石蜡油中。
不能使用水或常规灭火器,只能用沙土灭火
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
Na与反应的实质是与部分电离出来的反应
水是弱电解质
(1)钠与酸溶液反应
酸溶液中存在大量的,钠金属投入酸中优先与酸电离的反应
如果钠过量,酸消耗殆尽后,再与水反应
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
(2)钠与碱溶液反应
反应实质就是钠与水的反应
若钠投入到饱和澄清石灰水中,会观察到什么实验现象?
1.反应产生气体,放出大量的热量
2.由于的溶解度随温度的升高而减小,因此还能观察到溶液变浑浊,有沉淀生成
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
结构决定性质,性质决定用途
能力提升1:钠与酸、碱、盐溶液的反应规律
(3)钠与盐溶液反应
1.若盐溶液中的溶质不与NaOH反应,则反应停止,仅Na与水反应
2.若盐溶液中的溶质与NaOH反应
以溶液为例,则进行第二过程的反应:
总反应:
3.若盐溶液是溶液,,反应实质与酸相同
结构决定性质,性质决定用途
元素化学部分的学习方法
存在形式
生活中常见的物质
原子结构
物质性质
物质用途
物理性质与化学性质
核心思路
结构决定性质
性质决定用途
最外层电子
能力提升2:钠与水反应的实验拓展
结构决定性质,性质决定用途
能力提升2:钠与水反应的实验拓展
结构决定性质,性质决定用途
知识点5:钠的氧化物
第二部分:钠的化合物
、的异同点
同:1.都是由钠元素、氧元素组成,同属于氧化物
2.阴阳离子个数比为1:2
异:1. 是白色固体, 是淡黄色固体
2. 中阴离子为
从物质类别的角度预测、与水的反应
知识点5:钠的氧化物
第二部分:钠的化合物
设计实验
取同等、分别投入到试管中,用胶头滴管分别滴入2~3mL蒸馏水,观察实验现象。反应结束后再滴入适量酚酞溶液,观察实验现象。
加入的试管现象
①固体物质再滴入水后逐渐消融
②试管变烫(类比氧化钙与水的反应)
③滴入酚酞试剂后,溶液变红
知识点5:钠的氧化物
第二部分:钠的化合物
与水的实验现象
①固体物质消融,反应放热
②产生可以让带火星小木条复燃的气体
③滴入酚酞后溶液变红,且一段时间后褪色
知识点5:钠的氧化物
是碱性氧化物
是过氧化物
第一步
第二步
总
知识点5:钠的氧化物
失
得
1
歧化反应
归中反应
高温
4
2
失
得
知识点5:钠的氧化物
失
得
1
5
1
4
化合价不交叉原则
知识点5:钠的氧化物
二氧化碳的反应
不需要打气体符号
知识点5:钠的氧化物
归纳
性质异同 物质
组成结构 2:1 2:1
氧元素化合价 -2 -1
类别 碱性氧化物 过氧化物
颜色、状态 白色固体 淡黄色固体
与反应
与反应
转化反应 应用用途 用于制备NaOH 可作为漂白剂、供氧剂
知识点5:钠的盐
最常见的钠盐:
:白色粉末(颗粒较大)
:细小的白色晶体
知识点5:钠的盐
的性质探究实验
实验现象
操作 1g 1g
①观察外观 白色粉末 细小的白色晶体
②向两支分别装有的试管中滴入几滴水,振荡 加水结块,变成晶体,7、10) 加水,部分溶解
③插入温度计 示数上升明显,说明溶解放热 示数略下降,说明溶解吸热
④继续向②的试管中分别加入5mL水,用力振荡 完全溶解 固体量减少,部分溶解
⑤分别向③所得溶液中滴入1~2滴酚酞溶液 溶液呈红色 溶液呈粉红色
知识点5:钠的盐
的性质探究实验
实验现象
①装有固体的试管,滴入几滴水后,固体结块变成晶体, 7、10);
观察温度计,温度上升,说明溶解过程放热;
加入大量蒸馏水后,固体物质完全溶解,溶液无色透明,说明可溶于水。
②
