人教版(2019)选择性必修二 1.1.1 能层与能级、基态与激发态、原子光谱 (共20张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 1.1.1 能层与能级、基态与激发态、原子光谱 (共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 08:49:09 | ||
图片预览







文档简介
(共20张PPT)
第一章 原子结构与性质
1.1.1能层与能级 基态与激发态 原子光谱
新人教化学选择性必修二《物质结构与性质》
激光是20世纪以来继核能、信息技术、生物技术等之后人类的又一重大发明,被称为“最快的刀”“最准的尺”“最亮的光”。
激光的产生与原子核外电子跃迁释放能量有关。
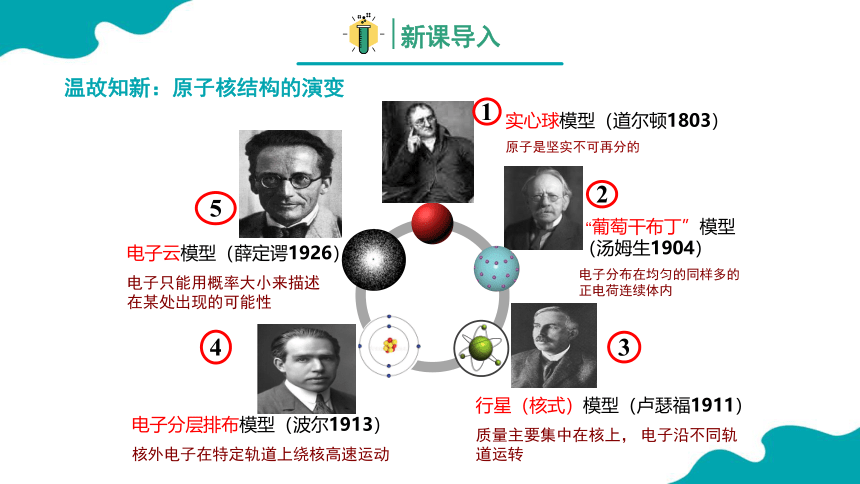
温故知新:原子核结构的演变
“葡萄干布丁”模型(汤姆生1904)
电子分布在均匀的同样多的正电荷连续体内
实心球模型(道尔顿1803)
原子是坚实不可再分的
1
2
行星(核式)模型(卢瑟福1911)
质量主要集中在核上, 电子沿不同轨道运转
3
电子分层排布模型(波尔1913)
核外电子在特定轨道上绕核高速运动
4
电子云模型(薛定谔1926)
电子只能用概率大小来描述在某处出现的可能性
5
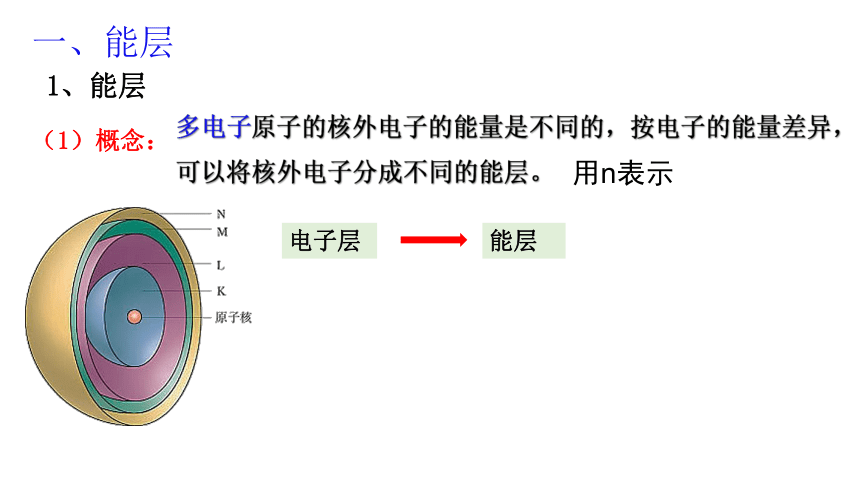
一、能层
1、能层
(1)概念:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
电子层
能层
用n表示
(2)表示方法及各能层最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2=2×12 8=2×22 18=2×32 32=2×42 50=2×52 72=2×62 98=2×72
能层越高,电子的能量越高。
能量的高低顺序为E(K)①能量规律
②数量规律
每层容纳的电子数不超过2n2(n为能层序数)
玻尔——核外电子分布分层排布的原子结构模型
①原子中的电子在具有确定能层上绕原子核运动,并且不辐射能量
②在不同能层上运动的电子具有不同的能量(E),而且能量值是不连续的
③只有当电子从一个轨道(Ei)跃迁到另一个轨道(Ej)时,才会辐射或吸收能量
二、基态与激发态 原子光谱
1、能量最低原理
原子的电子排布遵循能量最低原则使整个原子的能量处于 状态
最低
2、基态原子与激发态原子
原子
基态原子(稳定)
激发态原子(不稳定)
处于最低能量
处于较高能量
吸收能量
释放能量
基态原子
激发态原子
吸收能量
释放能量
能量较高
能量最低
3、光谱与光谱分析
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
光
能量
能量
基态
激发态
激发态原子不稳定,易 能量变为基态原子,其能量可转化为 。
释放
光
E=hv
思考:为什么钠的焰色试验出现黄光?锂为紫红色?
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱:暗背景、亮线
吸收光谱:亮背景、暗线
4、原子光谱
频率相同,线状不连续。
【思考】(1)同一元素发射光谱和吸收光谱有什么异同?
Li、He、Hg发射光谱
Li、He、Hg吸收光谱
钠原子中处于n=4的状态上的核外电子跃迁到n=3的状态,会产生多条谱线,为什么?
同一能层的不同电子所具有的能量存在差异
三.能级
(1)分类依据:
在多电子原子中,同一能层的电子,能量也可能 ,还可以把它们分成 。
不同
能级
能层是楼层,能级是楼梯的阶梯
(电子亚层)
(2)符号 :任一能层的能级都是从 s 能级开始,依次称p、d、f、g能级……
ns、np、nd、nf...(n代表能层)
能级数=该能层序数
第一能层有__个能级,即____
第二能层有__个能级,即_______
1s
2s、2p
1
2
能层 K L M N O 能级 …
最多容纳电子 …
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
(3)表示方法及各能级最多容纳的电子数
1、在每一能层中,能级符号的顺序是:ns、 np、nd、nf……(n代表能层)
2、任一能层的能级总的从s能级开始:能级数=该能层序数
5、不同能层中,能级的能量高低是 1s<2s<3s<4s….
3、各能级所在能层的取值
ns(n≥1)
np(n≥2)
nd(n≥3)
nf(n≥4)
4、每一能层最多可容纳2n2个电子,以s、p、d、f……排序的各能级可容
纳的最多电子数依次为1、3、5、7……的二倍
2p<3p<4p…
6、在同一能层中,能级的能量高低是 ns【归纳与拓展】
四、原子光谱的应用
(1)发现新元素
如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
1868年科学家们通过太阳光谱的分析发现了稀有气体氦。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
(2)检验元素
不同元素的焰色试验
光(辐射)是电子释放能量的重要形式之一。焰火、霓虹灯光、激光、荧光、LED 灯光等都与核外电子跃迁释放能量有关。
(3)生产生活
烟火
霓虹灯
②各能级(s、p、d、f ……)上所能容纳的电子数依次为1、3、 、7…… 的2倍。( )
①原子核外电子按能量不同分为不同的能层,同一能层又按能量不同分为不同的能级。( )
√
③能层离核越近能量越低。( )
④同一能层的电子能量一定相同。( )
×
⑤同一原子中,同一能层同一能级的电子能量一定相同。( )
⑥第 能层最多能容纳的电子数为 ,所以钠原子的第三能层填有18个电子( )
课堂练习1、判断正误
√
√
×
√
课堂练习2、下列能级符号书写错误 的是( @45@ )。
A. B. C. D.
B
课堂练习3、判断正误
(1)光(辐射)是电子跃迁释放能量的重要形式之一( )
(2)霓虹灯光、激光、萤光都与原子核外电子跃迁吸收能量有关( )
(3)产生激光的前提是原子要处于激发态( )
(4)同一原子处于激发态时的能量一定高于基态时的能量( )
×
√
√
√
一、 能层与能级
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
2 8 18 32 50 二、基态与激发态 原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
【课堂小结】
第一章 原子结构与性质
1.1.1能层与能级 基态与激发态 原子光谱
新人教化学选择性必修二《物质结构与性质》
激光是20世纪以来继核能、信息技术、生物技术等之后人类的又一重大发明,被称为“最快的刀”“最准的尺”“最亮的光”。
激光的产生与原子核外电子跃迁释放能量有关。
温故知新:原子核结构的演变
“葡萄干布丁”模型(汤姆生1904)
电子分布在均匀的同样多的正电荷连续体内
实心球模型(道尔顿1803)
原子是坚实不可再分的
1
2
行星(核式)模型(卢瑟福1911)
质量主要集中在核上, 电子沿不同轨道运转
3
电子分层排布模型(波尔1913)
核外电子在特定轨道上绕核高速运动
4
电子云模型(薛定谔1926)
电子只能用概率大小来描述在某处出现的可能性
5
一、能层
1、能层
(1)概念:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
电子层
能层
用n表示
(2)表示方法及各能层最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2=2×12 8=2×22 18=2×32 32=2×42 50=2×52 72=2×62 98=2×72
能层越高,电子的能量越高。
能量的高低顺序为E(K)
②数量规律
每层容纳的电子数不超过2n2(n为能层序数)
玻尔——核外电子分布分层排布的原子结构模型
①原子中的电子在具有确定能层上绕原子核运动,并且不辐射能量
②在不同能层上运动的电子具有不同的能量(E),而且能量值是不连续的
③只有当电子从一个轨道(Ei)跃迁到另一个轨道(Ej)时,才会辐射或吸收能量
二、基态与激发态 原子光谱
1、能量最低原理
原子的电子排布遵循能量最低原则使整个原子的能量处于 状态
最低
2、基态原子与激发态原子
原子
基态原子(稳定)
激发态原子(不稳定)
处于最低能量
处于较高能量
吸收能量
释放能量
基态原子
激发态原子
吸收能量
释放能量
能量较高
能量最低
3、光谱与光谱分析
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
光
能量
能量
基态
激发态
激发态原子不稳定,易 能量变为基态原子,其能量可转化为 。
释放
光
E=hv
思考:为什么钠的焰色试验出现黄光?锂为紫红色?
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱,总称原子光谱。
发射光谱:暗背景、亮线
吸收光谱:亮背景、暗线
4、原子光谱
频率相同,线状不连续。
【思考】(1)同一元素发射光谱和吸收光谱有什么异同?
Li、He、Hg发射光谱
Li、He、Hg吸收光谱
钠原子中处于n=4的状态上的核外电子跃迁到n=3的状态,会产生多条谱线,为什么?
同一能层的不同电子所具有的能量存在差异
三.能级
(1)分类依据:
在多电子原子中,同一能层的电子,能量也可能 ,还可以把它们分成 。
不同
能级
能层是楼层,能级是楼梯的阶梯
(电子亚层)
(2)符号 :任一能层的能级都是从 s 能级开始,依次称p、d、f、g能级……
ns、np、nd、nf...(n代表能层)
能级数=该能层序数
第一能层有__个能级,即____
第二能层有__个能级,即_______
1s
2s、2p
1
2
能层 K L M N O 能级 …
最多容纳电子 …
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
(3)表示方法及各能级最多容纳的电子数
1、在每一能层中,能级符号的顺序是:ns、 np、nd、nf……(n代表能层)
2、任一能层的能级总的从s能级开始:能级数=该能层序数
5、不同能层中,能级的能量高低是 1s<2s<3s<4s….
3、各能级所在能层的取值
ns(n≥1)
np(n≥2)
nd(n≥3)
nf(n≥4)
4、每一能层最多可容纳2n2个电子,以s、p、d、f……排序的各能级可容
纳的最多电子数依次为1、3、5、7……的二倍
2p<3p<4p…
6、在同一能层中,能级的能量高低是 ns
四、原子光谱的应用
(1)发现新元素
如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
1868年科学家们通过太阳光谱的分析发现了稀有气体氦。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
(2)检验元素
不同元素的焰色试验
光(辐射)是电子释放能量的重要形式之一。焰火、霓虹灯光、激光、荧光、LED 灯光等都与核外电子跃迁释放能量有关。
(3)生产生活
烟火
霓虹灯
②各能级(s、p、d、f ……)上所能容纳的电子数依次为1、3、 、7…… 的2倍。( )
①原子核外电子按能量不同分为不同的能层,同一能层又按能量不同分为不同的能级。( )
√
③能层离核越近能量越低。( )
④同一能层的电子能量一定相同。( )
×
⑤同一原子中,同一能层同一能级的电子能量一定相同。( )
⑥第 能层最多能容纳的电子数为 ,所以钠原子的第三能层填有18个电子( )
课堂练习1、判断正误
√
√
×
√
课堂练习2、下列能级符号书写
A. B. C. D.
B
课堂练习3、判断正误
(1)光(辐射)是电子跃迁释放能量的重要形式之一( )
(2)霓虹灯光、激光、萤光都与原子核外电子跃迁吸收能量有关( )
(3)产生激光的前提是原子要处于激发态( )
(4)同一原子处于激发态时的能量一定高于基态时的能量( )
×
√
√
√
一、 能层与能级
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
2 8 18 32 50 二、基态与激发态 原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
【课堂小结】
