人教版(2019)选择性必修二 分子结构与物质的性质 复习课件(共21张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 分子结构与物质的性质 复习课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 08:59:00 | ||
图片预览





文档简介
(共21张PPT)
《物质结构与性质》专题复习(第八课时)
分子结构与物质的性质(一)
册 别:选择性必修2
学 科:高中化学(人教版)
【课程学习目标】
1. 知道共价键可分为极性共价键和非极性共价键;能利用
电负性判断共价键的极性
2. 知道分子可以分为极性分子和非极性分子,知道分子极
性与分子中键的极性、分子的空间结构密切相关
3. 能根据分子结构的特点和键的极性判断分子的极性,并
据此对分子的一些典型性质及其应用作出解释
思维热身:1.复习化学键和电负性的概念。
2.由相同或不同原子形成的共价键,电子对是否会发生偏移?
如发生偏移,是怎样偏移的?
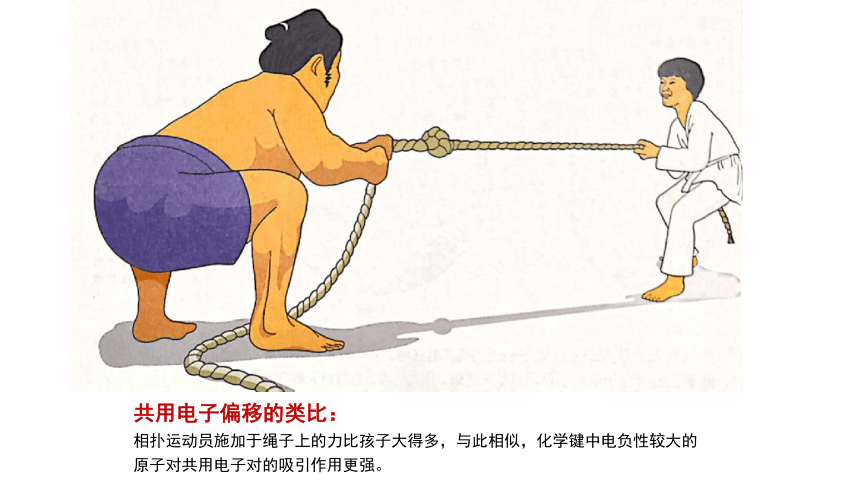
共用电子偏移的类比:
相扑运动员施加于绳子上的力比孩子大得多,与此相似,化学键中电负性较大的原子对共用电子对的吸引作用更强。
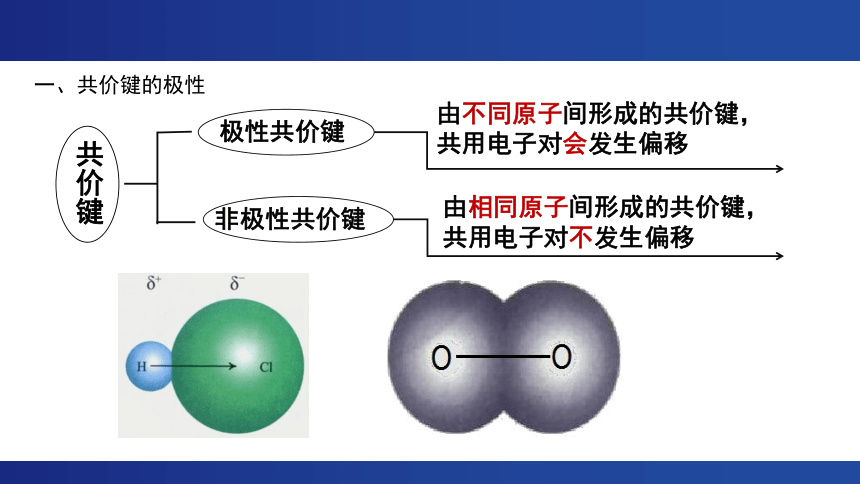
共价键
极性共价键
非极性共价键
由不同原子间形成的共价键,
共用电子对会发生偏移
由相同原子间形成的共价键,
共用电子对不发生偏移
一、共价键的极性
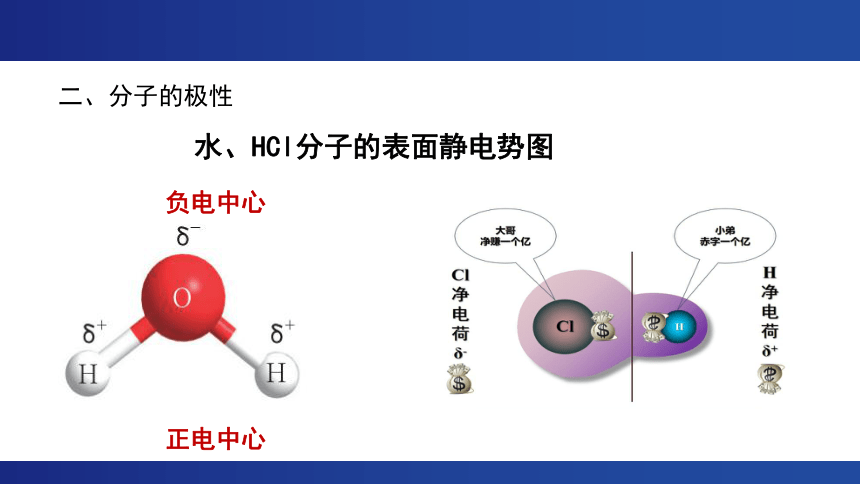
分子的极性及其应用
水、HCl分子的表面静电势图
负电中心
正电中心
二、分子的极性
正电中心和负电中心不重合
分子的正电中心和负电中性重合
二、分子的极性
水、氨气、氯化氢、CH3Cl 等
CH4、CO2、大部分非金属单质
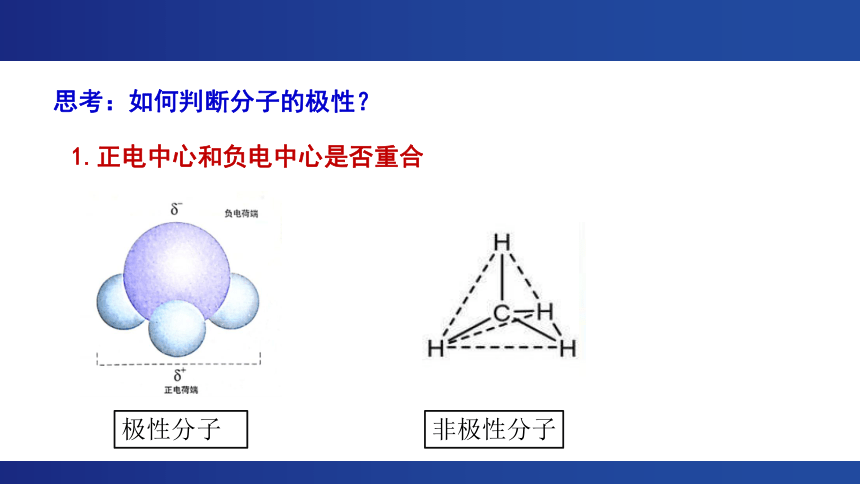
思考:如何判断分子的极性?
1.正电中心和负电中心是否重合
非极性分子
极性分子
思考:如何判断分子的极性?
2.化学键的极性的向量和是否为零
非极性分子
极性分子
中心原子化合价的绝对值
该元素的价电子数
=
非极性分子
中心原子化合价的绝对值
该元素的价电子数
≠
极性分子
思考:如何判断分子的极性?
3.中心原子化合价的绝对值是否等于该元素的价电子数
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
化合价法
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
分子的空间结构中心不对称
V形
三角锥形
四面体
……
有孤电子对
有不同键
一样的键
直线形
极性分子
非极性分子
思考:如何判断分子的极性?
4.根据分子的空间结构判断
思考:判断下列分子的极性。
①稀有气体分子是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
特殊的分子的极性
三、键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa=-lgKa
思考:怎样的结构会使乙酸中的H+更易电离?
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
思考:吸电子基团、推电子基团对羧基电离H+的影响如何?
请解释下列现象的原因:
1、氯乙酸的酸性大于乙酸
2、三氯乙酸的酸性大于二氯乙酸
3、三氟乙酸的酸性大于三氯乙酸
4、丙酸的酸性弱于乙酸
结论 1:
与羧基相连碳上的 H 被 Cl 取代时,羟基极性增大,酸性增强。
结论 2:
与羧基相连的碳原子上取代的氯原子越多,羟基极性越大,酸性越强。
结论 3:
与羧基相连的碳原子上取代基电负性越大,羟基极性越大,酸性越强。
结论 4:
与羧基相连的烃基越长,羧基中羟基极性越小,酸性越弱。
(1)羧酸酸性
推电子基团越多,酸性越弱
吸电子基团越多,酸性越强
【归纳小结】
键的极性对化学性质的影响
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
拓展:无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
(1)羧酸酸性
推电子基团越多,酸性越弱
吸电子基团越多,酸性越强
(2)沸点
在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
(3)溶解性
极性分子易溶于极性溶剂,如氨、乙醇等极性分子易溶于水;
非极性分子易溶于非极性溶剂,如油脂、石油的成分多不溶于水,而溶于非极性或极性较小的有机溶剂。 相似相溶原理
【归纳小结】
键的极性对物质性质的影响
《物质结构与性质》专题复习(第八课时)
分子结构与物质的性质(一)
册 别:选择性必修2
学 科:高中化学(人教版)
【课程学习目标】
1. 知道共价键可分为极性共价键和非极性共价键;能利用
电负性判断共价键的极性
2. 知道分子可以分为极性分子和非极性分子,知道分子极
性与分子中键的极性、分子的空间结构密切相关
3. 能根据分子结构的特点和键的极性判断分子的极性,并
据此对分子的一些典型性质及其应用作出解释
思维热身:1.复习化学键和电负性的概念。
2.由相同或不同原子形成的共价键,电子对是否会发生偏移?
如发生偏移,是怎样偏移的?
共用电子偏移的类比:
相扑运动员施加于绳子上的力比孩子大得多,与此相似,化学键中电负性较大的原子对共用电子对的吸引作用更强。
共价键
极性共价键
非极性共价键
由不同原子间形成的共价键,
共用电子对会发生偏移
由相同原子间形成的共价键,
共用电子对不发生偏移
一、共价键的极性
分子的极性及其应用
水、HCl分子的表面静电势图
负电中心
正电中心
二、分子的极性
正电中心和负电中心不重合
分子的正电中心和负电中性重合
二、分子的极性
水、氨气、氯化氢、CH3Cl 等
CH4、CO2、大部分非金属单质
思考:如何判断分子的极性?
1.正电中心和负电中心是否重合
非极性分子
极性分子
思考:如何判断分子的极性?
2.化学键的极性的向量和是否为零
非极性分子
极性分子
中心原子化合价的绝对值
该元素的价电子数
=
非极性分子
中心原子化合价的绝对值
该元素的价电子数
≠
极性分子
思考:如何判断分子的极性?
3.中心原子化合价的绝对值是否等于该元素的价电子数
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
化合价法
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
分子的空间结构中心不对称
V形
三角锥形
四面体
……
有孤电子对
有不同键
一样的键
直线形
极性分子
非极性分子
思考:如何判断分子的极性?
4.根据分子的空间结构判断
思考:判断下列分子的极性。
①稀有气体分子是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
特殊的分子的极性
三、键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa=-lgKa
思考:怎样的结构会使乙酸中的H+更易电离?
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
思考:吸电子基团、推电子基团对羧基电离H+的影响如何?
请解释下列现象的原因:
1、氯乙酸的酸性大于乙酸
2、三氯乙酸的酸性大于二氯乙酸
3、三氟乙酸的酸性大于三氯乙酸
4、丙酸的酸性弱于乙酸
结论 1:
与羧基相连碳上的 H 被 Cl 取代时,羟基极性增大,酸性增强。
结论 2:
与羧基相连的碳原子上取代的氯原子越多,羟基极性越大,酸性越强。
结论 3:
与羧基相连的碳原子上取代基电负性越大,羟基极性越大,酸性越强。
结论 4:
与羧基相连的烃基越长,羧基中羟基极性越小,酸性越弱。
(1)羧酸酸性
推电子基团越多,酸性越弱
吸电子基团越多,酸性越强
【归纳小结】
键的极性对化学性质的影响
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
拓展:无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
(1)羧酸酸性
推电子基团越多,酸性越弱
吸电子基团越多,酸性越强
(2)沸点
在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
(3)溶解性
极性分子易溶于极性溶剂,如氨、乙醇等极性分子易溶于水;
非极性分子易溶于非极性溶剂,如油脂、石油的成分多不溶于水,而溶于非极性或极性较小的有机溶剂。 相似相溶原理
【归纳小结】
键的极性对物质性质的影响
