人教版(2019)选择性必修三 2.2.1 烯烃 (共52张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修三 2.2.1 烯烃 (共52张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 00:00:00 | ||
图片预览






文档简介
(共52张PPT)
烯烃、炔烃
Olefins and alkynes
人教版高中化学选择性必修3
乙烯
PART 1
三天后
四天后
1、熟苹果可以大大缩短青橘子变熟的时间,你知道为什么吗
乙烯-催熟剂
情境导入
2、天猫超市买到的水果,在水果箱中放入一些用0.2%的KMnO4溶液浸泡过的纸,封严,能延长水果的保质期,你知道原因吗
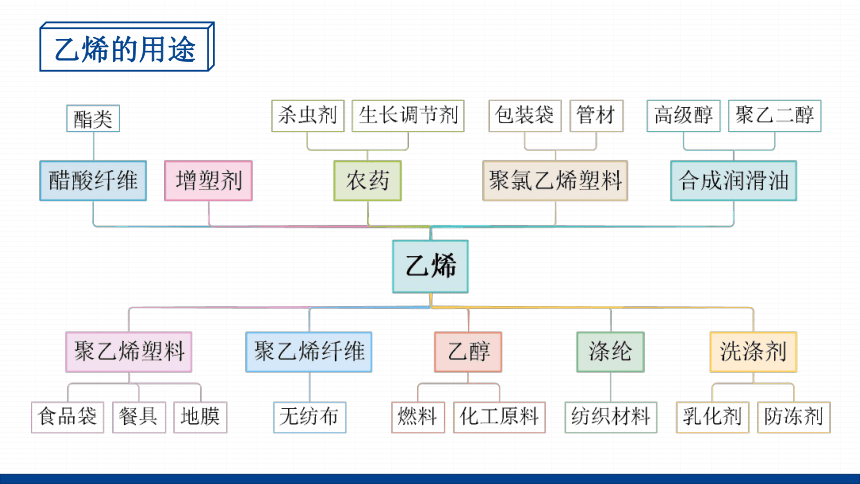
乙烯的用途
乙烯产品占石化产品的75%以上,全球超过35%的有机化合物都要以乙烯为原料来生产。
乙烯的产量是衡量国家石油化工发展水平的标志
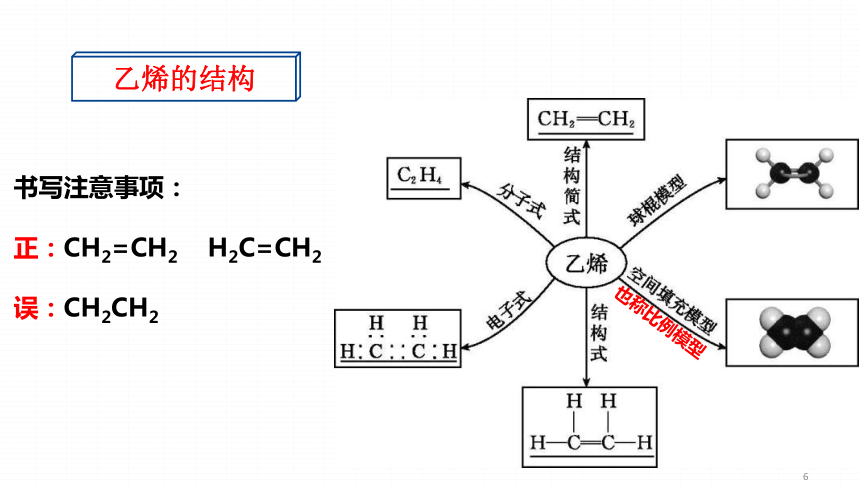
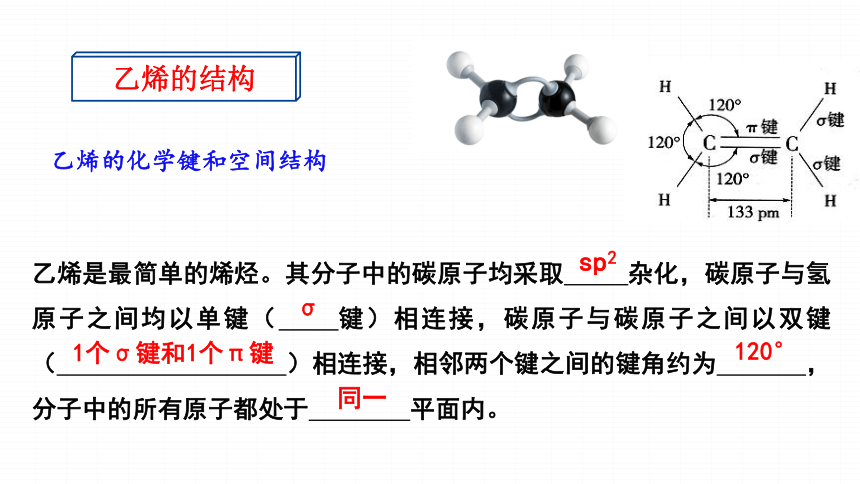
乙烯的结构书写注意事项:正:CH2=CH2H2C=CH2误:CH2CH2也称比例模型乙烯是最简单的烯烃。其分子中的碳原子均采取 杂化,碳原子与氢原子之间均以单键( 键)相连接,碳原子与碳原子之间以双键( )相连接,相邻两个键之间的键角约为 ,分子中的所有原子都处于 平面内。
乙烯的化学键和空间结构
乙烯的结构
sp2
σ
1个σ键和1个π键
120°
同一
乙烯的物理性质
常温下为无色、稍有气味的气体,
比空气轻,难溶于水。
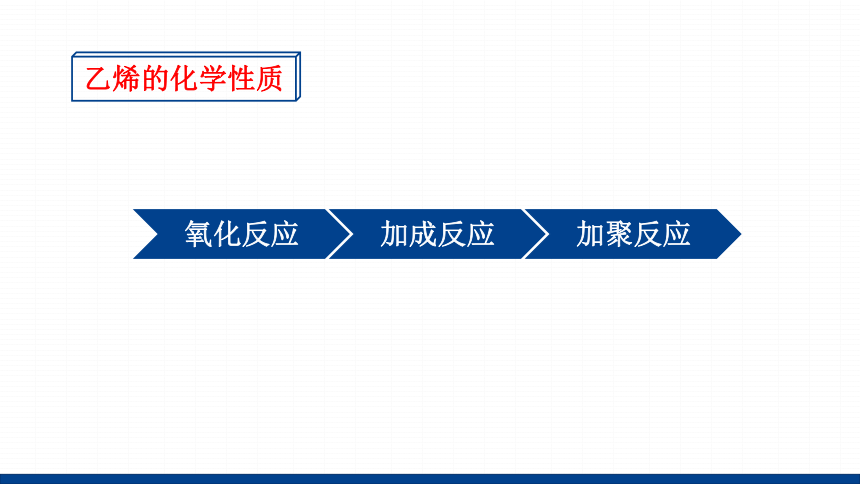
乙烯的化学性质
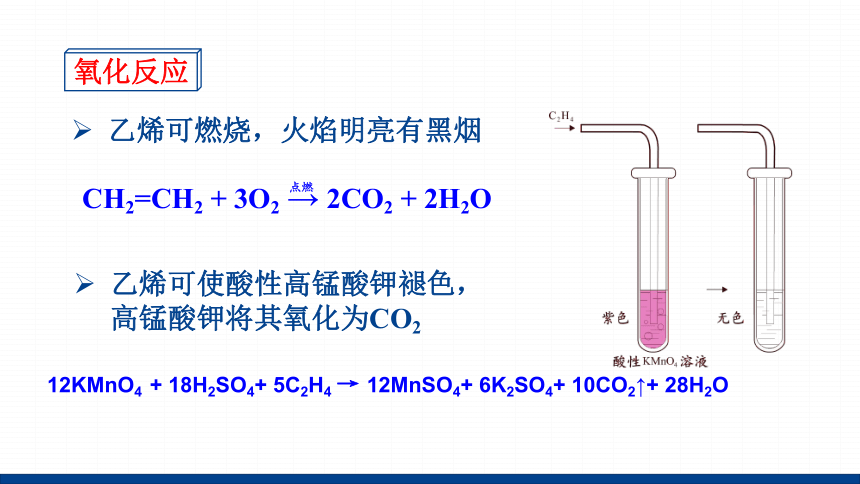
氧化反应
加成反应
加聚反应
乙烯可燃烧,火焰明亮有黑烟
乙烯可使酸性高锰酸钾褪色,高锰酸钾将其氧化为CO2
氧化反应
12KMnO4 + 18H2SO4+ 5C2H4 → 12MnSO4+ 6K2SO4+ 10CO2↑+ 28H2O
CH2=CH2 + 3O2 → 2CO2 + 2H2O
点燃
CH2 CH2 +Br2
有机物分子中双键或三键两端的碳原子与其他原子(或原子团)直接结合成新的化合物的反应叫加成反应
敲
黑
板
加成反应
CH2 CH2
Br Br
1,2-二溴乙烷
我是
溴分子
CH2Br-CH2Br
CH2 CH2 +Br2
CH2 CH2 +H2
CH2 CH2 +HCl
CH2 CH2 +H2O
催化剂
△
催化剂
△
催化剂
△
工业酒精的制备原理
CH3-CH3
CH3-CH2Cl
CH3-CH2OH
加成反应
加成反应
思考
根据已有的知识设计制备氯乙烷的实验方案。
方案1:乙烯和氯化氢的加成反应制备
方案2:利用乙烷和氯气发生取代反应制备
原子利用率达到100%(没有副产物)
除了生成一氯乙烷,还会有氯化氢、二氯乙烷、三氯乙烷……,副产物多,产率低,物质的分离提纯也难。
思考
现有两种无色气体乙烷和乙烯,如何鉴别?
分别将其通入KMnO4溶液中,能使其褪色的为乙烯
分别将其通入Br2的CCl4溶液中,能使其褪色的为乙烯
思考
现有乙烷和乙烯的混合气体,如何除去乙烯?
将混合气体通入溴水中洗气
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
+
+
+
+
加聚反应
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
+
+
+
+
加聚反应
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
加聚反应
CH2 CH2
[ ]n
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
CH2 CH2
[ ]n
nCH2=CH2
一定条件
加聚反应
【例】1 mol乙烯与氯气发生加成反应,反应完全后再与氯气发生取代反应,整个过程中氯气最多消耗( )
A. 3 mol B. 4 mol
C. 5 mol D. 6 mol
C
烯烃的性质
PART 2
烯烃(除乙烯外)分子内碳原子一般存在两种杂化方式:
碳碳双键两端的碳原子以及与之直接相连的四个原子一定在 。
单烯烃的分子通式:
sp2和sp3
C2H4
C3H6
C4H8
C5H10
CnH2n
同一平面
名称 结构简式 沸点 相对密度
乙烯 CH2=CH2 -103.7 0.566
丙烯 CH2=CHCH3 - 47.4 0.5193
1-丁烯 CH2=CHCH2CH3 -6.3 0.5951
1-戊烯 CH2=CH(CH2)2CH3 30 0.6405
1-己烯 CH2=CH(CH2)3CH3 63.3 0.6731
1-庚烯 CH2=CH(CH2)4CH3 93.6 0.6970
【思考】结合单烯烃的结构简式及沸点、相对密度,分析烯烃的物理性质,它们有着怎样的递变性? 为什么?
物理性质
3. 碳原子数相同时,支链越多,沸点越低。
1. 随着分子中碳原子数的递增,沸点逐渐升高。
2. 随着分子中碳原子数的递增,相对密度逐渐增大。
注意:
2. 常温下烯烃的状态
1. 所有烃均难溶于水,密度均小于水
C17以上为固态
C5~C16液态
C1~C4气态
物理性质
【思考】写出乙烯、丙烯与下列物质反应的化学方程式,并说明反应中官能团和化学键的变化。《教材》P33思考与讨论(1)
试剂 乙 烯 丙 烯
①溴
②氯化氢
③水
加成反应
试剂 乙烯 丙烯
溴水
氯化氢
水
CH2=CH2+Br2→CH2BrCH2Br
CH3CH=CH2+Br2→CH3CHBrCH2Br
CH2=CH2+HCl → CH3CH2Cl
催化剂
CH2=CH2+H2O → CH3CH2OH
催化剂
CH3CH=CH2+HCl→CH3CH2CH2Cl
催化剂
CH3CH=CH2+HCl→CH3CHClCH3
催化剂
CH3CH=CH2+H2O→CH3CHOHCH3
催化剂
CH3CH=CH2+H2O→CH3CH2CH2OH
催化剂
CH3-CH=CH2 +HCl
CH3-CH=CH2 +H2O
催化剂
△
催化剂
△
CH3-CH-CH2
-
H
-
Cl
CH3-CH-CH2
-
Cl
-
H
CH3-CH-CH2
-
H
-
OH
CH3-CH-CH2
-
OH
-
H
加成反应
(主要)
(主要)
含氢越多越加氢
氧化反应
将烯烃通入酸性KMnO4中会使溶液颜色 ,
乙烯被氧化为 。
烯烃在空气或氧气中完全燃烧生成CO2和H2O,
燃烧通式为 。
变浅直至消失
现象:
CO2
火焰明亮,冒黑烟
氧化反应
已知某些烯烃被酸性高锰酸钾溶液氧化可生成羧酸和酮
CH3COOH + CH3COCH3
CH3CH=C(CH3)2
KMnO4/H+
【练习】已知某烯烃的化学式为C5H10,它与酸性高锰酸钾
溶液反应后得到的产物为乙酸和丙酸,你能推测出此烯烃
的结构吗?
若与酸性高锰酸钾溶液反应后得到的产物是二氧化碳和CH3CH2 C CH3 (丁酮),此烯烃的结构又是怎样的呢?
O
CH3CH=CHCH2CH3
CH3
CH2=C-CH2CH3
【思考】含有碳碳双键官能团的有机化合物在一定条件下能发生类似乙烯的加聚反应。例如,氯乙烯可以通过加聚反应生成聚氯乙烯:
请根据乙烯、氯乙烯发生的加聚反应,分别写出丙烯、异丁烯(2-甲基-1-丙烯)发生加聚反应的化学方程式。
一定条件
nCH2 = CH
Cl
CH2-CH
[ ]n
Cl
加聚反应
nCH3CH = CH2
一定条件
CH2-CH
[ ]n
CH3
加聚反应
一定条件
n
CH2-CH
[ ]n
一定条件
nCH3C = CH2
CH3
C-CH2
[ ]n
CH3
CH3
烯烃的顺反异构
PART 3
【活动】观察2-丁烯的两个模型,思考:两者是否为同种物质?
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
化学性质基本相同,但物理性质有一定差异。
顺反异构(构型异构)
【思考】为什么会产生顺反异构,下列几种结构哪些有顺反异构?
双键的化合物——由于双键不能自由旋转,当双键连有不同的原子或基团时,就会出现两种不同的空间排布方式,从而产生顺反异构体。
形成顺反异构的条件:
1.有碳碳双键
2.双键的每个碳原子必须连接两个不同的原子或原子团。
C=C
Cl
Cl
H
H
C=C
Cl
H
Cl
H
烯烃的命名
3-甲基-1-丁烯
【步骤】
(1)选主链:将含有双键的最长碳链作为主链,称为“某烯”;
(2)编位号:从距离双键最近的一端给主链上的碳原子依次编号定位;
(3)写名称:用阿拉伯数字标明双键的位置。用“二”“三”等表示双键的个数。
烯烃的命名
思考
化学式为C5H10的烯烃有多少种?
C – C – C – C – C
C – C – C – C
C
-
C – C – C
C
-
-
C
【步骤1】
写出碳链异构
【步骤2】
写出碳碳双键的位置异构
1
1
2
2
1
2
3
1
有5种属于烯烃的同分异构体
【步骤3 】
判断碳碳双键的顺反异构
烯烃的同分异构
思考
化学式为C4H8的有机化合物有多少种?
烯烃
C – C – C – C
C – C – C
C
-
1
2
1
1
1
环烷烃
1
二烯烃的分类及性质
PART 4
通式:
CnH2n 2
②共轭二烯烃
类别:
①累积二烯烃
③孤立二烯烃
C C = C = C C
(不稳定)
C = C C = C C
C = C C C = C
二烯烃的通式及类别
两个双键在碳链中的不同位置:
二烯烃的加成反应
Cl
Cl
+ Cl2
Cl
Cl
1,2-加成
1,4-加成
+ Cl2
二烯烃的加成反应
+
2
二烯烃的加聚反应
n CH2=C CH=CH2
CH3
[ CH2 C=CH CH2 ]n
CH3
催化剂
实验现象
①高锰酸钾溶液 ;
②溴的四氯化碳溶液 ;
③D处点燃后,火焰 且伴有 。
紫色褪去
橙红色褪去
明亮
黑烟
实验结论
石蜡油(烷烃)分解产物中有不同于烷烃(饱和烃)的物质产生,即不饱和烃(烯烃)。
C16H34 C8H18 + C8H16
催化剂
△
C8H18 C4H10 + C4H8
催化剂
△
C4H10 C2H6 + C2H4
催化剂
△
C4H10 CH4 + C3H6
催化剂
△
烷烃
饱和烃
不饱和烃
烷烃
烯烃
烯烃、炔烃
Olefins and alkynes
人教版高中化学选择性必修3
乙烯
PART 1
三天后
四天后
1、熟苹果可以大大缩短青橘子变熟的时间,你知道为什么吗
乙烯-催熟剂
情境导入
2、天猫超市买到的水果,在水果箱中放入一些用0.2%的KMnO4溶液浸泡过的纸,封严,能延长水果的保质期,你知道原因吗
乙烯的用途
乙烯产品占石化产品的75%以上,全球超过35%的有机化合物都要以乙烯为原料来生产。
乙烯的产量是衡量国家石油化工发展水平的标志
乙烯的结构书写注意事项:正:CH2=CH2H2C=CH2误:CH2CH2也称比例模型乙烯是最简单的烯烃。其分子中的碳原子均采取 杂化,碳原子与氢原子之间均以单键( 键)相连接,碳原子与碳原子之间以双键( )相连接,相邻两个键之间的键角约为 ,分子中的所有原子都处于 平面内。
乙烯的化学键和空间结构
乙烯的结构
sp2
σ
1个σ键和1个π键
120°
同一
乙烯的物理性质
常温下为无色、稍有气味的气体,
比空气轻,难溶于水。
乙烯的化学性质
氧化反应
加成反应
加聚反应
乙烯可燃烧,火焰明亮有黑烟
乙烯可使酸性高锰酸钾褪色,高锰酸钾将其氧化为CO2
氧化反应
12KMnO4 + 18H2SO4+ 5C2H4 → 12MnSO4+ 6K2SO4+ 10CO2↑+ 28H2O
CH2=CH2 + 3O2 → 2CO2 + 2H2O
点燃
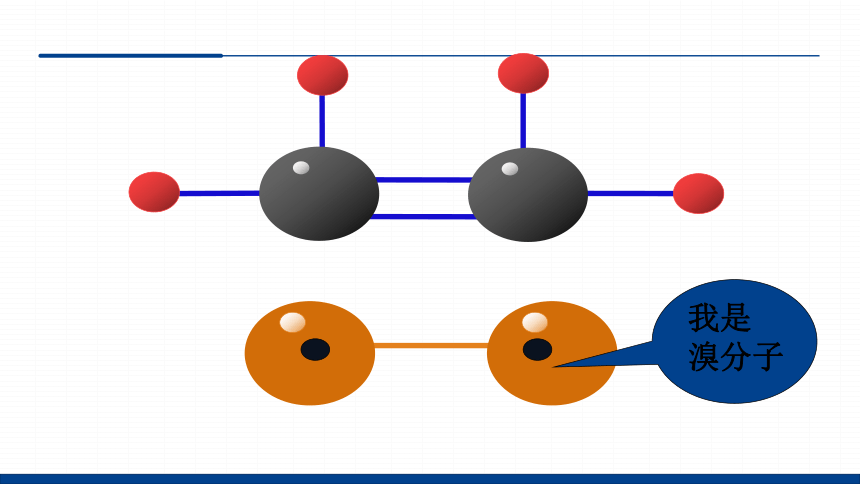
CH2 CH2 +Br2
有机物分子中双键或三键两端的碳原子与其他原子(或原子团)直接结合成新的化合物的反应叫加成反应
敲
黑
板
加成反应
CH2 CH2
Br Br
1,2-二溴乙烷
我是
溴分子
CH2Br-CH2Br
CH2 CH2 +Br2
CH2 CH2 +H2
CH2 CH2 +HCl
CH2 CH2 +H2O
催化剂
△
催化剂
△
催化剂
△
工业酒精的制备原理
CH3-CH3
CH3-CH2Cl
CH3-CH2OH
加成反应
加成反应
思考
根据已有的知识设计制备氯乙烷的实验方案。
方案1:乙烯和氯化氢的加成反应制备
方案2:利用乙烷和氯气发生取代反应制备
原子利用率达到100%(没有副产物)
除了生成一氯乙烷,还会有氯化氢、二氯乙烷、三氯乙烷……,副产物多,产率低,物质的分离提纯也难。
思考
现有两种无色气体乙烷和乙烯,如何鉴别?
分别将其通入KMnO4溶液中,能使其褪色的为乙烯
分别将其通入Br2的CCl4溶液中,能使其褪色的为乙烯
思考
现有乙烷和乙烯的混合气体,如何除去乙烯?
将混合气体通入溴水中洗气
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
+
+
+
+
加聚反应
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
+
+
+
+
加聚反应
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
加聚反应
CH2 CH2
[ ]n
乙烯能发生加成聚合反应生成高分子化合物聚乙烯
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
……
CH2 CH2
[ ]n
nCH2=CH2
一定条件
加聚反应
【例】1 mol乙烯与氯气发生加成反应,反应完全后再与氯气发生取代反应,整个过程中氯气最多消耗( )
A. 3 mol B. 4 mol
C. 5 mol D. 6 mol
C
烯烃的性质
PART 2
烯烃(除乙烯外)分子内碳原子一般存在两种杂化方式:
碳碳双键两端的碳原子以及与之直接相连的四个原子一定在 。
单烯烃的分子通式:
sp2和sp3
C2H4
C3H6
C4H8
C5H10
CnH2n
同一平面
名称 结构简式 沸点 相对密度
乙烯 CH2=CH2 -103.7 0.566
丙烯 CH2=CHCH3 - 47.4 0.5193
1-丁烯 CH2=CHCH2CH3 -6.3 0.5951
1-戊烯 CH2=CH(CH2)2CH3 30 0.6405
1-己烯 CH2=CH(CH2)3CH3 63.3 0.6731
1-庚烯 CH2=CH(CH2)4CH3 93.6 0.6970
【思考】结合单烯烃的结构简式及沸点、相对密度,分析烯烃的物理性质,它们有着怎样的递变性? 为什么?
物理性质
3. 碳原子数相同时,支链越多,沸点越低。
1. 随着分子中碳原子数的递增,沸点逐渐升高。
2. 随着分子中碳原子数的递增,相对密度逐渐增大。
注意:
2. 常温下烯烃的状态
1. 所有烃均难溶于水,密度均小于水
C17以上为固态
C5~C16液态
C1~C4气态
物理性质
【思考】写出乙烯、丙烯与下列物质反应的化学方程式,并说明反应中官能团和化学键的变化。《教材》P33思考与讨论(1)
试剂 乙 烯 丙 烯
①溴
②氯化氢
③水
加成反应
试剂 乙烯 丙烯
溴水
氯化氢
水
CH2=CH2+Br2→CH2BrCH2Br
CH3CH=CH2+Br2→CH3CHBrCH2Br
CH2=CH2+HCl → CH3CH2Cl
催化剂
CH2=CH2+H2O → CH3CH2OH
催化剂
CH3CH=CH2+HCl→CH3CH2CH2Cl
催化剂
CH3CH=CH2+HCl→CH3CHClCH3
催化剂
CH3CH=CH2+H2O→CH3CHOHCH3
催化剂
CH3CH=CH2+H2O→CH3CH2CH2OH
催化剂
CH3-CH=CH2 +HCl
CH3-CH=CH2 +H2O
催化剂
△
催化剂
△
CH3-CH-CH2
-
H
-
Cl
CH3-CH-CH2
-
Cl
-
H
CH3-CH-CH2
-
H
-
OH
CH3-CH-CH2
-
OH
-
H
加成反应
(主要)
(主要)
含氢越多越加氢
氧化反应
将烯烃通入酸性KMnO4中会使溶液颜色 ,
乙烯被氧化为 。
烯烃在空气或氧气中完全燃烧生成CO2和H2O,
燃烧通式为 。
变浅直至消失
现象:
CO2
火焰明亮,冒黑烟
氧化反应
已知某些烯烃被酸性高锰酸钾溶液氧化可生成羧酸和酮
CH3COOH + CH3COCH3
CH3CH=C(CH3)2
KMnO4/H+
【练习】已知某烯烃的化学式为C5H10,它与酸性高锰酸钾
溶液反应后得到的产物为乙酸和丙酸,你能推测出此烯烃
的结构吗?
若与酸性高锰酸钾溶液反应后得到的产物是二氧化碳和CH3CH2 C CH3 (丁酮),此烯烃的结构又是怎样的呢?
O
CH3CH=CHCH2CH3
CH3
CH2=C-CH2CH3
【思考】含有碳碳双键官能团的有机化合物在一定条件下能发生类似乙烯的加聚反应。例如,氯乙烯可以通过加聚反应生成聚氯乙烯:
请根据乙烯、氯乙烯发生的加聚反应,分别写出丙烯、异丁烯(2-甲基-1-丙烯)发生加聚反应的化学方程式。
一定条件
nCH2 = CH
Cl
CH2-CH
[ ]n
Cl
加聚反应
nCH3CH = CH2
一定条件
CH2-CH
[ ]n
CH3
加聚反应
一定条件
n
CH2-CH
[ ]n
一定条件
nCH3C = CH2
CH3
C-CH2
[ ]n
CH3
CH3
烯烃的顺反异构
PART 3
【活动】观察2-丁烯的两个模型,思考:两者是否为同种物质?
两个相同的原子或原子团排列在双键的同一侧的称为顺式结构。
两个相同的原子或原子团排列在双键的两侧的称为反式结构。
化学性质基本相同,但物理性质有一定差异。
顺反异构(构型异构)
【思考】为什么会产生顺反异构,下列几种结构哪些有顺反异构?
双键的化合物——由于双键不能自由旋转,当双键连有不同的原子或基团时,就会出现两种不同的空间排布方式,从而产生顺反异构体。
形成顺反异构的条件:
1.有碳碳双键
2.双键的每个碳原子必须连接两个不同的原子或原子团。
C=C
Cl
Cl
H
H
C=C
Cl
H
Cl
H
烯烃的命名
3-甲基-1-丁烯
【步骤】
(1)选主链:将含有双键的最长碳链作为主链,称为“某烯”;
(2)编位号:从距离双键最近的一端给主链上的碳原子依次编号定位;
(3)写名称:用阿拉伯数字标明双键的位置。用“二”“三”等表示双键的个数。
烯烃的命名
思考
化学式为C5H10的烯烃有多少种?
C – C – C – C – C
C – C – C – C
C
-
C – C – C
C
-
-
C
【步骤1】
写出碳链异构
【步骤2】
写出碳碳双键的位置异构
1
1
2
2
1
2
3
1
有5种属于烯烃的同分异构体
【步骤3 】
判断碳碳双键的顺反异构
烯烃的同分异构
思考
化学式为C4H8的有机化合物有多少种?
烯烃
C – C – C – C
C – C – C
C
-
1
2
1
1
1
环烷烃
1
二烯烃的分类及性质
PART 4
通式:
CnH2n 2
②共轭二烯烃
类别:
①累积二烯烃
③孤立二烯烃
C C = C = C C
(不稳定)
C = C C = C C
C = C C C = C
二烯烃的通式及类别
两个双键在碳链中的不同位置:
二烯烃的加成反应
Cl
Cl
+ Cl2
Cl
Cl
1,2-加成
1,4-加成
+ Cl2
二烯烃的加成反应
+
2
二烯烃的加聚反应
n CH2=C CH=CH2
CH3
[ CH2 C=CH CH2 ]n
CH3
催化剂
实验现象
①高锰酸钾溶液 ;
②溴的四氯化碳溶液 ;
③D处点燃后,火焰 且伴有 。
紫色褪去
橙红色褪去
明亮
黑烟
实验结论
石蜡油(烷烃)分解产物中有不同于烷烃(饱和烃)的物质产生,即不饱和烃(烯烃)。
C16H34 C8H18 + C8H16
催化剂
△
C8H18 C4H10 + C4H8
催化剂
△
C4H10 C2H6 + C2H4
催化剂
△
C4H10 CH4 + C3H6
催化剂
△
烷烃
饱和烃
不饱和烃
烷烃
烯烃
