2.2.2 炔烃 课件(共25张PPT) 人教版(2019)选择性必修三
文档属性
| 名称 | 2.2.2 炔烃 课件(共25张PPT) 人教版(2019)选择性必修三 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 09:53:23 | ||
图片预览







文档简介
(共25张PPT)
第二章
第二节 烯烃 炔烃
烃
第2课时 炔烃
硫粉
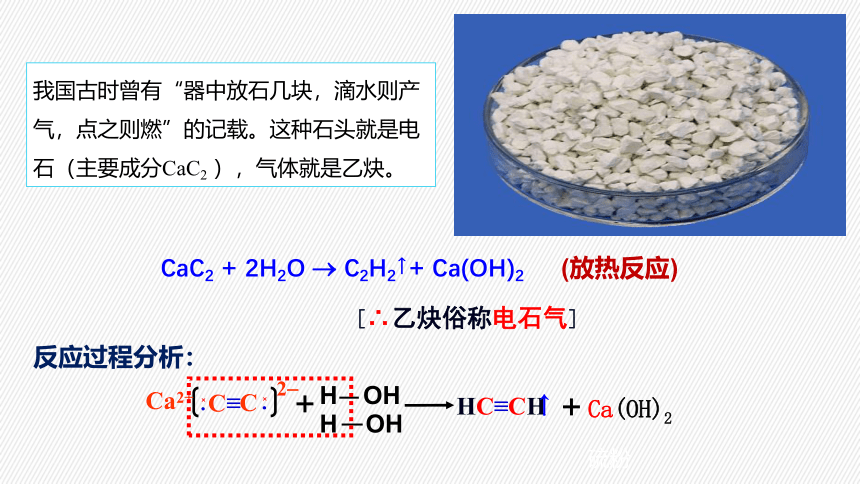
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。这种石头就是电石(主要成分CaC2 ),气体就是乙炔。
CaC2 + 2H2O C2H2↑+ Ca(OH)2
H OH
+
H OH
C≡
C
Ca2+
2
×●
×●
HC≡CH
↑
+
Ca(OH)2
反应过程分析:
[∴乙炔俗称电石气]
(放热反应)
01
炔烃的结构和性质
二、乙炔
2.空间结构:
1.物理性质
乙炔是最简单的炔烃,俗称电石气,是无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
乙炔的分子式为C2H2,结构简式为CH≡CH,分子为直线形结构,相邻两个键之间的夹角为180°。
球棍模型
空间充填模型
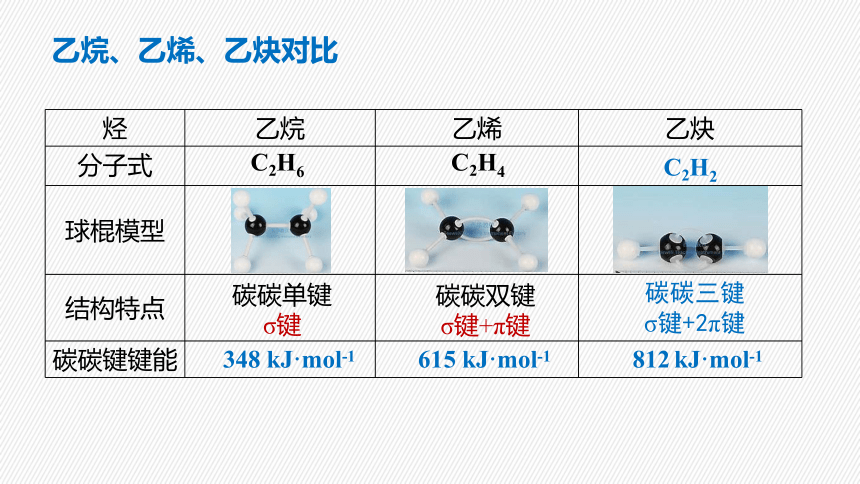
烃 乙烷 乙烯 乙炔
分子式
球棍模型
结构特点
碳碳键键能
C2H6 C2H4
碳碳单键
σ键
碳碳双键
σ键+π键
C2H2
碳碳三键
σ键+2π键
348 kJ·mol-1 615 kJ·mol-1 812 kJ·mol-1
乙烷、乙烯、乙炔对比
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔在空气中燃烧,火焰明亮,并伴有浓烈的黑烟。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔在纯氧中燃烧,火焰非常明亮,放出大量的热,可以用来切割或焊接金属(氧炔焰)。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔能被酸性高锰酸钾氧化(生成CO2),因此能使酸性高锰酸钾溶液褪色。
离子方程式:CH≡CH + 2MnO4- + 6H+ → 2Mn2+ + 2CO2 + 4H2O
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + Br2 → BrCH=CHBr(1,2-二溴乙烯)
BrCH=CHBr + Br2 → CHBr2CHBr2(1,1,2,2-四溴乙烷)
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + H2 → CH2=CH2
催化剂
△
CH≡CH + HCl → CH2=CH-Cl(氯乙烯)
催化剂
△
聚氯乙烯(PVC塑料)
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + H2O → CH3CHO
催化剂
△
注:乙炔与水加成,先生成乙烯醇(CH2=CH-OH),乙烯醇不稳定,很快转化为乙醛。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
③加聚反应
乙炔可以发生加聚反应,生成聚乙炔,聚乙炔可用于制备导电高分子材料。
(1)氧化反应
①燃烧:
②与酸性高锰酸钾溶液反应:
将炔烃通入酸性高锰酸钾溶液中,会使其褪色
(2)加成反应
炔烃的化学性质——与乙炔相似
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
X—C≡C—Y+Br2 CXBr=CYBr
(3)加聚反应
一定条件下
nX—C≡C—Y [ C=C ]n
X
Y
1.请写出戊炔所有属于炔烃的同分异构体的结构简式:
__________________________________________________________。
2.请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
深度思考
CH≡C—CH2—CH2—CH3、CH3C≡CCH2CH3、
3.某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的
结构简式为__________________________________。
深度思考
、
应用体验
1.下列关于炔烃的叙述正确的是
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃分子中只含有极性键
D.乙炔与分子式为C4H6的烃一定互为同系物
√
应用体验
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
√
分析由CH≡CH到CH2Br—CHBrCl的组成变化:增加了2个溴原子、
1个氢原子和1个氯原子,推得加成的物质分别是氯化氢和溴。先利用催化剂使CH≡CH与HCl反应生成CH2==CHCl,再与Br2反应生成CH2Br—CHBrCl。
返回
3. 乙炔的实验室制法:
反应装置:
固+液 气体
(课本P35-36)
实验注意事项:
2.导管口塞棉花:
饱和食盐水
①使用饱和食盐水代替水
②控制饱和食盐水的滴加速度
1.为了获得平稳的乙炔气流
防止产生的泡沫涌入导管
CaC2 + 2H2O C2H2↑+ Ca(OH)2
实验要点:
3. CuSO4溶液的作用:
1.用饱和食盐水代替水,缓解反应速率;同时用分液漏斗,以控制流速.
2.导管口塞棉花:防止产生的泡沫涌入导管
电石中含有少量杂质
杂质可与水作用
除去乙炔中混有的H2S、AsH3 、 PH3等气体
H2S+CuSO4=CuS↓+H2SO4
CuSO4会与AsH3 、 PH3发生氧化还原反应
除杂原理
4.禁用启普发生器:
①反应剧烈,难控制
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
②反应放热,易使启普发生器炸裂。
[CaS、砷化钙(Ca3As2)、磷化钙(Ca3P2)等]
H2S
AsH3
PH3
3. 乙炔的实验室制法:
(课本P35-36)
应用体验
某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
(1)A中制取乙炔的化学方程式为____________________________________。
(2)制乙炔时,打开分液漏斗的活塞,使水慢慢滴下的原因是________
_______________________________________________。
CaC2+2H2O―→CH≡CH↑+Ca(OH)2
控制反应
速率、使产生的气流平稳,避免产生的泡沫进入导管
应用体验
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用____(填字母,下同)装置,干燥乙炔最好选用____装置。
C
D
返回
链状烷烃、烯烃、炔烃的结构和化学性质的比较
三
链状烷烃 烯烃 炔烃
通式 ________(n≥1) (单烯烃,n≥2) (单炔烃,n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部为 ;饱和链烃 含 ;不饱和链烃 含 ;不饱和链烃
CnH2n+2
CnH2n
CnH2n-2
单键
碳碳双键
碳碳三键
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有_____ 燃烧火焰很明亮,伴有__________
酸性KMnO4溶液反应 使酸性KMnO4溶液褪色 加聚反应 - 能发生 鉴别 溴水和酸性KMnO4溶液__________ 溴水和酸性KMnO4溶液______ 不与
黑烟
浓烈的黑烟
能
均不褪色
均褪色
应用体验
1.下列有关丙烷、丙烯、丙炔的说法正确的是
A.丙烷、丙烯、丙炔的球棍模型分别表示为
B.相同物质的量的三种物质完全燃烧,在标准状况下生成的气体的体
积之比为1∶1∶1
C.丙烷、丙烯、丙炔均能使酸性KMnO4溶液褪色
D.丙炔中的碳原子均采取sp杂化
√
应用体验
2.在一定条件下,乙炔可转化为乙烯基乙炔(CH≡C—CH==CH2)。下列关于乙烯基乙炔分子的说法错误的是
A.能使酸性KMnO4溶液褪色
B.1 mol 乙烯基乙炔最多能与3 mol Br2发生加成反应
C.乙烯基乙炔分子中含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时耗氧量不相同
√
返回
第二章
第二节 烯烃 炔烃
烃
第2课时 炔烃
硫粉
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。这种石头就是电石(主要成分CaC2 ),气体就是乙炔。
CaC2 + 2H2O C2H2↑+ Ca(OH)2
H OH
+
H OH
C≡
C
Ca2+
2
×●
×●
HC≡CH
↑
+
Ca(OH)2
反应过程分析:
[∴乙炔俗称电石气]
(放热反应)
01
炔烃的结构和性质
二、乙炔
2.空间结构:
1.物理性质
乙炔是最简单的炔烃,俗称电石气,是无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
乙炔的分子式为C2H2,结构简式为CH≡CH,分子为直线形结构,相邻两个键之间的夹角为180°。
球棍模型
空间充填模型
烃 乙烷 乙烯 乙炔
分子式
球棍模型
结构特点
碳碳键键能
C2H6 C2H4
碳碳单键
σ键
碳碳双键
σ键+π键
C2H2
碳碳三键
σ键+2π键
348 kJ·mol-1 615 kJ·mol-1 812 kJ·mol-1
乙烷、乙烯、乙炔对比
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔在空气中燃烧,火焰明亮,并伴有浓烈的黑烟。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔在纯氧中燃烧,火焰非常明亮,放出大量的热,可以用来切割或焊接金属(氧炔焰)。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
①氧化反应
乙炔能被酸性高锰酸钾氧化(生成CO2),因此能使酸性高锰酸钾溶液褪色。
离子方程式:CH≡CH + 2MnO4- + 6H+ → 2Mn2+ + 2CO2 + 4H2O
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + Br2 → BrCH=CHBr(1,2-二溴乙烯)
BrCH=CHBr + Br2 → CHBr2CHBr2(1,1,2,2-四溴乙烷)
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + H2 → CH2=CH2
催化剂
△
CH≡CH + HCl → CH2=CH-Cl(氯乙烯)
催化剂
△
聚氯乙烯(PVC塑料)
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
②加成反应
乙炔分子中含有不饱和的碳碳三键,能与卤素单质的水溶液或四氯化碳溶液、氢气、卤化氢和水等物质发生加成反应。
CH≡CH + H2O → CH3CHO
催化剂
△
注:乙炔与水加成,先生成乙烯醇(CH2=CH-OH),乙烯醇不稳定,很快转化为乙醛。
01
炔烃的结构和性质
二、乙炔
3.乙炔的化学性质
③加聚反应
乙炔可以发生加聚反应,生成聚乙炔,聚乙炔可用于制备导电高分子材料。
(1)氧化反应
①燃烧:
②与酸性高锰酸钾溶液反应:
将炔烃通入酸性高锰酸钾溶液中,会使其褪色
(2)加成反应
炔烃的化学性质——与乙炔相似
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
X—C≡C—Y+Br2 CXBr=CYBr
(3)加聚反应
一定条件下
nX—C≡C—Y [ C=C ]n
X
Y
1.请写出戊炔所有属于炔烃的同分异构体的结构简式:
__________________________________________________________。
2.请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
深度思考
CH≡C—CH2—CH2—CH3、CH3C≡CCH2CH3、
3.某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的
结构简式为__________________________________。
深度思考
、
应用体验
1.下列关于炔烃的叙述正确的是
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃分子中只含有极性键
D.乙炔与分子式为C4H6的烃一定互为同系物
√
应用体验
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
√
分析由CH≡CH到CH2Br—CHBrCl的组成变化:增加了2个溴原子、
1个氢原子和1个氯原子,推得加成的物质分别是氯化氢和溴。先利用催化剂使CH≡CH与HCl反应生成CH2==CHCl,再与Br2反应生成CH2Br—CHBrCl。
返回
3. 乙炔的实验室制法:
反应装置:
固+液 气体
(课本P35-36)
实验注意事项:
2.导管口塞棉花:
饱和食盐水
①使用饱和食盐水代替水
②控制饱和食盐水的滴加速度
1.为了获得平稳的乙炔气流
防止产生的泡沫涌入导管
CaC2 + 2H2O C2H2↑+ Ca(OH)2
实验要点:
3. CuSO4溶液的作用:
1.用饱和食盐水代替水,缓解反应速率;同时用分液漏斗,以控制流速.
2.导管口塞棉花:防止产生的泡沫涌入导管
电石中含有少量杂质
杂质可与水作用
除去乙炔中混有的H2S、AsH3 、 PH3等气体
H2S+CuSO4=CuS↓+H2SO4
CuSO4会与AsH3 、 PH3发生氧化还原反应
除杂原理
4.禁用启普发生器:
①反应剧烈,难控制
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
②反应放热,易使启普发生器炸裂。
[CaS、砷化钙(Ca3As2)、磷化钙(Ca3P2)等]
H2S
AsH3
PH3
3. 乙炔的实验室制法:
(课本P35-36)
应用体验
某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
(1)A中制取乙炔的化学方程式为____________________________________。
(2)制乙炔时,打开分液漏斗的活塞,使水慢慢滴下的原因是________
_______________________________________________。
CaC2+2H2O―→CH≡CH↑+Ca(OH)2
控制反应
速率、使产生的气流平稳,避免产生的泡沫进入导管
应用体验
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用____(填字母,下同)装置,干燥乙炔最好选用____装置。
C
D
返回
链状烷烃、烯烃、炔烃的结构和化学性质的比较
三
链状烷烃 烯烃 炔烃
通式 ________(n≥1) (单烯烃,n≥2) (单炔烃,n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部为 ;饱和链烃 含 ;不饱和链烃 含 ;不饱和链烃
CnH2n+2
CnH2n
CnH2n-2
单键
碳碳双键
碳碳三键
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有_____ 燃烧火焰很明亮,伴有__________
酸性KMnO4溶液反应 使酸性KMnO4溶液褪色 加聚反应 - 能发生 鉴别 溴水和酸性KMnO4溶液__________ 溴水和酸性KMnO4溶液______ 不与
黑烟
浓烈的黑烟
能
均不褪色
均褪色
应用体验
1.下列有关丙烷、丙烯、丙炔的说法正确的是
A.丙烷、丙烯、丙炔的球棍模型分别表示为
B.相同物质的量的三种物质完全燃烧,在标准状况下生成的气体的体
积之比为1∶1∶1
C.丙烷、丙烯、丙炔均能使酸性KMnO4溶液褪色
D.丙炔中的碳原子均采取sp杂化
√
应用体验
2.在一定条件下,乙炔可转化为乙烯基乙炔(CH≡C—CH==CH2)。下列关于乙烯基乙炔分子的说法错误的是
A.能使酸性KMnO4溶液褪色
B.1 mol 乙烯基乙炔最多能与3 mol Br2发生加成反应
C.乙烯基乙炔分子中含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时耗氧量不相同
√
返回
