人教版(2019)选择性必修三 2.1.1 烷烃的结构和性质(共61张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修三 2.1.1 烷烃的结构和性质(共61张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-18 00:00:00 | ||
图片预览







文档简介
(共61张PPT)
一寸光阴一寸金,寸金难买寸光阴。
脂肪
烃
烷烃
烯烃
炔烃
>C=C<
C—C
—C≡C—
脂肪
脂肪烃(aliphatic hydrocarbons),是指具有脂肪族化合物基本属性的碳氢化合物。因为这类有机物最早从脂肪中提取,所以也叫做脂肪烃。而脂肪烃及其衍生物(包括卤代烃)等称为脂肪族化合物。脂肪族化合物中,碳原子以直链、支链或环状排列,分别称为直链脂肪烃,支链脂肪烃及脂环烃。
提取
宁波舟山港,册子岛原油码头,45万吨级油轮
烷烃
烷烃的结构与性质
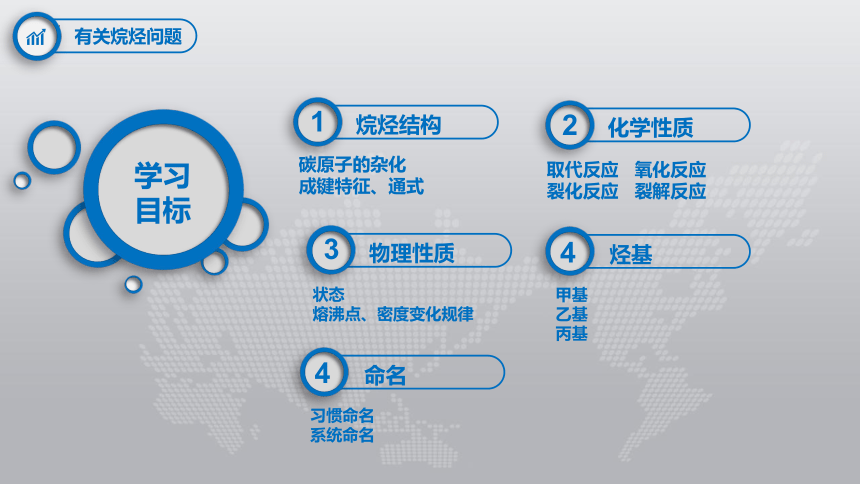
有关烷烃问题
学习
目标
烷烃结构
碳原子的杂化
成键特征、通式
1
化学性质
取代反应 氧化反应
裂化反应 裂解反应
2
物理性质
甲基
乙基
丙基
3
烃基
状态
熔沸点、密度变化规律
4
习惯命名
系统命名
命名
4
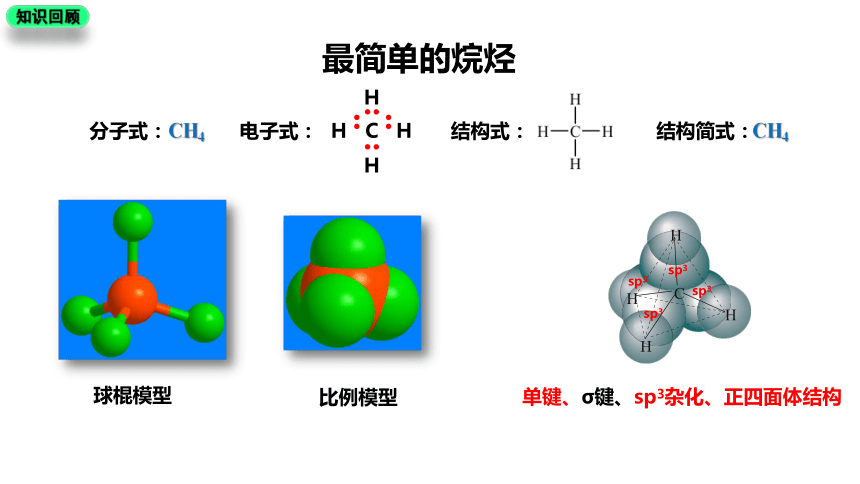
知识回顾
最简单的烷烃
CH4
电子式:
CH4
C
H
H
H
H
分子式:
结构式:
结构简式:
球棍模型
比例模型
H
H
H
C
H
sp3
sp3
sp3
sp3
单键、σ键、sp3杂化、正四面体结构
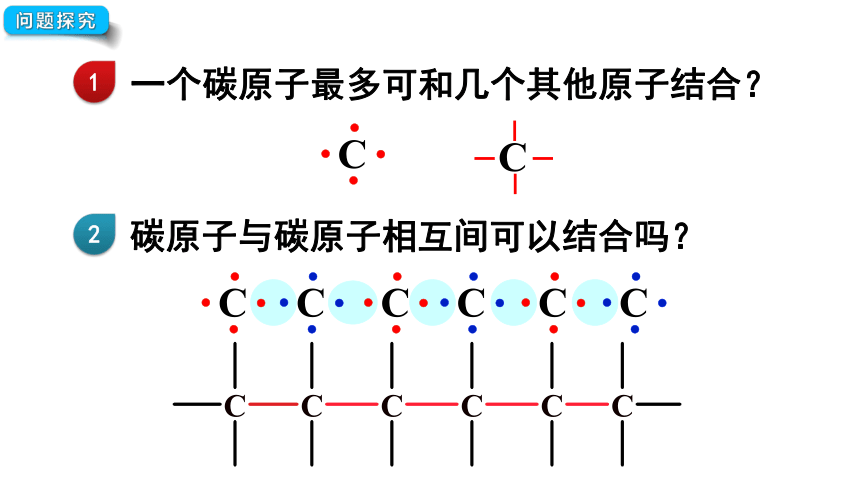
烷烃长啥样子?
一个碳原子最多可和几个其他原子结合?
问题探究
1
2
碳原子与碳原子相互间可以结合吗?
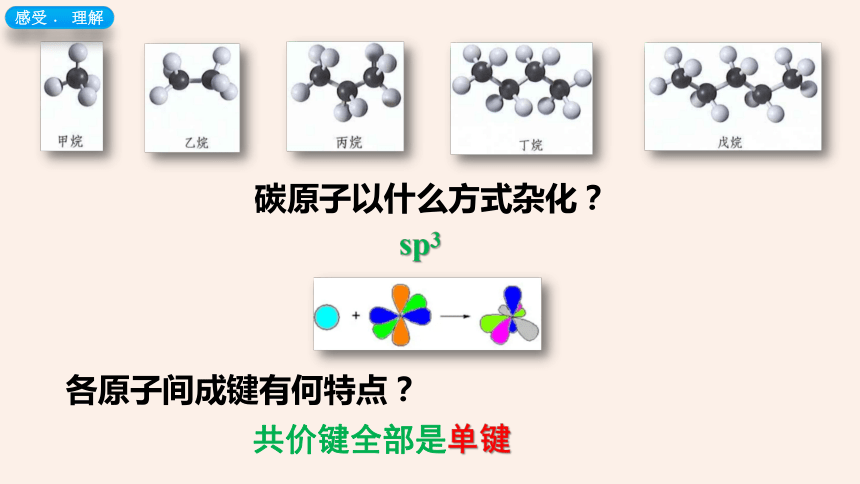
感受﹒ 理解
碳原子以什么方式杂化?
sp3
各原子间成键有何特点?
共价键全部是单键
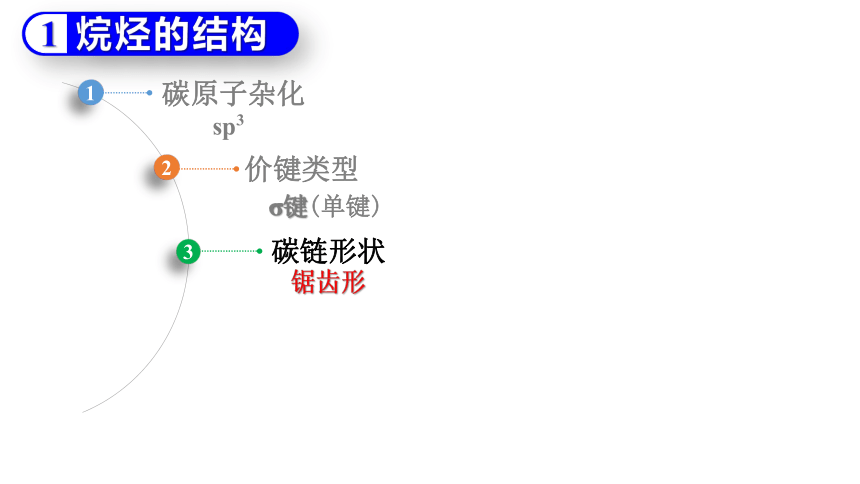
烷烃的结构
1
1
2
sp3
碳原子杂化
σ键(单键)
价键类型
乙烷
丙烷
正丁烷
思考﹒ 运用
三分子中,碳原子之间是直线连接的吗?
烷烃的结构
1
1
2
3
sp3
碳原子杂化
σ键(单键)
价键类型
锯齿形
碳链形状
名称 结构简式 分子式
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
CH2
观察与思考
结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
同系物判断的三个关键点
同
两种物质属于同一类物质,官能团的种类和数目一样。
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
似
差
感受﹒ 理解
烷烃的结构
1
孙先辉
孙先辉
1
2
3
4
5
sp3
碳原子杂化
σ键(单键)
价键类型
锯齿形
碳链形状
互为同系物
碳原子数不同的烷烃
CnH2n+2(n≥1)
通式
烷烃的内在美
甲烷的化学性质
知识回顾
01
02
03
难氧化
能燃烧、不能被酸性高锰酸钾溶液氧化。
易取代
在光照条件下与氯气发生取代反应。
难分解
高温条件下能分解生成炭黑和氢气。
根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
不反应
易燃
不反应
不反应
取代反应
思考﹒ 运用
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型
预测
断键部位
反应类型
C—C C—H
键能/(kJ·mol-1) 347.7 413.4
H C F
电负性 2.1 2.5 4.0
电负性相差越小,形成的共价键的极性越小,化学反应中越难断裂。
常温下,烷烃的化学性质较稳定。
键能越大,化学键越牢固,化学反应中越难断裂。
化学性质
2
1
常温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
用作溶剂、润滑油
打火机使用的气体主要是可燃性气体
今多用丁烷、丙烷类和石油液化气
气体经加压后充入贮气箱,一旦释放到空气中便吸热气化而迅速膨胀,极易点燃
早期多用汽油
丁烷完全燃烧化学方程式:
丁烷催化氧化制乙酸的化学方程式:
孙先辉 PPT
生活中的化学
化学性质
2
孙先辉
1
2
常温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
天然气、沼气
(甲烷)
液化石油气
(C4以下)
煤油
(C11~C16)
汽油
(C5~C11)
常用的
烷烃燃料
柴油
(C15~C18)
丁烷
“蜡烛冒烟”事件
呛走了宾客,皇帝路易斯·菲利普责成调查此事。
1883年法国巴黎王室一次舞会上
新买的巨大的蜡烛燃烧时,冒出一股刺鼻的气体
巴黎大学化学教授迪马查明了原因,并发现了一个新的反应类型。
化学趣史
化学性质
2
1
2
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3
取代反应——特征反应
X2是气体 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
思考﹒ 运用
乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
烷烃
卤代烃
+
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
替代法
乙烷与氯气在光照下反应,可能生成的些产物
问题解决
一取代
二取代
三取代
四取代
五取代
六取代
烷烃与卤素的取代反应是连续反应,产物较为复杂,不适合制备物质。
一氯乙烷的制备探究
方法一更好:原子利用率高,产物纯净。
方法一:CH2=CH2+HCl → CH3CH2Cl
方法二:CH3CH3+Cl2 → CH3CH2Cl+HCl
考考你的智慧
知识回顾
工业上是如何制取乙烯的?
全国最大乙烯裂解炉
石油蒸馏得到的汽油不能满足需要,工业上是如何解决这一问题的?
催化裂化
化学性质
2
孙先辉
1
2
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3
取代反应——特征反应
X2是气体 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
4
分解反应
裂化反应
得到液态烃
裂解反应
裂化汽油
裂解气
C20H42 C10H22+C10H20
C16H34 C8H16+C8H18
01难氧化
具有可燃性
02易取代
光照下与卤素单质发生取代反应
03难分解
一定条件下发生裂化和裂解
化学性质
归纳整理
烷烃的外在美
问题探究
预测烷烃的熔点和沸点等物理性质变化基本规律,说说你预测的原理。
相对分子质量增大
碳原子数增多
分子间作用力增大
熔点、沸点升高
孙先辉
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
资料在线
气
液
固
逐
渐
升
高
逐
渐
增
大
身边的化学
甲烷
丙烷和丁烷
丁烷
C17~C21的烷烃
C18~C30的烷烃
C5~C11的烷烃
物理性质
3
孙先辉
1
状态
①气体:C1~C4
②液体: C5~C16
③固体: C17
2
熔沸点
随着碳原子数的增加,烷烃熔沸点逐渐升高
3
密度
随着碳原子数的增加,烷烃的密度逐渐升高,但小于水的密度
物质 甲烷 乙烷 丁烷 戊烷
沸点 -162 ℃ -89 ℃ -1 ℃ 36 ℃
根据以下数据推断丙烷的沸点可能是
A .约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
解析:烷烃的熔点、沸点随分子中碳原子数的增加逐渐升高,故丙烷的沸点介于乙烷和丁烷之间。
你学会了吗?
烃基
H
C
H
H
H
CH3
甲基
烃分子去掉一个氢原子
或去掉二个、三个氢原子
—CH2—
烃基
烃基
4
概念
烃分子中去掉一个原子后剩余的基团
1
请你试一试
CH4
CH3CH3
CH3CH2CH3
甲基
乙基
丙基
丙烷(CH3CH2CH3)分子中有两种处于不同化学环境的氢原子
丙基
请你试一试
-H
正丙基
-H
异丙基
烃基
4
概念
烃分子中去掉一个原子后剩余的基团
1
2
常见烃基
根据丁烷两种同分异构体的结构,写出4种丁基(-C4H9)的结构简式。
考考你自己
基和根的区别
你注意到了吗?
根
不带电荷
基
不稳定
不能独立存在
带电荷
稳定
能独立存在
-OH
OH-
命名
4
请说出表格中烷烃的名称。
分子式 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C11H24 C13H28
名称
甲烷
丙烷
丁烷
戊烷
己烷
十一烷
十三烷
乙烷
回顾练习
4.1 习惯命名法
烷烃命名
4
碳原子数≤10
用甲、乙、丙、丁、戊、己、庚、辛、壬、癸对应碳原子数,其后加“烷”字
1
2
碳原子数>10
用汉字数字对应碳原子数,其后加“烷”字
孙先辉
丁烷(C4H10)
正丁烷
沸点-0.5 ℃
异丁烷
沸点-11.6 ℃
孙先辉
戊烷(C4H10)
正戊烷
沸点36.1 ℃
异戊烷
沸点27.9 ℃
新戊烷
沸点9.5 ℃
烷烃习惯命名法
碳原子数≤10
用甲、乙、丙、丁、戊、己、庚、辛、壬、癸对应碳原子数,其后加“烷”字
1
2
碳原子数>10
用汉字数字对应碳原子数,其后加“烷”字
3
若烷烃有多种同分异构体
以“正、异、新”区分
己烷(C6H14)的同分异构体有几种?如何命名呢?
①
②
2个
正己烷
异己烷
新己烷
习惯命名法已经无法满足,我们要学习系统命名法。
交流讨论
①
②
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
孙先辉
课堂小结
烷
烃
通式
CnH2n+2(n≥1)
①含氢量最高:CH4
②共价键总数:3n+1
结构特点
碳原子sp3杂化 均为单键 碳链锯齿状
化学性质
取代反应 氧化反应 裂解和裂化
物理性质
难溶于水 熔沸点及密度递变性
命名原则
选主链 定编号 写名称
方法一:CH2=CH2+HCl CH3CH2Cl
方法二:CH3CH3+Cl2 CH3CH2Cl+HCl
(3)若要制备一氯乙烷用哪种方法好?
HCl
方法一更好,
原子利用率高,产物纯净。
考考你自己
乙烷能和Cl2发生反应。
(1) 1 mol 乙烷最多能和多少 mol Cl2发生取代反应?
(2 )生成的产物中最多的是什么?
催化剂
光照
6
下列物质中,在常温和光照的条件下可以与乙烷发生化学反应的是
A.稀硫酸 B . NaOH溶液
C.Cl2 D .酸性KMnO4 溶液
考考你自己
下列有关烷烃的叙述中,正确的是________________
①在所有烷烃分子中,都有碳碳单键。
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去。
③分子通式为CnH2n+2的烃不一定是烷烃。
④所有的烷烃在光照条件下都能与氯气发生取代反应。
⑤光照条件下,乙烷通入溴水中,可使溴水褪色。
⑥相同质量的烷烃完全燃烧,耗氧量最大的是CH4。
⑦C3H8的烃与氯气发生一氯取代,所得的化合物有2种。
⑧任意两个烷烃分子一定互为同系物。
④ ⑥ ⑦ ⑧
看谁做得既准又快
以下有机物的结构简式,有无错误,是何错误?
联想与质疑
以下有机物的结构简式,代表几种物质?
考考你的智慧
一寸光阴一寸金,寸金难买寸光阴。
脂肪
烃
烷烃
烯烃
炔烃
>C=C<
C—C
—C≡C—
脂肪
脂肪烃(aliphatic hydrocarbons),是指具有脂肪族化合物基本属性的碳氢化合物。因为这类有机物最早从脂肪中提取,所以也叫做脂肪烃。而脂肪烃及其衍生物(包括卤代烃)等称为脂肪族化合物。脂肪族化合物中,碳原子以直链、支链或环状排列,分别称为直链脂肪烃,支链脂肪烃及脂环烃。
提取
宁波舟山港,册子岛原油码头,45万吨级油轮
烷烃
烷烃的结构与性质
有关烷烃问题
学习
目标
烷烃结构
碳原子的杂化
成键特征、通式
1
化学性质
取代反应 氧化反应
裂化反应 裂解反应
2
物理性质
甲基
乙基
丙基
3
烃基
状态
熔沸点、密度变化规律
4
习惯命名
系统命名
命名
4
知识回顾
最简单的烷烃
CH4
电子式:
CH4
C
H
H
H
H
分子式:
结构式:
结构简式:
球棍模型
比例模型
H
H
H
C
H
sp3
sp3
sp3
sp3
单键、σ键、sp3杂化、正四面体结构
烷烃长啥样子?
一个碳原子最多可和几个其他原子结合?
问题探究
1
2
碳原子与碳原子相互间可以结合吗?
感受﹒ 理解
碳原子以什么方式杂化?
sp3
各原子间成键有何特点?
共价键全部是单键
烷烃的结构
1
1
2
sp3
碳原子杂化
σ键(单键)
价键类型
乙烷
丙烷
正丁烷
思考﹒ 运用
三分子中,碳原子之间是直线连接的吗?
烷烃的结构
1
1
2
3
sp3
碳原子杂化
σ键(单键)
价键类型
锯齿形
碳链形状
名称 结构简式 分子式
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
CH2
观察与思考
结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
同系物判断的三个关键点
同
两种物质属于同一类物质,官能团的种类和数目一样。
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
似
差
感受﹒ 理解
烷烃的结构
1
孙先辉
孙先辉
1
2
3
4
5
sp3
碳原子杂化
σ键(单键)
价键类型
锯齿形
碳链形状
互为同系物
碳原子数不同的烷烃
CnH2n+2(n≥1)
通式
烷烃的内在美
甲烷的化学性质
知识回顾
01
02
03
难氧化
能燃烧、不能被酸性高锰酸钾溶液氧化。
易取代
在光照条件下与氯气发生取代反应。
难分解
高温条件下能分解生成炭黑和氢气。
根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
不反应
易燃
不反应
不反应
取代反应
思考﹒ 运用
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型
预测
断键部位
反应类型
C—C C—H
键能/(kJ·mol-1) 347.7 413.4
H C F
电负性 2.1 2.5 4.0
电负性相差越小,形成的共价键的极性越小,化学反应中越难断裂。
常温下,烷烃的化学性质较稳定。
键能越大,化学键越牢固,化学反应中越难断裂。
化学性质
2
1
常温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
用作溶剂、润滑油
打火机使用的气体主要是可燃性气体
今多用丁烷、丙烷类和石油液化气
气体经加压后充入贮气箱,一旦释放到空气中便吸热气化而迅速膨胀,极易点燃
早期多用汽油
丁烷完全燃烧化学方程式:
丁烷催化氧化制乙酸的化学方程式:
孙先辉 PPT
生活中的化学
化学性质
2
孙先辉
1
2
常温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
天然气、沼气
(甲烷)
液化石油气
(C4以下)
煤油
(C11~C16)
汽油
(C5~C11)
常用的
烷烃燃料
柴油
(C15~C18)
丁烷
“蜡烛冒烟”事件
呛走了宾客,皇帝路易斯·菲利普责成调查此事。
1883年法国巴黎王室一次舞会上
新买的巨大的蜡烛燃烧时,冒出一股刺鼻的气体
巴黎大学化学教授迪马查明了原因,并发现了一个新的反应类型。
化学趣史
化学性质
2
1
2
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3
取代反应——特征反应
X2是气体 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
思考﹒ 运用
乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
烷烃
卤代烃
+
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
替代法
乙烷与氯气在光照下反应,可能生成的些产物
问题解决
一取代
二取代
三取代
四取代
五取代
六取代
烷烃与卤素的取代反应是连续反应,产物较为复杂,不适合制备物质。
一氯乙烷的制备探究
方法一更好:原子利用率高,产物纯净。
方法一:CH2=CH2+HCl → CH3CH2Cl
方法二:CH3CH3+Cl2 → CH3CH2Cl+HCl
考考你的智慧
知识回顾
工业上是如何制取乙烯的?
全国最大乙烯裂解炉
石油蒸馏得到的汽油不能满足需要,工业上是如何解决这一问题的?
催化裂化
化学性质
2
孙先辉
1
2
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
稳定性
氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3
取代反应——特征反应
X2是气体 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
4
分解反应
裂化反应
得到液态烃
裂解反应
裂化汽油
裂解气
C20H42 C10H22+C10H20
C16H34 C8H16+C8H18
01难氧化
具有可燃性
02易取代
光照下与卤素单质发生取代反应
03难分解
一定条件下发生裂化和裂解
化学性质
归纳整理
烷烃的外在美
问题探究
预测烷烃的熔点和沸点等物理性质变化基本规律,说说你预测的原理。
相对分子质量增大
碳原子数增多
分子间作用力增大
熔点、沸点升高
孙先辉
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
资料在线
气
液
固
逐
渐
升
高
逐
渐
增
大
身边的化学
甲烷
丙烷和丁烷
丁烷
C17~C21的烷烃
C18~C30的烷烃
C5~C11的烷烃
物理性质
3
孙先辉
1
状态
①气体:C1~C4
②液体: C5~C16
③固体: C17
2
熔沸点
随着碳原子数的增加,烷烃熔沸点逐渐升高
3
密度
随着碳原子数的增加,烷烃的密度逐渐升高,但小于水的密度
物质 甲烷 乙烷 丁烷 戊烷
沸点 -162 ℃ -89 ℃ -1 ℃ 36 ℃
根据以下数据推断丙烷的沸点可能是
A .约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
解析:烷烃的熔点、沸点随分子中碳原子数的增加逐渐升高,故丙烷的沸点介于乙烷和丁烷之间。
你学会了吗?
烃基
H
C
H
H
H
CH3
甲基
烃分子去掉一个氢原子
或去掉二个、三个氢原子
—CH2—
烃基
烃基
4
概念
烃分子中去掉一个原子后剩余的基团
1
请你试一试
CH4
CH3CH3
CH3CH2CH3
甲基
乙基
丙基
丙烷(CH3CH2CH3)分子中有两种处于不同化学环境的氢原子
丙基
请你试一试
-H
正丙基
-H
异丙基
烃基
4
概念
烃分子中去掉一个原子后剩余的基团
1
2
常见烃基
根据丁烷两种同分异构体的结构,写出4种丁基(-C4H9)的结构简式。
考考你自己
基和根的区别
你注意到了吗?
根
不带电荷
基
不稳定
不能独立存在
带电荷
稳定
能独立存在
-OH
OH-
命名
4
请说出表格中烷烃的名称。
分子式 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C11H24 C13H28
名称
甲烷
丙烷
丁烷
戊烷
己烷
十一烷
十三烷
乙烷
回顾练习
4.1 习惯命名法
烷烃命名
4
碳原子数≤10
用甲、乙、丙、丁、戊、己、庚、辛、壬、癸对应碳原子数,其后加“烷”字
1
2
碳原子数>10
用汉字数字对应碳原子数,其后加“烷”字
孙先辉
丁烷(C4H10)
正丁烷
沸点-0.5 ℃
异丁烷
沸点-11.6 ℃
孙先辉
戊烷(C4H10)
正戊烷
沸点36.1 ℃
异戊烷
沸点27.9 ℃
新戊烷
沸点9.5 ℃
烷烃习惯命名法
碳原子数≤10
用甲、乙、丙、丁、戊、己、庚、辛、壬、癸对应碳原子数,其后加“烷”字
1
2
碳原子数>10
用汉字数字对应碳原子数,其后加“烷”字
3
若烷烃有多种同分异构体
以“正、异、新”区分
己烷(C6H14)的同分异构体有几种?如何命名呢?
①
②
2个
正己烷
异己烷
新己烷
习惯命名法已经无法满足,我们要学习系统命名法。
交流讨论
①
②
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
孙先辉
课堂小结
烷
烃
通式
CnH2n+2(n≥1)
①含氢量最高:CH4
②共价键总数:3n+1
结构特点
碳原子sp3杂化 均为单键 碳链锯齿状
化学性质
取代反应 氧化反应 裂解和裂化
物理性质
难溶于水 熔沸点及密度递变性
命名原则
选主链 定编号 写名称
方法一:CH2=CH2+HCl CH3CH2Cl
方法二:CH3CH3+Cl2 CH3CH2Cl+HCl
(3)若要制备一氯乙烷用哪种方法好?
HCl
方法一更好,
原子利用率高,产物纯净。
考考你自己
乙烷能和Cl2发生反应。
(1) 1 mol 乙烷最多能和多少 mol Cl2发生取代反应?
(2 )生成的产物中最多的是什么?
催化剂
光照
6
下列物质中,在常温和光照的条件下可以与乙烷发生化学反应的是
A.稀硫酸 B . NaOH溶液
C.Cl2 D .酸性KMnO4 溶液
考考你自己
下列有关烷烃的叙述中,正确的是________________
①在所有烷烃分子中,都有碳碳单键。
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去。
③分子通式为CnH2n+2的烃不一定是烷烃。
④所有的烷烃在光照条件下都能与氯气发生取代反应。
⑤光照条件下,乙烷通入溴水中,可使溴水褪色。
⑥相同质量的烷烃完全燃烧,耗氧量最大的是CH4。
⑦C3H8的烃与氯气发生一氯取代,所得的化合物有2种。
⑧任意两个烷烃分子一定互为同系物。
④ ⑥ ⑦ ⑧
看谁做得既准又快
以下有机物的结构简式,有无错误,是何错误?
联想与质疑
以下有机物的结构简式,代表几种物质?
考考你的智慧
