2.3.1 苯的结构与性质 课件(共31张PPT)人教版(2019)选择性必修三
文档属性
| 名称 | 2.3.1 苯的结构与性质 课件(共31张PPT)人教版(2019)选择性必修三 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
第二章 烃
第3节 芳香烃
第1课时 苯的结构与性质
1.通过实验探究活动,预测、验证并分析苯及其同系物的化学性质。
2.通过对比、类比等方法,说出苯和苯的同系物的性质异同,举例说明有机化合物中官能团之间的相互影响。
苯的发现:
远在2300多年前,诗人屈原在《楚辞》中就写下了“蕙肴蒸兮兰藉”的诗文,可见芳香油的利用具有悠久的历史,之后科学家的研究中发现,有芳香气味的物质中的很多化合物有一个共同的特点:含有一个相同的结构单元——苯环。
芳香烃:在烃类化合物中,含有一个或多个苯环的化合物。
最简单的芳香烃为苯。
COOH
Cl
芳香族化合物:
芳香烃:
苯的同系物:
是分子中含有苯环的化合物(一个或多个苯环)。
分子中含有一个苯环,苯环上的侧链全部为烷烃基。
[区别] 芳香化合物、芳香烃、苯的同系物三个概念
芳香化合物:含苯环的化合物(可含除C、H外的元素)。
芳香烃:含有苯环的烃(只含C、H元素) 。
苯的同系物:有1个苯环,侧链全为烷烃基的芳香烃。
芳香烃
同系物
苯的
芳香化合物
苯
最简单的芳香烃是:苯
实验探究苯的分子结构
向两支各盛有2 mL苯的试管中分别加入酸性高锰酸钾溶液和溴水,用力振荡,观察现象。
试剂 实验现象 实验结论
酸性高锰 酸钾溶液
溴水 溴在苯中的溶解度比在水中的大,因此苯能将溴从水中萃取出来。
苯不能被酸性高锰酸钾溶液氧化,也不与溴水反应,苯分子具有不同于烯烃和炔烃的特殊结构
共价键 碳碳 单键 碳碳 双键 苯环中的
碳碳键
键长/pm 154.1 133.7 139
X射线衍射法证实了苯分子结构是平面正六边形
每个碳碳键的键长相等,都是139 pm,
介于碳碳单键与碳碳双键的键长之间。
苯分子中的碳碳键是一种介于单键和双键之间的独特的键
结论:
(六个C-C键完全相同)
1
2
4
3
苯分子中的6个碳碳键的键长相等
苯不能使溴的四氯化碳溶液褪色
如何证明苯分子中只有一种介于碳碳单键和碳碳双键之间的特殊的键?
和
是同一种物质
苯不能使酸性高锰酸钾溶液褪色
球棍模型
空间填充模型
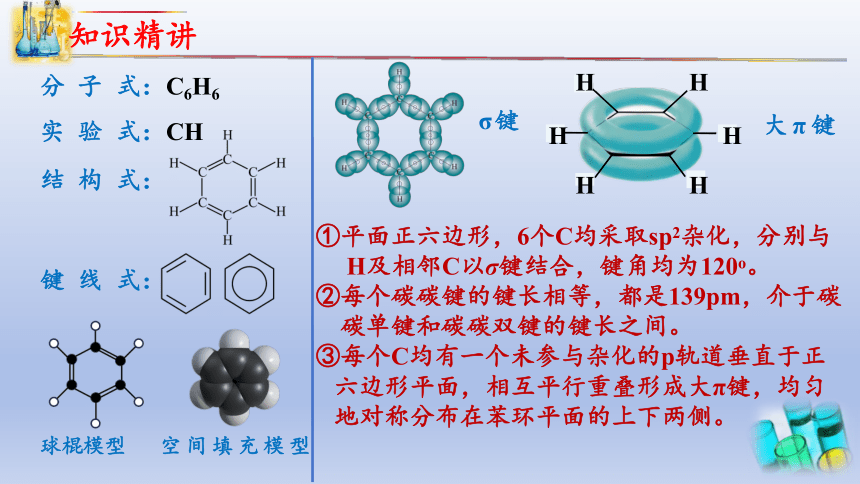
分 子 式:C6H6
实 验 式:CH
结 构 式:
键 线 式:
H
H
H
H
H
H
大π键
σ键
①平面正六边形,6个C均采取sp2杂化,分别与
H及相邻C以σ键结合,键角均为120o。
②每个碳碳键的键长相等,都是139pm,介于碳
碳单键和碳碳双键的键长之间。
③每个C均有一个未参与杂化的p轨道垂直于正
六边形平面,相互平行重叠形成大π键,均匀
地对称分布在苯环平面的上下两侧。
颜 色:
气 味:
状 态:
密 度:
溶解性:
挥发性:
熔沸点:
无色透明
特殊芳香气味
液体
比水 。
不溶于水, 易溶于有机溶剂
易挥发
熔点5.5℃,沸点80.1 ℃
苯的物理性质
有 毒
用冰冷却时结成无色的晶体。
(密封保存)
小
苯有毒!苯是一种重要的化工原料和有机溶剂.
P41
(0.88g/cm3)
苯分子中的碳碳键介于单键和双键之间的独特的键,苯既有烷烃的性质,能发生取代反应,也有烯烃的性质,但由于大π键比较稳定,在一定情况下能发生加成反应。苯有可燃性,但不能被酸性KMnO4溶液以及溴水氧化。
易取代,能加成,难氧化。
根据苯的结构,预测苯可能发生的化学反应类型。
苯的化学性质
苯的化学性质
氧化反应
加成反应
取代反应
①可燃性
纯卤素
√
②使酸性KMnO4溶液褪色
×
硝酸
硫酸
H2、X2、HX、H2O
√
阅读教材,苯能发生的化学反应类型。
除去溶解在溴苯中的液溴,以提纯溴苯
吸收检验HBr
吸收HBr,防止污染环境
防止倒吸
冷凝回流、导气
反应现象:
液体轻微沸腾;
反应结束后,三颈烧瓶底部出现棕褐色油状液体;
锥形瓶内有白雾,向锥形瓶中加入AgNO3溶液,出现浅黄色沉淀不溶于硝酸;
向三颈烧瓶中加入NaOH溶液,溶液分层,并产生红褐色沉淀。
取代反应——溴化反应
取代反应——溴化反应
+ Br2 + HBr ↑
FeBr3
Br
无色液体,不溶于水,密度比水大
溴苯
反应实质
苯环里的氢原子被溴分子里的溴原子(-Br)所取代的反应
纯液溴
或Fe粉
2Fe+3Br2===2FeBr3
苯
液溴
混合
长导管口处
锥形瓶内
①滴入AgNO3溶液
烧瓶内液体
倒入烧杯内水中
Fe屑
互溶、
不反应
深红棕色
剧烈
反应
(放热反应)
大量白雾
淡黄色沉淀
烧杯底部有褐色油状物、不溶于水
实验小结:
取溶液:
②加入镁粉
产生大量气体
加入NaOH搅拌
得到无色油状物
上层清液中加入KSCN(aq)溶液变血红色
(HBr与水蒸气的小液滴)
说明瓶内有H+ 和Br-
说明Fe被Br2氧化成了Fe3+
生成了有机物溴苯
从这些现象中分别可以得出什么结论呢?
取代反应——溴化反应
苯和液溴 —— 取代 —— 化学反应
苯和溴水 —— 萃取 —— 物理变化
纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
反应中制取的是粗产品,剩余的Br2溶解在生成的溴苯中。
水洗→碱洗→水洗→干燥→蒸馏(得到纯净的溴苯)
除去溴苯
中的溴
除去溴蒸气,
净化HBr气体
检验HBr酸性
检验HBr
除去HBr尾气
防倒吸
①有分液漏斗,控制液溴的量。
②加装一个用苯(CCl4)除溴蒸气的装置。
③倒扣的漏斗可以防倒吸,还有利于尾气吸收
生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?
为什么?如何除去混在HBr中的溴蒸气?
不可靠,因为溴易挥发。
溴蒸气溶于水,
也能生成HBr
与AgNO3溶液
反应生成淡黄色沉淀。
将产生的气体
①通过苯(CCl4)洗气
(除去其中的溴)
②再通入AgNO3溶液中
AgNO3 +HBr = AgBr↓ +HNO3
HBr
取代反应——溴化反应装置改进
(1)试剂的加入顺序为?
(2)长玻璃导管的作用是什么?
(3)蒸馏水的作用?
(4)碱石灰的作用?
(5)滴加硝酸银溶液作用?
(6)两种产物的位置在哪里?
先加苯,再加溴,最后加铁粉
导气(苯和溴都易挥发)兼起冷凝回流(放热反应)作用
吸收反应的尾气HBr和溴蒸气
产生淡黄色沉淀,检验HBr
溴苯在三颈烧瓶里,
HBr由于其易挥发,挥发到锥形瓶中
冷凝作用和吸收HBr
取代反应——溴化反应注意事项总结:
思考:如何获得纯净的溴苯?
产物中可能含有溴苯、苯、
HBr和Br2
试剂:
操作:
目的:
水
分液
除HBr
HBr水溶液
溴苯
苯、溴
试剂:
操作:
目的:
NaOH
分液
除Br2
NaBr溶液
NaBrO溶液
溴苯
苯
溴苯
苯
蒸馏
除苯
操作:
目的:
取代反应——硝化反应
50~60
+ HNO3
+ H2O
浓硫酸
无色、苦杏仁味的
油状液体,密度大于水
硝基苯
HO-NO2
苯环里的氢原子被硝酸分子里的硝基(-NO2)所取代的反应
浓硫酸:
作催化剂加快反应;吸水使反应有利于正向移动
反应实质
水浴加热,50~60 ℃;优点:反应物均匀受热且容易控制温度。
℃
(1)试剂添加顺序?
(2)加热方式?
(3)温度计位置?
(4)试管上方长导管的作用?
(5)浓硫酸的作用?
(6)溶液为什么显黄色?
先加浓硝酸,再加浓硫酸,等混合液冷却到50-60℃后再加苯 (因为,苯和硝酸均易挥发)
水浴加热,容易控制温度,受热均匀
温度计必须悬挂在水浴中,温度过高,苯挥发,硝酸分解。
导气兼冷凝回流、减少反应物的挥发
催化剂、吸水剂
硝基苯因溶有少量NO2而显黄色
取代反应——硝化反应注意事项总结:
思考:如何获得纯净的硝基苯?
产物中可能含有硝基苯、苯、硫酸、硝酸、NO2
试剂:
操作:
目的:
水
分液
除酸
酸液
硝基苯
苯
残余酸
试剂:
操作:
目的:
NaOH
分液
除酸
盐溶液
硝基苯
苯
硝基苯
苯
蒸馏
除苯
操作:
目的:
加热方式的比较
水浴温度0-100℃
(水作为热浴物质)
油浴温度100-250℃
(油作为热浴物质)
沙浴温度400-600℃
(沙石作为热浴物质)
加热时,待加热的物质通常置于容器内,容器置于热源上,有些容器,如玻璃容器和陶瓷容器,若直接置于热源上,则往往因受热不均,温升过快,产生炸裂,或因热传递不良,使加热物质受热不均匀。为此,对进入实验室的加热容器产品应进行热浴处理。
所谓热浴,是将容器置于热浴物质内,让热浴物质的温度缓慢升高到一定程度,再让其缓慢冷却,从而达到改善容器热传递性能,使容器质底均匀的方法。在实验室常用的热浴方法:
大鹿化学
取代反应——磺化反应
苯磺酸
苯与浓硫酸在70~80℃发生取代反应
苯磺酸易溶于水,是一种强酸。
应用:
磺化反应被广泛应用于制备合成洗涤剂。
浓硫酸作用:反应物和吸水剂
磺酸基
☆★苯的溴代反应、硝化反应、磺化反应都属于取代反应。
加成反应
苯的大π键比较稳定,一般不易发生烯烃和炔烃所发生的加成反应
在Pt、Ni等催化剂并加热的条件下,苯能与H2发生加成反应,生成环己烷
+ 3H2
催化剂
△
在光照条件下,苯能与氯气发生加成反应,生成六氯环己烷
3Cl2
光照
Cl
Cl
Cl
Cl
Cl
Cl
(六六六农药)
氧化反应
a.可燃性
12CO2+6H2O
2C6H6+15O2
火焰明亮,并伴有浓烟
b.苯 能使酸性高锰酸钾褪色?
难氧化
不
傅克反应
(苯+卤代烃/酰氯→烷基苯/酮)
在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应,称为傅列德尔一克拉夫茨烷基化反应;芳烃与酰卤或酸酐作用,芳环上的氢原子被酰基取代,生成芳酮的反应,称为傅列德尔~克拉夫茨酰基化反应
AlCl3
C2H5
HBr
C2H5Br
AlCl3
HCl
CH3C
O
Cl
CCH3
O
(2)可燃
(1)稳定
(3)易取代:
(4) 难加成:
2C6H6 + 15O2 12CO2 + 6H2O
点燃
磺化反应
与氢气、氯气加成
不能使溴水和酸性高锰酸钾溶液褪色。
卤代反应
硝化反应
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
+HO-SO3H
70℃~80℃
-SO3H
+ H2O
+ Br2
FeBr3
Br
+ HBr
总体来说,苯的化学性质是“易取代,能加成,难氧化”
1. 在实验室中,下列除去杂质的方法正确的是( )
A. 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取溴
B. 硝基苯中混有浓硝酸和浓硫酸,将其倒入到NaOH溶液中,静置,分液
C. 乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷
D. 乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气
B
2.下列关于苯的叙述正确的是( )
A.反应①为加成反应
B.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
C.反应③为取代反应,有机产物是一种烃
D.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
D
第二章 烃
第3节 芳香烃
第1课时 苯的结构与性质
1.通过实验探究活动,预测、验证并分析苯及其同系物的化学性质。
2.通过对比、类比等方法,说出苯和苯的同系物的性质异同,举例说明有机化合物中官能团之间的相互影响。
苯的发现:
远在2300多年前,诗人屈原在《楚辞》中就写下了“蕙肴蒸兮兰藉”的诗文,可见芳香油的利用具有悠久的历史,之后科学家的研究中发现,有芳香气味的物质中的很多化合物有一个共同的特点:含有一个相同的结构单元——苯环。
芳香烃:在烃类化合物中,含有一个或多个苯环的化合物。
最简单的芳香烃为苯。
COOH
Cl
芳香族化合物:
芳香烃:
苯的同系物:
是分子中含有苯环的化合物(一个或多个苯环)。
分子中含有一个苯环,苯环上的侧链全部为烷烃基。
[区别] 芳香化合物、芳香烃、苯的同系物三个概念
芳香化合物:含苯环的化合物(可含除C、H外的元素)。
芳香烃:含有苯环的烃(只含C、H元素) 。
苯的同系物:有1个苯环,侧链全为烷烃基的芳香烃。
芳香烃
同系物
苯的
芳香化合物
苯
最简单的芳香烃是:苯
实验探究苯的分子结构
向两支各盛有2 mL苯的试管中分别加入酸性高锰酸钾溶液和溴水,用力振荡,观察现象。
试剂 实验现象 实验结论
酸性高锰 酸钾溶液
溴水 溴在苯中的溶解度比在水中的大,因此苯能将溴从水中萃取出来。
苯不能被酸性高锰酸钾溶液氧化,也不与溴水反应,苯分子具有不同于烯烃和炔烃的特殊结构
共价键 碳碳 单键 碳碳 双键 苯环中的
碳碳键
键长/pm 154.1 133.7 139
X射线衍射法证实了苯分子结构是平面正六边形
每个碳碳键的键长相等,都是139 pm,
介于碳碳单键与碳碳双键的键长之间。
苯分子中的碳碳键是一种介于单键和双键之间的独特的键
结论:
(六个C-C键完全相同)
1
2
4
3
苯分子中的6个碳碳键的键长相等
苯不能使溴的四氯化碳溶液褪色
如何证明苯分子中只有一种介于碳碳单键和碳碳双键之间的特殊的键?
和
是同一种物质
苯不能使酸性高锰酸钾溶液褪色
球棍模型
空间填充模型
分 子 式:C6H6
实 验 式:CH
结 构 式:
键 线 式:
H
H
H
H
H
H
大π键
σ键
①平面正六边形,6个C均采取sp2杂化,分别与
H及相邻C以σ键结合,键角均为120o。
②每个碳碳键的键长相等,都是139pm,介于碳
碳单键和碳碳双键的键长之间。
③每个C均有一个未参与杂化的p轨道垂直于正
六边形平面,相互平行重叠形成大π键,均匀
地对称分布在苯环平面的上下两侧。
颜 色:
气 味:
状 态:
密 度:
溶解性:
挥发性:
熔沸点:
无色透明
特殊芳香气味
液体
比水 。
不溶于水, 易溶于有机溶剂
易挥发
熔点5.5℃,沸点80.1 ℃
苯的物理性质
有 毒
用冰冷却时结成无色的晶体。
(密封保存)
小
苯有毒!苯是一种重要的化工原料和有机溶剂.
P41
(0.88g/cm3)
苯分子中的碳碳键介于单键和双键之间的独特的键,苯既有烷烃的性质,能发生取代反应,也有烯烃的性质,但由于大π键比较稳定,在一定情况下能发生加成反应。苯有可燃性,但不能被酸性KMnO4溶液以及溴水氧化。
易取代,能加成,难氧化。
根据苯的结构,预测苯可能发生的化学反应类型。
苯的化学性质
苯的化学性质
氧化反应
加成反应
取代反应
①可燃性
纯卤素
√
②使酸性KMnO4溶液褪色
×
硝酸
硫酸
H2、X2、HX、H2O
√
阅读教材,苯能发生的化学反应类型。
除去溶解在溴苯中的液溴,以提纯溴苯
吸收检验HBr
吸收HBr,防止污染环境
防止倒吸
冷凝回流、导气
反应现象:
液体轻微沸腾;
反应结束后,三颈烧瓶底部出现棕褐色油状液体;
锥形瓶内有白雾,向锥形瓶中加入AgNO3溶液,出现浅黄色沉淀不溶于硝酸;
向三颈烧瓶中加入NaOH溶液,溶液分层,并产生红褐色沉淀。
取代反应——溴化反应
取代反应——溴化反应
+ Br2 + HBr ↑
FeBr3
Br
无色液体,不溶于水,密度比水大
溴苯
反应实质
苯环里的氢原子被溴分子里的溴原子(-Br)所取代的反应
纯液溴
或Fe粉
2Fe+3Br2===2FeBr3
苯
液溴
混合
长导管口处
锥形瓶内
①滴入AgNO3溶液
烧瓶内液体
倒入烧杯内水中
Fe屑
互溶、
不反应
深红棕色
剧烈
反应
(放热反应)
大量白雾
淡黄色沉淀
烧杯底部有褐色油状物、不溶于水
实验小结:
取溶液:
②加入镁粉
产生大量气体
加入NaOH搅拌
得到无色油状物
上层清液中加入KSCN(aq)溶液变血红色
(HBr与水蒸气的小液滴)
说明瓶内有H+ 和Br-
说明Fe被Br2氧化成了Fe3+
生成了有机物溴苯
从这些现象中分别可以得出什么结论呢?
取代反应——溴化反应
苯和液溴 —— 取代 —— 化学反应
苯和溴水 —— 萃取 —— 物理变化
纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
反应中制取的是粗产品,剩余的Br2溶解在生成的溴苯中。
水洗→碱洗→水洗→干燥→蒸馏(得到纯净的溴苯)
除去溴苯
中的溴
除去溴蒸气,
净化HBr气体
检验HBr酸性
检验HBr
除去HBr尾气
防倒吸
①有分液漏斗,控制液溴的量。
②加装一个用苯(CCl4)除溴蒸气的装置。
③倒扣的漏斗可以防倒吸,还有利于尾气吸收
生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?
为什么?如何除去混在HBr中的溴蒸气?
不可靠,因为溴易挥发。
溴蒸气溶于水,
也能生成HBr
与AgNO3溶液
反应生成淡黄色沉淀。
将产生的气体
①通过苯(CCl4)洗气
(除去其中的溴)
②再通入AgNO3溶液中
AgNO3 +HBr = AgBr↓ +HNO3
HBr
取代反应——溴化反应装置改进
(1)试剂的加入顺序为?
(2)长玻璃导管的作用是什么?
(3)蒸馏水的作用?
(4)碱石灰的作用?
(5)滴加硝酸银溶液作用?
(6)两种产物的位置在哪里?
先加苯,再加溴,最后加铁粉
导气(苯和溴都易挥发)兼起冷凝回流(放热反应)作用
吸收反应的尾气HBr和溴蒸气
产生淡黄色沉淀,检验HBr
溴苯在三颈烧瓶里,
HBr由于其易挥发,挥发到锥形瓶中
冷凝作用和吸收HBr
取代反应——溴化反应注意事项总结:
思考:如何获得纯净的溴苯?
产物中可能含有溴苯、苯、
HBr和Br2
试剂:
操作:
目的:
水
分液
除HBr
HBr水溶液
溴苯
苯、溴
试剂:
操作:
目的:
NaOH
分液
除Br2
NaBr溶液
NaBrO溶液
溴苯
苯
溴苯
苯
蒸馏
除苯
操作:
目的:
取代反应——硝化反应
50~60
+ HNO3
+ H2O
浓硫酸
无色、苦杏仁味的
油状液体,密度大于水
硝基苯
HO-NO2
苯环里的氢原子被硝酸分子里的硝基(-NO2)所取代的反应
浓硫酸:
作催化剂加快反应;吸水使反应有利于正向移动
反应实质
水浴加热,50~60 ℃;优点:反应物均匀受热且容易控制温度。
℃
(1)试剂添加顺序?
(2)加热方式?
(3)温度计位置?
(4)试管上方长导管的作用?
(5)浓硫酸的作用?
(6)溶液为什么显黄色?
先加浓硝酸,再加浓硫酸,等混合液冷却到50-60℃后再加苯 (因为,苯和硝酸均易挥发)
水浴加热,容易控制温度,受热均匀
温度计必须悬挂在水浴中,温度过高,苯挥发,硝酸分解。
导气兼冷凝回流、减少反应物的挥发
催化剂、吸水剂
硝基苯因溶有少量NO2而显黄色
取代反应——硝化反应注意事项总结:
思考:如何获得纯净的硝基苯?
产物中可能含有硝基苯、苯、硫酸、硝酸、NO2
试剂:
操作:
目的:
水
分液
除酸
酸液
硝基苯
苯
残余酸
试剂:
操作:
目的:
NaOH
分液
除酸
盐溶液
硝基苯
苯
硝基苯
苯
蒸馏
除苯
操作:
目的:
加热方式的比较
水浴温度0-100℃
(水作为热浴物质)
油浴温度100-250℃
(油作为热浴物质)
沙浴温度400-600℃
(沙石作为热浴物质)
加热时,待加热的物质通常置于容器内,容器置于热源上,有些容器,如玻璃容器和陶瓷容器,若直接置于热源上,则往往因受热不均,温升过快,产生炸裂,或因热传递不良,使加热物质受热不均匀。为此,对进入实验室的加热容器产品应进行热浴处理。
所谓热浴,是将容器置于热浴物质内,让热浴物质的温度缓慢升高到一定程度,再让其缓慢冷却,从而达到改善容器热传递性能,使容器质底均匀的方法。在实验室常用的热浴方法:
大鹿化学
取代反应——磺化反应
苯磺酸
苯与浓硫酸在70~80℃发生取代反应
苯磺酸易溶于水,是一种强酸。
应用:
磺化反应被广泛应用于制备合成洗涤剂。
浓硫酸作用:反应物和吸水剂
磺酸基
☆★苯的溴代反应、硝化反应、磺化反应都属于取代反应。
加成反应
苯的大π键比较稳定,一般不易发生烯烃和炔烃所发生的加成反应
在Pt、Ni等催化剂并加热的条件下,苯能与H2发生加成反应,生成环己烷
+ 3H2
催化剂
△
在光照条件下,苯能与氯气发生加成反应,生成六氯环己烷
3Cl2
光照
Cl
Cl
Cl
Cl
Cl
Cl
(六六六农药)
氧化反应
a.可燃性
12CO2+6H2O
2C6H6+15O2
火焰明亮,并伴有浓烟
b.苯 能使酸性高锰酸钾褪色?
难氧化
不
傅克反应
(苯+卤代烃/酰氯→烷基苯/酮)
在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应,称为傅列德尔一克拉夫茨烷基化反应;芳烃与酰卤或酸酐作用,芳环上的氢原子被酰基取代,生成芳酮的反应,称为傅列德尔~克拉夫茨酰基化反应
AlCl3
C2H5
HBr
C2H5Br
AlCl3
HCl
CH3C
O
Cl
CCH3
O
(2)可燃
(1)稳定
(3)易取代:
(4) 难加成:
2C6H6 + 15O2 12CO2 + 6H2O
点燃
磺化反应
与氢气、氯气加成
不能使溴水和酸性高锰酸钾溶液褪色。
卤代反应
硝化反应
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
+HO-SO3H
70℃~80℃
-SO3H
+ H2O
+ Br2
FeBr3
Br
+ HBr
总体来说,苯的化学性质是“易取代,能加成,难氧化”
1. 在实验室中,下列除去杂质的方法正确的是( )
A. 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取溴
B. 硝基苯中混有浓硝酸和浓硫酸,将其倒入到NaOH溶液中,静置,分液
C. 乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷
D. 乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气
B
2.下列关于苯的叙述正确的是( )
A.反应①为加成反应
B.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
C.反应③为取代反应,有机产物是一种烃
D.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
D
