3.2.1 醇 课件(共36张PPT)人教版(2019)选择性必修三
文档属性
| 名称 | 3.2.1 醇 课件(共36张PPT)人教版(2019)选择性必修三 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 22:19:42 | ||
图片预览








文档简介
(共36张PPT)
第三章 烃的衍生物
第2节 醇 酚
第1课时 醇
醇和酚都是重要的有机化合物。例如,常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、 用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上 10 种有机化合物
到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的
有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
酚也是一种分子中含有羟基的有机化合物,它和醇的结构、性质有何异同?
联想·质疑
活动:
温故知新
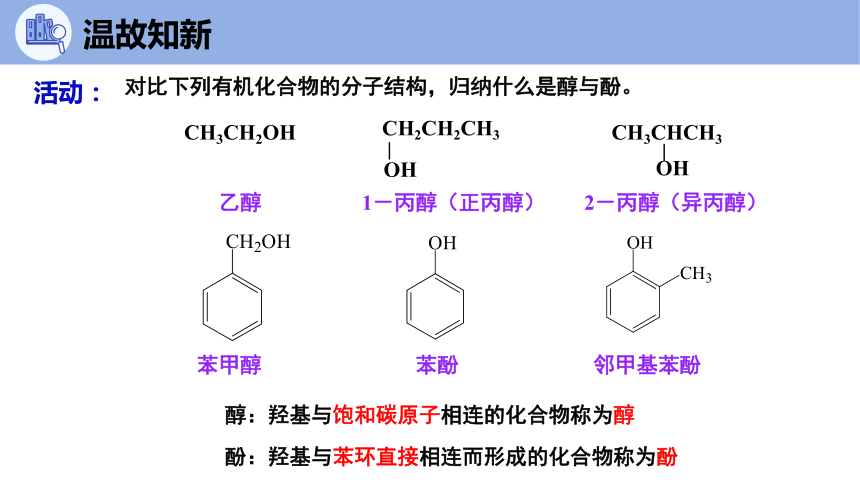
对比下列有机化合物的分子结构,归纳什么是醇与酚。
硫粉
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
醇:羟基与饱和碳原子相连的化合物称为醇
酚:羟基与苯环直接相连而形成的化合物称为酚
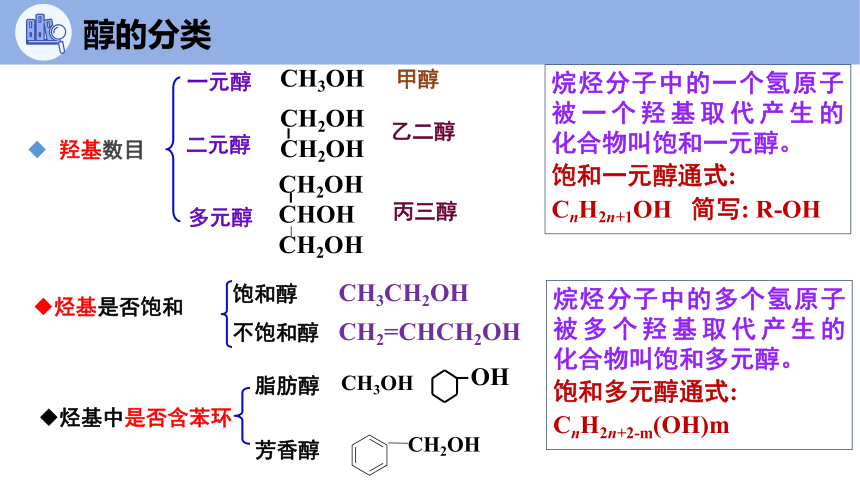
醇的分类
烷烃分子中的一个氢原子被一个羟基取代产生的 化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH 简写: R-OH
硫粉
羟基数目
一元醇
CH3OH 甲醇
乙二醇
CH2OH
CH2OH
CH2OH
CHOH
CH2OH
丙三醇
烃基是否饱和
烃基中是否含苯环
饱和醇
不饱和醇
脂肪醇
芳香醇
多元醇
二元醇
CH2=CHCH2OH
OH
CH3OH
CH2OH
CH3CH2OH
烷烃分子中的多个氢原子被多个羟基取代产生的 化合物叫饱和多元醇。
饱和多元醇通式:
CnH2n+2-m(OH)m
醇的分类
按羟基数目
二元醇
三元醇
一元醇
硫粉
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
CH3OH
甲醇(木醇、木精)
剧毒
用于能源领域
如汽车燃料
醇的分类
硫粉
名称 性质 用途
甲醇 无色透明、易挥发的液体;能与水及多种有机溶剂混溶;有毒、误服少量(10 mL)可致人失明,多量(30 mL)可致人死亡 化工原料、燃料
乙二醇 丙三醇 无色、黏稠的液体,有甜味、能与水混溶,能显著降低水的凝固点
发动机防冻液的主要化学成分,也是合成涤纶等高分子化合物的主要原料
无色、黏稠、具有甜味的液体,能与水以任意比例混溶,具有很强吸水能力
吸水能力—配制印泥、化妆品;凝固点低—作防冻剂;
三硝酸甘油酯俗称硝化甘油, 可作炸药等
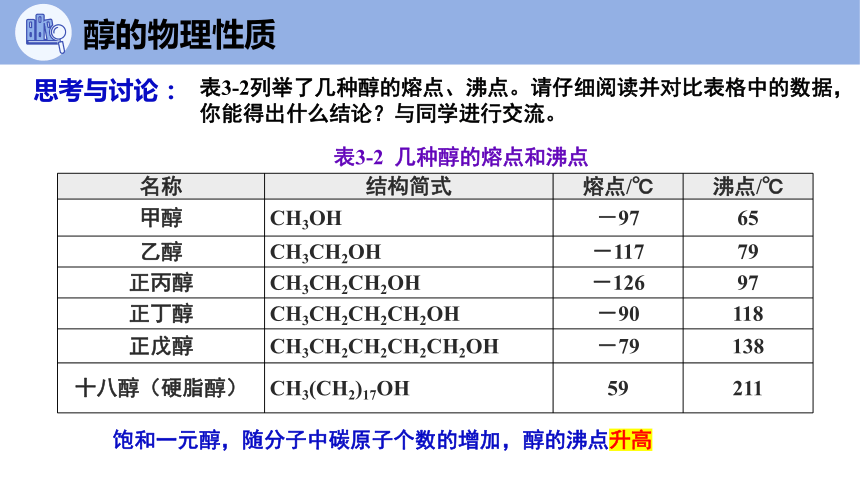
醇的物理性质
硫粉
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
表3-2列举了几种醇的熔点、沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
思考与讨论:
饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高
表3-3列举了几种相对分子质量相近的醇与烷烃的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间的相互作用增强,至使沸点升高。
羟基影响醇的沸点
表3-4列举了几种醇的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
表3-4 几种醇的沸点
碳原子数相同时,羟基个数越多,醇的沸点越高
3-5列举了几种醇在水中的溶解情况。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
硫粉
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
表3-5 几种醇的沸点
甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比例混溶。
随着烷基增大,醇的溶解度减小
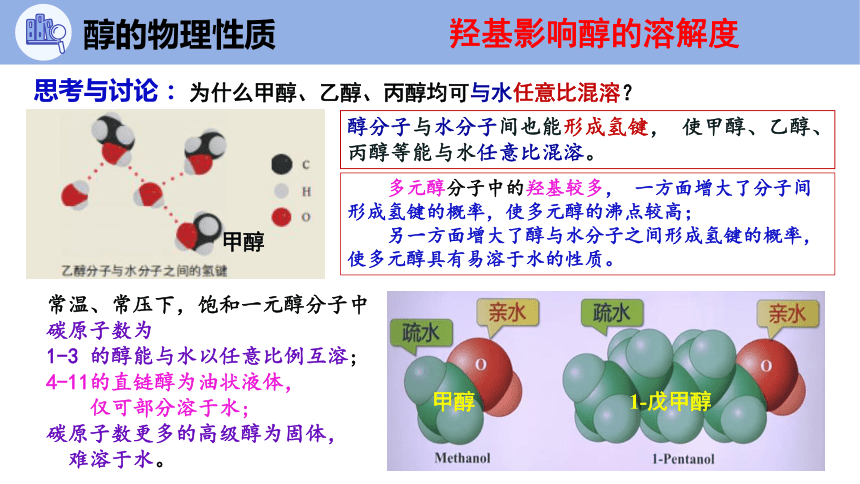
为什么甲醇、乙醇、丙醇均可与水任意比混溶?
醇分子与水分子间也能形成氢键, 使甲醇、乙醇、丙醇等能与水任意比混溶。
醇的物理性质
思考与讨论:
常温、常压下,饱和一元醇分子中
碳原子数为
1-3 的醇能与水以任意比例互溶;
4-11的直链醇为油状液体,
仅可部分溶于水;
碳原子数更多的高级醇为固体,
难溶于水。
多元醇分子中的羟基较多, 一方面增大了分子间 形成氢键的概率,使多元醇的沸点较高;
另一方面增大了醇与水分子之间形成氢键的概率,使多元醇具有易溶于水的性质。
甲醇
甲醇
1-戊甲醇
羟基影响醇的溶解度
最近的《流体 物理评论》(Physical Review Fluids)杂志上记录着一项研究:法国的物理学家成功地用 塑料颗粒、甘油和水制造出了能够保持很久的泡泡,最久的多达 465 天。
拓展视野
论文链接:https://journals.aps.org/prfluids/abstract/10.1103/PhysRevFluids.7.L011601
三种泡泡的寿命对比:
a. 肥皂泡:1 分钟
b. 水煤气泡:6-9 分钟
c. 水 / 甘油泡:101 + 天
甘油与水分子间产生很强的氢键,更能从空气中吸收水分,从而补偿水分蒸发。
醇的化学性质
思考与讨论:
以乙醇为例,分析其结构,并预测反应类型。
醇的化学性质主要是由官能团-羟基所决定。
羟基氧原子吸引电子能力比氢原子和碳原子的强,
使O-H和C-O的电子都向氧原子偏移。
①中的O-H键易断裂,使羟基氢原子被取代
②中的C-O键易断裂,脱羟基,发生取代反应/消去反应
醇的化学性质
1.置换反应
与活泼金属(Na)的反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H
乙醇钠是有机合成中的重要试剂,它常用于医药和农药等生产中,也常用作有机合成中的强碱性催化剂。
醇的化学性质
[活动1]:写出乙二醇、丙三醇与钠反应化学方程式。
+ 2Na →
CH2OH
CH2OH
+ H2↑
CH2ONa
CH2ONa
+ 6Na →
CH2OH
CHOH
CH2OH
2
+ 3H2↑
CH2ONa
CHONa
CH2ONa
2
2mol -OH ~ 2mol Na~1molH2
通过与钠的反应可测定醇分子中羟基的个数
醇的化学性质
2.取代反应
①与氢卤酸反应
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
断裂化学键的位置:②的-OH
[实质]卤原子取代羟基,-OH和H生成水
H C C O H
H
H
H
H
①
②
③
④
卤代烃
醇
强碱水溶液,加热-X被-OH取代
氢卤酸,加热-OH被-X取代
[应用]可用于制备卤代烃
醇的化学性质
2.取代反应
②与羧酸反应—酯化反应
CH3CO-OH + H-O-C2H5 CH3COOC2H5+H2O
浓硫酸
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H
[实质]酸出羟基,醇出氢
[活动2]:写出苯甲醇与乙酸反应化学方程式。
酸脱羟基,醇脱氢
同位素示踪法
18
O
CH3—C—OH +H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
醇的化学性质
2.取代反应
③醇分子间的取代反应
[反应条件]浓硫酸、140 ℃
两醇脱去一个水分子生成醚
乙醚:无色液体、易挥发,有特殊气味,有麻醉作用,微溶于水,易溶于有机溶剂,乙醚一种优良溶剂。
两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构:R-O-R’,R和R’表示烃基,可相同,也可不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H和②的-OH
C2H5-OH + H-OC2H5 C2H5-O-C2H5 + H2O
浓H2SO4
140 ℃
乙醚开创了医用麻醉时代
跨学科链接
外科手术离不开麻醉。麻醉的原意是用药物或其他方法,使病人整个机体或机体的一部分暂时失去感觉,以达到无痛的目的。中国最早关于麻醉药物的记载是2000年前扁鹊用麻醉药物进行手术。在西方,古希腊人用葡萄酒加乳香等制成饮料产生麻醉作用。直到18世纪前后,随着工业革命和化学研究的发展,化学家普利斯特里 (J. Priestley)发现了一氧化二氮(N2O),它很快被用于牙科麻醉,该麻醉剂多采用N2O和20%O2的混合气体。
1818年,化学家法拉第发现当乙醚蒸气和空气混合后,人会出现酒醉和沉睡的现象,与先前发现的N2O作用相似。但因乙醚具有易燃、易爆性,人们普遍认为其在医学中的使用是危险的,当时未应用于临床。不久,有人发现吸入乙醚后像醉汉一样跌倒受伤的受试者中无一诉说存在疼痛,据此推测乙醚可作为麻醉药。1846年,美国医生摩尔顿(W. T. G.Morton)用吸入乙醚方式麻醉了一名患者,并切除其下颌的肿瘤,摩尔顿成为乙醚麻醉术的第一个演示者,由此,麻醉学科正式创立。
麻醉剂从第一代一氧化二氮、乙醚等到第二代乙烯醚、环丙烷,一直存在易燃、易爆、不良反应的毒副作用等问题。20世纪50年代后,化学家在乙醚基础上发明了 氟代醚,这是不易燃的吸入式麻醉药,但也存在一定的毒副作用。研制新型的、毒副作用更低的特异性麻醉药,仍是当今化学药物研究的一大课题。
醇的化学性质
3.消去反应
[实验现象]
KMnO4酸性溶液、溴的CCl4溶液褪色
[实验结论]
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
[实验3-2]实验室制乙烯
制乙烯实验装置
酒精与浓硫酸体积比为1∶3(浓硫酸缓慢加入乙醇中)
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
NaOH溶液作用?
用排水集气法收集(不用排空气法)
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。
吸收SO2和乙醇
注意:温度计水银球要置于反应物的中央位置因为需要测量的是反应物的温度,而且不能与烧瓶接触。
SO2和乙醇干扰KMnO4酸性溶液对产物乙烯的检验
醇的化学性质
3.消去反应
[实验3-2]实验室制乙烯
1.98%浓硫酸:催化剂和脱水剂。
2.配制体积比为1:3的乙醇与浓硫酸:
向95%的乙醇,滴加浓硫酸,边搅拌,冷却备用。
3.碎瓷片(沸石):防液体受热时发生暴沸。
4.温度计的水银球要置于反应液中央。
5.温度迅速升到170℃。140℃,生成乙醚。
6.NaOH溶液:浓硫酸会让乙醇变成C,
C+浓硫酸→SO2,用NaOH溶液吸收。
7.乙烯用排水法收集。
醇的化学性质
3.消去反应
CH2=CH2+ H2O
浓H2SO4
170 ℃
H C C O H
H
H
H
H
[反应条件]浓硫酸、170 ℃ 断裂化学键的位置:②的-OH和④的C-H
[反应实质]断羟基及β-C上的一个氢
H C C O H
H
H
H
H
①
②
③
④
β α
[活动3]:写出乙二醇发生消去反应的化学方程式。
烯/炔
醇
水,催化剂/加热加压,加成反应
浓硫酸/170 ℃,消去反应
[应用]可用于制备烯、炔烃
醇的化学性质
3.消去反应
(1)
(2)
(3)
(4)
醇的化学性质
思考与讨论:
CH2-CH2-CH2-CH2
溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同
现象 CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液 加热
C—Br C—H
碳碳双键
CH2=CH2 NaBr H2O
C—O C—H
碳碳双键
CH2=CH2 H2O
CH2-CH2-CH2-CH2
OH
Br
浓硫酸
△
CH2=CH-CH=CH2
+ 2H2O
写出下列化学反应方程式
(1)
(2)
OH
Br
+ 2NaOH
醇
△
CH2=CH-CH=CH2
浓硫酸 170℃加热
+ 2NaBr + 2H2O
醇的化学性质
4.氧化反应
乙醇是一种清洁燃料,在空气中完全燃烧,生成CO2和H2O:
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
①燃烧
醇的化学性质
4.氧化反应
②催化氧化
2H—C—C—H
H O—H
H H
+ O2
Cu/Ag
2H—C—C—H
H O
H
+ 2H2O
H C C O H
H
H
H
H
①
②
③
④
β α
[反应条件]Cu/Ag、△
断裂化学键的位置:②的-OH和③的C-H
[反应实质]断羟基及 α-C上的一个氢
思考与讨论:是否所有的醇都可催化氧化生成醇?
醇的化学性质
4.氧化反应
②催化氧化
α-C上氢原子个数
醇的化学性质
4.氧化反应
②催化氧化
[活动4]:判断以下醇能否发生催化氧化反应,若能,写出反应的
化学方程式。
醇的化学性质
4.氧化反应
③与强氧化剂的反应
C2H5OH
KMnO4(H+)
CH3COOH
酸性高锰酸钾紫红色褪去
还原
橙色
Cr2O72-
Cr3+
绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
K2Cr2O7(H+)
C2H5OH
CH3CHO
CH3COOH
继续氧化
醇的化学性质
4.氧化反应
③与强氧化剂的反应
与醇的催化氧化类似,羟基 碳原子上没有H原子的醇,不能与强氧化剂发生反应。
A.羟基所在碳上有两个氢可氧化生成酸
B.羟基所在碳上有一个氢可氧化生成酮
C.羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
整理与提升
乙醇的化学性质与结构的关系 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 —
取代 反应 卤代反应 乙醇、浓HX
酯化反应 乙醇、羧酸
(自身)成醚 分子间脱水 乙醇
消去反应 乙醇
氧化 反应 催化氧化 乙醇、氧气
强氧化剂氧化 乙醇、KMnO4/H+
燃烧 乙醇、O2 全部 点燃
有来有往为取代,有来无往是加成,有往无来为消去,得氧失氢是氧化,得氢失氧为还原。
①
②
①
一分子断①,
另一分子断②
②⑤
①③
①③
△
浓硫酸,△
浓硫酸,
140 ℃
浓硫酸,
170 ℃
Cu/Ag,△
—
整理与提升
整理与提升
烃
取
代
卤代烃
R-X
水
解
醇
R-OH
氧
化
醛
R'-CHO
氧
化
酸
R'-COOH
不 饱 和 烃
消
去
消
去
酯
加
成
加
成
取代
HX
强氧化剂
整理与提升
1.氧化反应
有机化学中的氧化反应及还原反应
在有机化学反应中,通常把有机化合物分子中失去氢原子或者加入氧原子的反应叫做氧化反应(有机物被氧化)。
2.还原反应
在有机化学反应中,通常把有机化合物分子中加入氢原子或者失去氧原子的反应叫做还原反应(有机物被还原)。
常见的氧化剂有氧气、酸性 KMnO4溶液、臭氧、银氨溶液和
新制氢氧化铜悬浊液等
常见的还原剂有氢气、氢化铝锂(LiAIH4)和硼氢化钠(NaBH4)等
利用氧化反应或还原反应,可以使有机化合物的官能团发生转变,实现醇醛和羧酸等有机化合物之间的相互转化。
赏析实验
第三章 烃的衍生物
第2节 醇 酚
第1课时 醇
醇和酚都是重要的有机化合物。例如,常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、 用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上 10 种有机化合物
到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的
有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
酚也是一种分子中含有羟基的有机化合物,它和醇的结构、性质有何异同?
联想·质疑
活动:
温故知新
对比下列有机化合物的分子结构,归纳什么是醇与酚。
硫粉
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
醇:羟基与饱和碳原子相连的化合物称为醇
酚:羟基与苯环直接相连而形成的化合物称为酚
醇的分类
烷烃分子中的一个氢原子被一个羟基取代产生的 化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH 简写: R-OH
硫粉
羟基数目
一元醇
CH3OH 甲醇
乙二醇
CH2OH
CH2OH
CH2OH
CHOH
CH2OH
丙三醇
烃基是否饱和
烃基中是否含苯环
饱和醇
不饱和醇
脂肪醇
芳香醇
多元醇
二元醇
CH2=CHCH2OH
OH
CH3OH
CH2OH
CH3CH2OH
烷烃分子中的多个氢原子被多个羟基取代产生的 化合物叫饱和多元醇。
饱和多元醇通式:
CnH2n+2-m(OH)m
醇的分类
按羟基数目
二元醇
三元醇
一元醇
硫粉
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
CH3OH
甲醇(木醇、木精)
剧毒
用于能源领域
如汽车燃料
醇的分类
硫粉
名称 性质 用途
甲醇 无色透明、易挥发的液体;能与水及多种有机溶剂混溶;有毒、误服少量(10 mL)可致人失明,多量(30 mL)可致人死亡 化工原料、燃料
乙二醇 丙三醇 无色、黏稠的液体,有甜味、能与水混溶,能显著降低水的凝固点
发动机防冻液的主要化学成分,也是合成涤纶等高分子化合物的主要原料
无色、黏稠、具有甜味的液体,能与水以任意比例混溶,具有很强吸水能力
吸水能力—配制印泥、化妆品;凝固点低—作防冻剂;
三硝酸甘油酯俗称硝化甘油, 可作炸药等
醇的物理性质
硫粉
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
表3-2列举了几种醇的熔点、沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
思考与讨论:
饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高
表3-3列举了几种相对分子质量相近的醇与烷烃的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间的相互作用增强,至使沸点升高。
羟基影响醇的沸点
表3-4列举了几种醇的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
表3-4 几种醇的沸点
碳原子数相同时,羟基个数越多,醇的沸点越高
3-5列举了几种醇在水中的溶解情况。请仔细阅读并对比表格中的数据,你能得出什么结论?与同学进行交流。
醇的物理性质
思考与讨论:
硫粉
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
表3-5 几种醇的沸点
甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比例混溶。
随着烷基增大,醇的溶解度减小
为什么甲醇、乙醇、丙醇均可与水任意比混溶?
醇分子与水分子间也能形成氢键, 使甲醇、乙醇、丙醇等能与水任意比混溶。
醇的物理性质
思考与讨论:
常温、常压下,饱和一元醇分子中
碳原子数为
1-3 的醇能与水以任意比例互溶;
4-11的直链醇为油状液体,
仅可部分溶于水;
碳原子数更多的高级醇为固体,
难溶于水。
多元醇分子中的羟基较多, 一方面增大了分子间 形成氢键的概率,使多元醇的沸点较高;
另一方面增大了醇与水分子之间形成氢键的概率,使多元醇具有易溶于水的性质。
甲醇
甲醇
1-戊甲醇
羟基影响醇的溶解度
最近的《流体 物理评论》(Physical Review Fluids)杂志上记录着一项研究:法国的物理学家成功地用 塑料颗粒、甘油和水制造出了能够保持很久的泡泡,最久的多达 465 天。
拓展视野
论文链接:https://journals.aps.org/prfluids/abstract/10.1103/PhysRevFluids.7.L011601
三种泡泡的寿命对比:
a. 肥皂泡:1 分钟
b. 水煤气泡:6-9 分钟
c. 水 / 甘油泡:101 + 天
甘油与水分子间产生很强的氢键,更能从空气中吸收水分,从而补偿水分蒸发。
醇的化学性质
思考与讨论:
以乙醇为例,分析其结构,并预测反应类型。
醇的化学性质主要是由官能团-羟基所决定。
羟基氧原子吸引电子能力比氢原子和碳原子的强,
使O-H和C-O的电子都向氧原子偏移。
①中的O-H键易断裂,使羟基氢原子被取代
②中的C-O键易断裂,脱羟基,发生取代反应/消去反应
醇的化学性质
1.置换反应
与活泼金属(Na)的反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H
乙醇钠是有机合成中的重要试剂,它常用于医药和农药等生产中,也常用作有机合成中的强碱性催化剂。
醇的化学性质
[活动1]:写出乙二醇、丙三醇与钠反应化学方程式。
+ 2Na →
CH2OH
CH2OH
+ H2↑
CH2ONa
CH2ONa
+ 6Na →
CH2OH
CHOH
CH2OH
2
+ 3H2↑
CH2ONa
CHONa
CH2ONa
2
2mol -OH ~ 2mol Na~1molH2
通过与钠的反应可测定醇分子中羟基的个数
醇的化学性质
2.取代反应
①与氢卤酸反应
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
断裂化学键的位置:②的-OH
[实质]卤原子取代羟基,-OH和H生成水
H C C O H
H
H
H
H
①
②
③
④
卤代烃
醇
强碱水溶液,加热-X被-OH取代
氢卤酸,加热-OH被-X取代
[应用]可用于制备卤代烃
醇的化学性质
2.取代反应
②与羧酸反应—酯化反应
CH3CO-OH + H-O-C2H5 CH3COOC2H5+H2O
浓硫酸
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H
[实质]酸出羟基,醇出氢
[活动2]:写出苯甲醇与乙酸反应化学方程式。
酸脱羟基,醇脱氢
同位素示踪法
18
O
CH3—C—OH +H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
醇的化学性质
2.取代反应
③醇分子间的取代反应
[反应条件]浓硫酸、140 ℃
两醇脱去一个水分子生成醚
乙醚:无色液体、易挥发,有特殊气味,有麻醉作用,微溶于水,易溶于有机溶剂,乙醚一种优良溶剂。
两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构:R-O-R’,R和R’表示烃基,可相同,也可不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
H C C O H
H
H
H
H
①
②
③
④
断裂化学键的位置:①的O-H和②的-OH
C2H5-OH + H-OC2H5 C2H5-O-C2H5 + H2O
浓H2SO4
140 ℃
乙醚开创了医用麻醉时代
跨学科链接
外科手术离不开麻醉。麻醉的原意是用药物或其他方法,使病人整个机体或机体的一部分暂时失去感觉,以达到无痛的目的。中国最早关于麻醉药物的记载是2000年前扁鹊用麻醉药物进行手术。在西方,古希腊人用葡萄酒加乳香等制成饮料产生麻醉作用。直到18世纪前后,随着工业革命和化学研究的发展,化学家普利斯特里 (J. Priestley)发现了一氧化二氮(N2O),它很快被用于牙科麻醉,该麻醉剂多采用N2O和20%O2的混合气体。
1818年,化学家法拉第发现当乙醚蒸气和空气混合后,人会出现酒醉和沉睡的现象,与先前发现的N2O作用相似。但因乙醚具有易燃、易爆性,人们普遍认为其在医学中的使用是危险的,当时未应用于临床。不久,有人发现吸入乙醚后像醉汉一样跌倒受伤的受试者中无一诉说存在疼痛,据此推测乙醚可作为麻醉药。1846年,美国医生摩尔顿(W. T. G.Morton)用吸入乙醚方式麻醉了一名患者,并切除其下颌的肿瘤,摩尔顿成为乙醚麻醉术的第一个演示者,由此,麻醉学科正式创立。
麻醉剂从第一代一氧化二氮、乙醚等到第二代乙烯醚、环丙烷,一直存在易燃、易爆、不良反应的毒副作用等问题。20世纪50年代后,化学家在乙醚基础上发明了 氟代醚,这是不易燃的吸入式麻醉药,但也存在一定的毒副作用。研制新型的、毒副作用更低的特异性麻醉药,仍是当今化学药物研究的一大课题。
醇的化学性质
3.消去反应
[实验现象]
KMnO4酸性溶液、溴的CCl4溶液褪色
[实验结论]
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
[实验3-2]实验室制乙烯
制乙烯实验装置
酒精与浓硫酸体积比为1∶3(浓硫酸缓慢加入乙醇中)
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
NaOH溶液作用?
用排水集气法收集(不用排空气法)
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。
吸收SO2和乙醇
注意:温度计水银球要置于反应物的中央位置因为需要测量的是反应物的温度,而且不能与烧瓶接触。
SO2和乙醇干扰KMnO4酸性溶液对产物乙烯的检验
醇的化学性质
3.消去反应
[实验3-2]实验室制乙烯
1.98%浓硫酸:催化剂和脱水剂。
2.配制体积比为1:3的乙醇与浓硫酸:
向95%的乙醇,滴加浓硫酸,边搅拌,冷却备用。
3.碎瓷片(沸石):防液体受热时发生暴沸。
4.温度计的水银球要置于反应液中央。
5.温度迅速升到170℃。140℃,生成乙醚。
6.NaOH溶液:浓硫酸会让乙醇变成C,
C+浓硫酸→SO2,用NaOH溶液吸收。
7.乙烯用排水法收集。
醇的化学性质
3.消去反应
CH2=CH2+ H2O
浓H2SO4
170 ℃
H C C O H
H
H
H
H
[反应条件]浓硫酸、170 ℃ 断裂化学键的位置:②的-OH和④的C-H
[反应实质]断羟基及β-C上的一个氢
H C C O H
H
H
H
H
①
②
③
④
β α
[活动3]:写出乙二醇发生消去反应的化学方程式。
烯/炔
醇
水,催化剂/加热加压,加成反应
浓硫酸/170 ℃,消去反应
[应用]可用于制备烯、炔烃
醇的化学性质
3.消去反应
(1)
(2)
(3)
(4)
醇的化学性质
思考与讨论:
CH2-CH2-CH2-CH2
溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同
现象 CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液 加热
C—Br C—H
碳碳双键
CH2=CH2 NaBr H2O
C—O C—H
碳碳双键
CH2=CH2 H2O
CH2-CH2-CH2-CH2
OH
Br
浓硫酸
△
CH2=CH-CH=CH2
+ 2H2O
写出下列化学反应方程式
(1)
(2)
OH
Br
+ 2NaOH
醇
△
CH2=CH-CH=CH2
浓硫酸 170℃加热
+ 2NaBr + 2H2O
醇的化学性质
4.氧化反应
乙醇是一种清洁燃料,在空气中完全燃烧,生成CO2和H2O:
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
①燃烧
醇的化学性质
4.氧化反应
②催化氧化
2H—C—C—H
H O—H
H H
+ O2
Cu/Ag
2H—C—C—H
H O
H
+ 2H2O
H C C O H
H
H
H
H
①
②
③
④
β α
[反应条件]Cu/Ag、△
断裂化学键的位置:②的-OH和③的C-H
[反应实质]断羟基及 α-C上的一个氢
思考与讨论:是否所有的醇都可催化氧化生成醇?
醇的化学性质
4.氧化反应
②催化氧化
α-C上氢原子个数
醇的化学性质
4.氧化反应
②催化氧化
[活动4]:判断以下醇能否发生催化氧化反应,若能,写出反应的
化学方程式。
醇的化学性质
4.氧化反应
③与强氧化剂的反应
C2H5OH
KMnO4(H+)
CH3COOH
酸性高锰酸钾紫红色褪去
还原
橙色
Cr2O72-
Cr3+
绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
K2Cr2O7(H+)
C2H5OH
CH3CHO
CH3COOH
继续氧化
醇的化学性质
4.氧化反应
③与强氧化剂的反应
与醇的催化氧化类似,羟基 碳原子上没有H原子的醇,不能与强氧化剂发生反应。
A.羟基所在碳上有两个氢可氧化生成酸
B.羟基所在碳上有一个氢可氧化生成酮
C.羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
整理与提升
乙醇的化学性质与结构的关系 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 —
取代 反应 卤代反应 乙醇、浓HX
酯化反应 乙醇、羧酸
(自身)成醚 分子间脱水 乙醇
消去反应 乙醇
氧化 反应 催化氧化 乙醇、氧气
强氧化剂氧化 乙醇、KMnO4/H+
燃烧 乙醇、O2 全部 点燃
有来有往为取代,有来无往是加成,有往无来为消去,得氧失氢是氧化,得氢失氧为还原。
①
②
①
一分子断①,
另一分子断②
②⑤
①③
①③
△
浓硫酸,△
浓硫酸,
140 ℃
浓硫酸,
170 ℃
Cu/Ag,△
—
整理与提升
整理与提升
烃
取
代
卤代烃
R-X
水
解
醇
R-OH
氧
化
醛
R'-CHO
氧
化
酸
R'-COOH
不 饱 和 烃
消
去
消
去
酯
加
成
加
成
取代
HX
强氧化剂
整理与提升
1.氧化反应
有机化学中的氧化反应及还原反应
在有机化学反应中,通常把有机化合物分子中失去氢原子或者加入氧原子的反应叫做氧化反应(有机物被氧化)。
2.还原反应
在有机化学反应中,通常把有机化合物分子中加入氢原子或者失去氧原子的反应叫做还原反应(有机物被还原)。
常见的氧化剂有氧气、酸性 KMnO4溶液、臭氧、银氨溶液和
新制氢氧化铜悬浊液等
常见的还原剂有氢气、氢化铝锂(LiAIH4)和硼氢化钠(NaBH4)等
利用氧化反应或还原反应,可以使有机化合物的官能团发生转变,实现醇醛和羧酸等有机化合物之间的相互转化。
赏析实验
