人教版(2019)选择性必修三 3.2.2 酚 (共44张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修三 3.2.2 酚 (共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-18 15:34:42 | ||
图片预览








文档简介
(共44张PPT)
第三章
第二节 醇 酚
0
第2课时 酚
约瑟夫·李斯特
(Joseph Lister , 1827~1912)
浓度很低的某些酚类溶液(与水的比例通常在 1:20 ~1:40),可以用来消毒杀菌。
使苯酚首次声名远扬的应归功于英国著名的医生里斯特。里斯特发现病人手术后死因多数是伤口化脓感染。偶然之下用苯酚稀溶液来喷洒手术的器械以及医生的双手,结果病人的感染情况显著减少。这一发现使苯酚成为一种强有力的外科消毒剂。里斯特也因此被誉为“外科消毒之父”。
是谁使苯酚声名远扬?
科学史话 P66
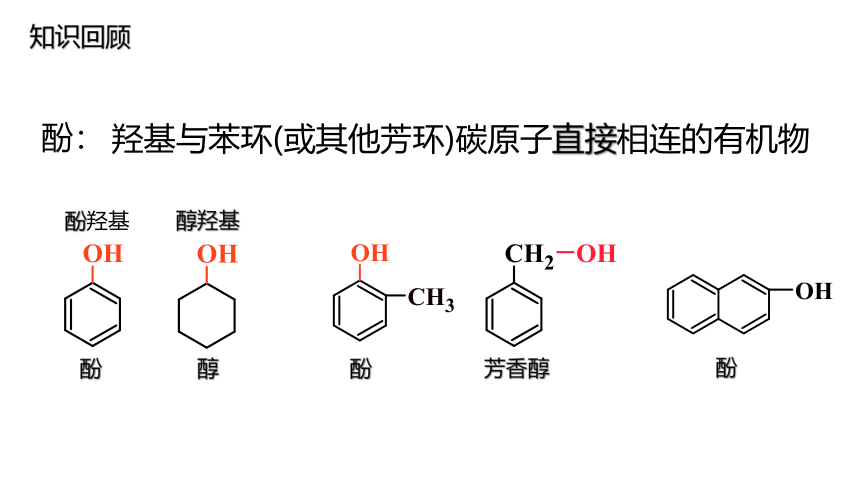
羟基与苯环(或其他芳环)碳原子直接相连的有机物
酚
醇
芳香醇
酚
酚羟基
醇羟基
酚:
酚
知识回顾
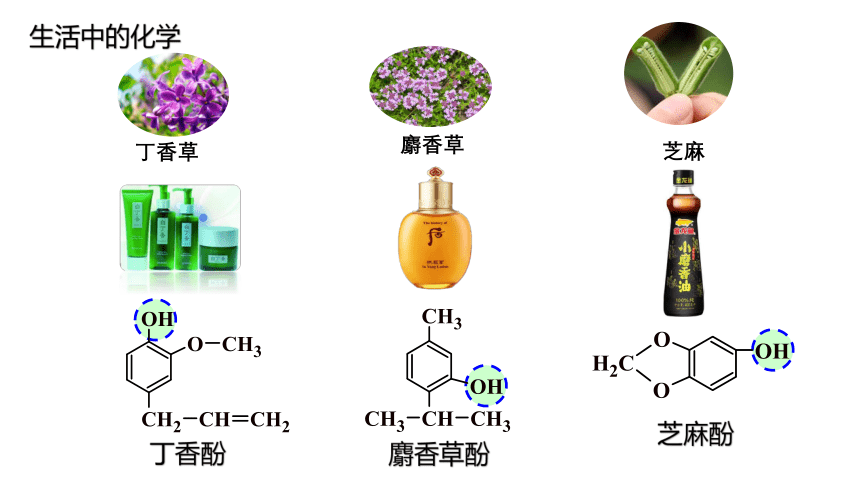
麝香草
丁香草
芝麻
生活中的化学
丁香酚
麝香草酚
芝麻酚
类别 脂肪醇 芳香醇 酚
实例 CH3CH2OH
官能团 —OH —OH —OH
结构 特点 —OH与 —OH与 —OH与
脂肪醇、芳香醇、酚的比较
概念辨析
链烃基相连
芳香烃基侧链相连
苯环直接相连
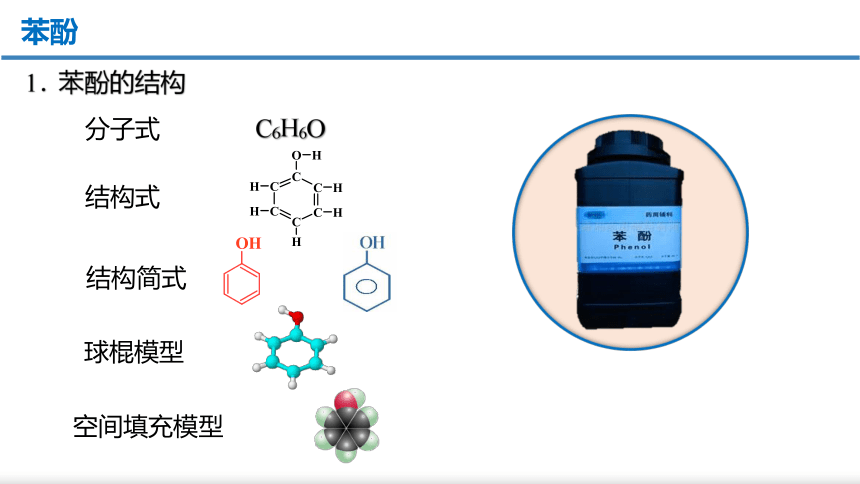
苯酚是一元酚,是最简单的酚类化合物
C6H6O
分子式
结构式
结构简式
球棍模型
空间填充模型
苯酚
1. 苯酚的结构
色态味:
溶解性:
室温下,在水中溶解度是9.2 g,65℃以上时能
跟水互溶;易溶于乙醇等有机溶剂
无色晶体,有特殊的气味
43 ℃
(常用乙醇洗去试管壁上附着的苯酚)
注意:露置在空气中因部分发生氧化而显粉红色
熔点:
苯酚
2. 苯酚的物理性质
毒性:
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心
若沾到皮肤上,应立即用乙醇冲洗,再用水冲洗
(3)常温下苯酚为粉红色晶体( )
(4)实验时手指上不小心沾上苯酚,立即用70 ℃以上的热水清洗( )
根据所学内容,正误判断
CH2OH
OH
(1) 苯酚分子中13个原子一定处于同一平面上( )
(2) 和 是同系物( )
练一练
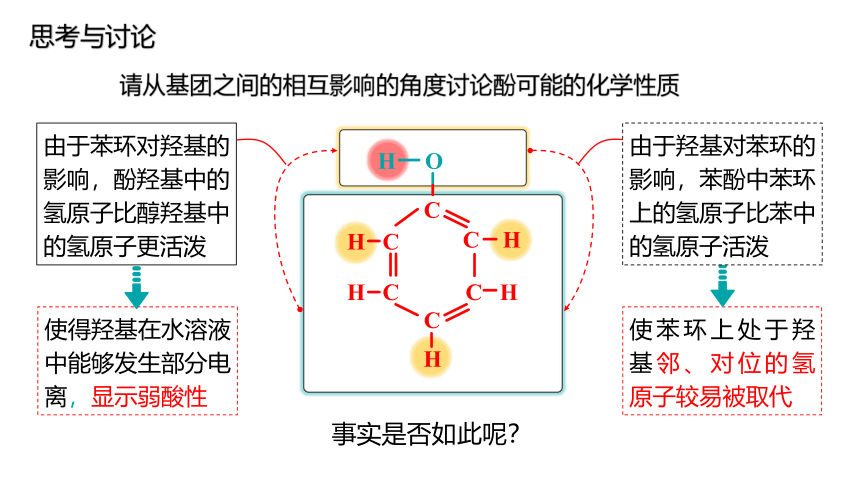
请从基团之间的相互影响的角度讨论酚可能的化学性质
H O
C
C H
H C
C
C H
H C
H
使得羟基在水溶液中能够发生部分电离,显示弱酸性
使苯环上处于羟基邻、对位的氢原子较易被取代
大鹿化学工作室制作,侵权必究
由于苯环对羟基的影响,酚羟基中的氢原子比醇羟基中的氢原子更活泼
由于羟基对苯环的影响,苯酚中苯环上的氢原子比苯中的氢原子活泼
思考与讨论
事实是否如此呢?
实验3-4 P64
实验内容 实验现象
(1)向盛有0.3g苯酚晶体的试管中加入2mL蒸馏水,振荡试管
(2)向试管中逐滴加入5% NaOH溶液并振荡试管
(3)再向试管中加入稀盐酸
实验3-4 P64
实验内容 实验现象 实验结论
(1)向盛有0.3g苯酚晶体的试管中加入2mL蒸馏水,振荡试管
(2)向试管中逐滴加入5% NaOH溶液并振荡试管
(3)再向试管中加入稀盐酸
溶液变澄清
得到悬浊液
溶液变混浊
室温下苯酚在水中的溶解度不大
苯酚呈弱酸性
苯酚的酸性比盐酸弱
(1) 弱酸性
① 部分电离
OH
O-
+ H+
苯酚酸性很弱,不能使石蕊、甲基橙等酸碱指示剂变色。
苯环对羟基有影响
俗称:石炭酸
苯酚
3. 苯酚的化学性质
石炭,实际上就是煤的另一种称呼。
对于苯酚来说,最早在煤焦油中发现,而煤焦油则是煤炭干馏后得到的产物。因此,将苯酚称作carbolic acid,字面意义上是“从煤焦油中发现的酸性物质”,然后再次被译为石碳酸,而苯酚则是根据其结构进行的命名。
③ 与NaOH溶液反应
+H2O
OH
ONa
+NaOH
苯酚钠
苯酚
3. 苯酚的化学性质
② 与Na的反应
2C6H5OH+2Na 2C6H5ONa+H2↑
(1) 弱酸性
④ 苯酚钠与盐酸或碳酸反应生成苯酚
+NaCl
OH
ONa
+ HCl
+NaHCO3
OH
ONa
+ CO2+H2O
向苯酚钠溶液中通入 CO2 气体,不论CO2过量与否,均生成NaHCO3而不生成Na2CO3
苯酚
3. 苯酚的化学性质
酸性:H2CO3 > C6H5OH > HCO3-
(1) 弱酸性
⑤ 苯酚钠与碳酸钠反应
OH
+ Na2CO3
ONa
+
NaHCO3
OH
+ NaHCO3
不反应
(1) 弱酸性
苯酚
3. 苯酚的化学性质
酸性:H2CO3 > C6H5OH > HCO3-
如何除去苯中的苯酚?
利用苯酚的酸性
NaOH溶液
在混合溶液中加入稍过量的NaOH溶液,振荡,静置,分液,取上层液体,即为苯。
学以致用
原理
试剂
操作
【实验3-5】P65
向试管中加入0.1g苯酚和3mL水,振荡,得到苯酚溶液,再向其中逐滴加入饱和溴水,边加边振荡,观察实验现象。
实验现象
有白色沉淀生成
【实验3-5】P65
向试管中加入0.1g苯酚和3mL水,振荡,得到苯酚溶液,再向其中逐滴加入饱和溴水,边加边振荡,观察实验现象。
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
思路:导电性、pH等。
测定反应前后溶液的导电性变化
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
方案一
把一条pH试纸分成三段,置于表面皿中,先分别测定溴水和苯酚溶液的pH,并记录,最后测定反应后溶液的pH
溶液 pH 结论
溴水
苯酚溶液 反应后溶液 6
7
3
溴水与苯酚是
取代反应
用pH试纸测定反应前后溶液的pH
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
方案二
2,4,6-三溴苯酚
三溴苯酚不溶于水,但溶于有机溶剂,本实验成功的关键是浓溴水要足量
实验非常灵敏,常用于苯酚的定性和定量测定
苯酚
3. 苯酚的化学性质
(2) 取代反应
特别提醒
受羟基的影响,苯基上的邻、对位的H变得更活泼
苯、苯酚与Br2反应的比较 类别 苯 苯酚
取代反应 溴的状态 液溴 饱和溴水
条件 催化剂 无催化剂
产物
特点 苯酚与溴的取代反应比苯易进行 原因 酚羟基对苯环的影响使苯环上的邻、对位氢原子变得活泼,易被取代
Br
OH
Br
Br
Br
总结
在苯酚分子中,羟基和苯环相互影响,使苯环在羟基的邻、对位上的氢原子较易被取代
苦味酸,炸药
OH
NO2
NO2
O2N
+ 3H2O
OH
+ 3HNO3
浓硫酸
三硝基苯酚
该反应也称为硝化反应
苯酚
3. 苯酚的化学性质
(2) 取代反应
C
C
C
C
C
C
H
O
H
H
H
H
H
在苯酚分子中,苯基影响了与其相连的羟基,促使其羟基的氢原子比乙醇分子中羟基上的氢原子更易电离
而羟基则反过来影响了与其相连的苯基,使其苯基上邻、对位的氢原子更活泼,更容易被其他原子或原子团所取代
以上事实充分说明有机化合物分子中基团之间存在相互影响、相互制约
思考与讨论 P65
如何检验亚铁盐是否变质了?
知识回顾
向盛有少量苯酚稀溶液的试管中,滴入几滴 FeCl3溶液,振荡,观察实验现象
实验3-6 P66
6C6H5OH+Fe3+ → [Fe(C6H5O)6]3-(显色离子) + 6H+
苯酚
3. 苯酚的化学性质
(3) 显色反应
苯酚与FeCl3溶液作用显紫色,利用此性质也可以检验Fe3+、苯酚的存在。酚类物质一般都可以与FeCl3作用显色,可用于检验其存在。
苯酚
3. 苯酚的化学性质
(4) 加成反应
该反应也称为还原反应
切开的苹果、削了皮的土豆、香蕉放置一段时间后会变棕色,这种现象在化学上被称作“酶促褐变”
什么原因呢?
大鹿化学工作室制作
大鹿化学工作室制作
生活中的化学
植物组织中天然存在一些酚类物质,它们在完整的细胞中作为呼吸传递物质。当被果蔬被碰伤、切割、去皮等操作后,细胞被破坏,邻苯二酚等酚类物质会在氧气条件下,与多酚氧化酶(PPO)反应生成醌类物质,大量的醌类物质再进一步氧化聚合,就形成了褐色色素沉着。
OH
OH
多酚氧化酶(PPO)
O2
O
O
邻苯二酚
1,2苯醌
氧化
聚合
大鹿化学工作室制作
大鹿化学工作室制作
资料卡片
苯酚是无色晶体,但放置时间过长部分苯酚被空气中的氧气氧化往往显粉红色
OH
+ O2
O
O
+ H2O
邻苯醌(红)
O
O
+ H2O
对苯醌(黄)
苯酚
3. 苯酚的化学性质
(5) 氧化反应
苯酚也能使酸性KMnO4褪色
酚醛树脂
相对分子质量小的化合物
聚合成相对分子质量大的高分子,同时生成小分子
H
OH
+ (n-1)H2O
催化剂
苯酚
3. 苯酚的化学性质
(6) 缩聚反应
酚醛树脂俗称“电木”,它不易燃烧,具有良好的电绝缘性能,被广泛用来生产电闸、电灯开关、电话机等电器用品。
酚醛树脂
医药
消毒剂
染料
合成香料
合成纤维
苯酚
苯酚的用途
1 mol最多能与____mol Br2的溴水发生反应
1 mol最多能与_____mol NaOH发生反应
1
1
1
2
课堂练习
官能团
耗H2
耗Br2 ——
耗OH- —— ——
归纳总结
1 mol消耗NaOH为2 mol
C2H5Br
1 mol消耗NaOH为1 mol
特别提醒
第二节 醇 酚
第2课时
酚
代表物质:苯酚
概念与示例
代表物质:苯酚
分子结构
物理性质
化学性质
弱酸性
取代反应
显色反应
氧化反应
课堂小结
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
已知:
1. 上述①~⑤的反应中,属于取代反应的有_____________(填数字序号)。
① ② ③ ⑤
课堂练习
请按要求填空:
2. 工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是___________________________。
保护酚羟基被硝酸氧化
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
课堂练习
第三章
第二节 醇 酚
0
第2课时 酚
约瑟夫·李斯特
(Joseph Lister , 1827~1912)
浓度很低的某些酚类溶液(与水的比例通常在 1:20 ~1:40),可以用来消毒杀菌。
使苯酚首次声名远扬的应归功于英国著名的医生里斯特。里斯特发现病人手术后死因多数是伤口化脓感染。偶然之下用苯酚稀溶液来喷洒手术的器械以及医生的双手,结果病人的感染情况显著减少。这一发现使苯酚成为一种强有力的外科消毒剂。里斯特也因此被誉为“外科消毒之父”。
是谁使苯酚声名远扬?
科学史话 P66
羟基与苯环(或其他芳环)碳原子直接相连的有机物
酚
醇
芳香醇
酚
酚羟基
醇羟基
酚:
酚
知识回顾
麝香草
丁香草
芝麻
生活中的化学
丁香酚
麝香草酚
芝麻酚
类别 脂肪醇 芳香醇 酚
实例 CH3CH2OH
官能团 —OH —OH —OH
结构 特点 —OH与 —OH与 —OH与
脂肪醇、芳香醇、酚的比较
概念辨析
链烃基相连
芳香烃基侧链相连
苯环直接相连
苯酚是一元酚,是最简单的酚类化合物
C6H6O
分子式
结构式
结构简式
球棍模型
空间填充模型
苯酚
1. 苯酚的结构
色态味:
溶解性:
室温下,在水中溶解度是9.2 g,65℃以上时能
跟水互溶;易溶于乙醇等有机溶剂
无色晶体,有特殊的气味
43 ℃
(常用乙醇洗去试管壁上附着的苯酚)
注意:露置在空气中因部分发生氧化而显粉红色
熔点:
苯酚
2. 苯酚的物理性质
毒性:
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心
若沾到皮肤上,应立即用乙醇冲洗,再用水冲洗
(3)常温下苯酚为粉红色晶体( )
(4)实验时手指上不小心沾上苯酚,立即用70 ℃以上的热水清洗( )
根据所学内容,正误判断
CH2OH
OH
(1) 苯酚分子中13个原子一定处于同一平面上( )
(2) 和 是同系物( )
练一练
请从基团之间的相互影响的角度讨论酚可能的化学性质
H O
C
C H
H C
C
C H
H C
H
使得羟基在水溶液中能够发生部分电离,显示弱酸性
使苯环上处于羟基邻、对位的氢原子较易被取代
大鹿化学工作室制作,侵权必究
由于苯环对羟基的影响,酚羟基中的氢原子比醇羟基中的氢原子更活泼
由于羟基对苯环的影响,苯酚中苯环上的氢原子比苯中的氢原子活泼
思考与讨论
事实是否如此呢?
实验3-4 P64
实验内容 实验现象
(1)向盛有0.3g苯酚晶体的试管中加入2mL蒸馏水,振荡试管
(2)向试管中逐滴加入5% NaOH溶液并振荡试管
(3)再向试管中加入稀盐酸
实验3-4 P64
实验内容 实验现象 实验结论
(1)向盛有0.3g苯酚晶体的试管中加入2mL蒸馏水,振荡试管
(2)向试管中逐滴加入5% NaOH溶液并振荡试管
(3)再向试管中加入稀盐酸
溶液变澄清
得到悬浊液
溶液变混浊
室温下苯酚在水中的溶解度不大
苯酚呈弱酸性
苯酚的酸性比盐酸弱
(1) 弱酸性
① 部分电离
OH
O-
+ H+
苯酚酸性很弱,不能使石蕊、甲基橙等酸碱指示剂变色。
苯环对羟基有影响
俗称:石炭酸
苯酚
3. 苯酚的化学性质
石炭,实际上就是煤的另一种称呼。
对于苯酚来说,最早在煤焦油中发现,而煤焦油则是煤炭干馏后得到的产物。因此,将苯酚称作carbolic acid,字面意义上是“从煤焦油中发现的酸性物质”,然后再次被译为石碳酸,而苯酚则是根据其结构进行的命名。
③ 与NaOH溶液反应
+H2O
OH
ONa
+NaOH
苯酚钠
苯酚
3. 苯酚的化学性质
② 与Na的反应
2C6H5OH+2Na 2C6H5ONa+H2↑
(1) 弱酸性
④ 苯酚钠与盐酸或碳酸反应生成苯酚
+NaCl
OH
ONa
+ HCl
+NaHCO3
OH
ONa
+ CO2+H2O
向苯酚钠溶液中通入 CO2 气体,不论CO2过量与否,均生成NaHCO3而不生成Na2CO3
苯酚
3. 苯酚的化学性质
酸性:H2CO3 > C6H5OH > HCO3-
(1) 弱酸性
⑤ 苯酚钠与碳酸钠反应
OH
+ Na2CO3
ONa
+
NaHCO3
OH
+ NaHCO3
不反应
(1) 弱酸性
苯酚
3. 苯酚的化学性质
酸性:H2CO3 > C6H5OH > HCO3-
如何除去苯中的苯酚?
利用苯酚的酸性
NaOH溶液
在混合溶液中加入稍过量的NaOH溶液,振荡,静置,分液,取上层液体,即为苯。
学以致用
原理
试剂
操作
【实验3-5】P65
向试管中加入0.1g苯酚和3mL水,振荡,得到苯酚溶液,再向其中逐滴加入饱和溴水,边加边振荡,观察实验现象。
实验现象
有白色沉淀生成
【实验3-5】P65
向试管中加入0.1g苯酚和3mL水,振荡,得到苯酚溶液,再向其中逐滴加入饱和溴水,边加边振荡,观察实验现象。
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
思路:导电性、pH等。
测定反应前后溶液的导电性变化
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
方案一
把一条pH试纸分成三段,置于表面皿中,先分别测定溴水和苯酚溶液的pH,并记录,最后测定反应后溶液的pH
溶液 pH 结论
溴水
苯酚溶液 反应后溶液 6
7
3
溴水与苯酚是
取代反应
用pH试纸测定反应前后溶液的pH
苯酚与溴水发生取代反应还是加成反应?如何设计实验证明?
观察与思考
方案二
2,4,6-三溴苯酚
三溴苯酚不溶于水,但溶于有机溶剂,本实验成功的关键是浓溴水要足量
实验非常灵敏,常用于苯酚的定性和定量测定
苯酚
3. 苯酚的化学性质
(2) 取代反应
特别提醒
受羟基的影响,苯基上的邻、对位的H变得更活泼
苯、苯酚与Br2反应的比较 类别 苯 苯酚
取代反应 溴的状态 液溴 饱和溴水
条件 催化剂 无催化剂
产物
特点 苯酚与溴的取代反应比苯易进行 原因 酚羟基对苯环的影响使苯环上的邻、对位氢原子变得活泼,易被取代
Br
OH
Br
Br
Br
总结
在苯酚分子中,羟基和苯环相互影响,使苯环在羟基的邻、对位上的氢原子较易被取代
苦味酸,炸药
OH
NO2
NO2
O2N
+ 3H2O
OH
+ 3HNO3
浓硫酸
三硝基苯酚
该反应也称为硝化反应
苯酚
3. 苯酚的化学性质
(2) 取代反应
C
C
C
C
C
C
H
O
H
H
H
H
H
在苯酚分子中,苯基影响了与其相连的羟基,促使其羟基的氢原子比乙醇分子中羟基上的氢原子更易电离
而羟基则反过来影响了与其相连的苯基,使其苯基上邻、对位的氢原子更活泼,更容易被其他原子或原子团所取代
以上事实充分说明有机化合物分子中基团之间存在相互影响、相互制约
思考与讨论 P65
如何检验亚铁盐是否变质了?
知识回顾
向盛有少量苯酚稀溶液的试管中,滴入几滴 FeCl3溶液,振荡,观察实验现象
实验3-6 P66
6C6H5OH+Fe3+ → [Fe(C6H5O)6]3-(显色离子) + 6H+
苯酚
3. 苯酚的化学性质
(3) 显色反应
苯酚与FeCl3溶液作用显紫色,利用此性质也可以检验Fe3+、苯酚的存在。酚类物质一般都可以与FeCl3作用显色,可用于检验其存在。
苯酚
3. 苯酚的化学性质
(4) 加成反应
该反应也称为还原反应
切开的苹果、削了皮的土豆、香蕉放置一段时间后会变棕色,这种现象在化学上被称作“酶促褐变”
什么原因呢?
大鹿化学工作室制作
大鹿化学工作室制作
生活中的化学
植物组织中天然存在一些酚类物质,它们在完整的细胞中作为呼吸传递物质。当被果蔬被碰伤、切割、去皮等操作后,细胞被破坏,邻苯二酚等酚类物质会在氧气条件下,与多酚氧化酶(PPO)反应生成醌类物质,大量的醌类物质再进一步氧化聚合,就形成了褐色色素沉着。
OH
OH
多酚氧化酶(PPO)
O2
O
O
邻苯二酚
1,2苯醌
氧化
聚合
大鹿化学工作室制作
大鹿化学工作室制作
资料卡片
苯酚是无色晶体,但放置时间过长部分苯酚被空气中的氧气氧化往往显粉红色
OH
+ O2
O
O
+ H2O
邻苯醌(红)
O
O
+ H2O
对苯醌(黄)
苯酚
3. 苯酚的化学性质
(5) 氧化反应
苯酚也能使酸性KMnO4褪色
酚醛树脂
相对分子质量小的化合物
聚合成相对分子质量大的高分子,同时生成小分子
H
OH
+ (n-1)H2O
催化剂
苯酚
3. 苯酚的化学性质
(6) 缩聚反应
酚醛树脂俗称“电木”,它不易燃烧,具有良好的电绝缘性能,被广泛用来生产电闸、电灯开关、电话机等电器用品。
酚醛树脂
医药
消毒剂
染料
合成香料
合成纤维
苯酚
苯酚的用途
1 mol最多能与____mol Br2的溴水发生反应
1 mol最多能与_____mol NaOH发生反应
1
1
1
2
课堂练习
官能团
耗H2
耗Br2 ——
耗OH- —— ——
归纳总结
1 mol消耗NaOH为2 mol
C2H5Br
1 mol消耗NaOH为1 mol
特别提醒
第二节 醇 酚
第2课时
酚
代表物质:苯酚
概念与示例
代表物质:苯酚
分子结构
物理性质
化学性质
弱酸性
取代反应
显色反应
氧化反应
课堂小结
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
已知:
1. 上述①~⑤的反应中,属于取代反应的有_____________(填数字序号)。
① ② ③ ⑤
课堂练习
请按要求填空:
2. 工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是___________________________。
保护酚羟基被硝酸氧化
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
课堂练习
