3.3 醛、酮 课件(共60张PPT) 人教版(2019)选择性必修三
文档属性
| 名称 | 3.3 醛、酮 课件(共60张PPT) 人教版(2019)选择性必修三 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 22:33:41 | ||
图片预览








文档简介
(共60张PPT)
《烃的衍生物—醛、酮》
2022级高二·选择性必修3
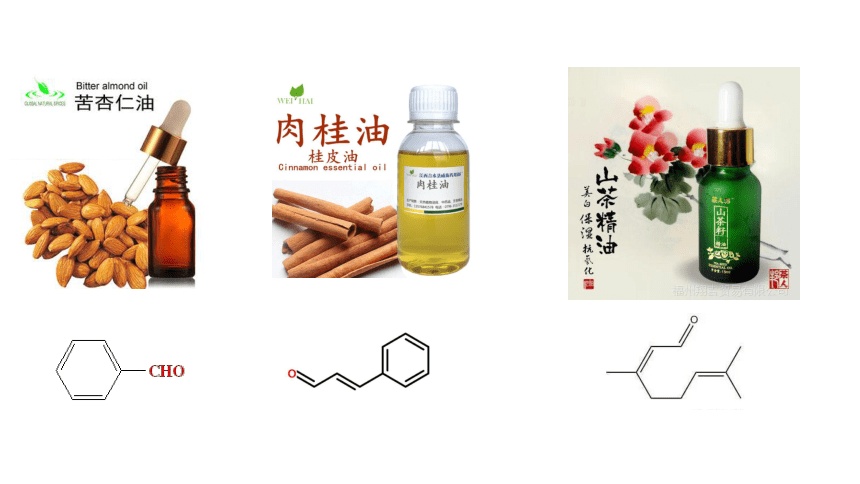
生活中的醛
陈皮中含柠檬醛
醛基与烃基(或氢原子)直接相连的化合物称为醛, 简写为:R—CHO
羰基与2个烃基直接相连的化合物称为酮,简写为:R1COCR2
羰基( C )是一个碳原子和一个氧原子以双键相连形成的一种原子团,
如果羰基的碳原子连着一个氢原子便形成了醛基( )
O
O
C
H
饱和一元醛的通式为:
CnH2nO
醛的概念
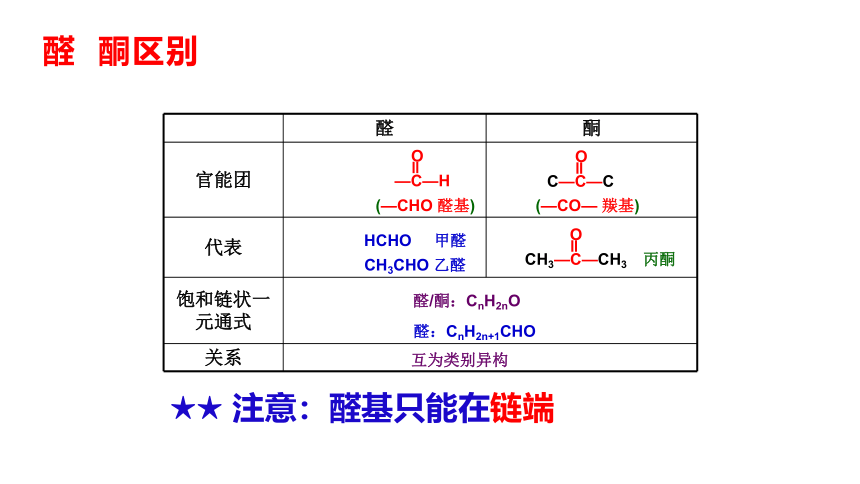
醛 酮区别
醛 酮
官能团
代表
饱和链状一元通式 关系 —C—H
O
(—CHO 醛基)
C—C—C
O
(—CO— 羰基)
HCHO 甲醛
CH3CHO 乙醛
CH3—C—CH3
O
丙酮
醛/酮:CnH2nO
醛:CnH2n+1CHO
互为类别异构
★★ 注意:醛基只能在链端
2、醛的分类:
醛
脂肪醛
芳香醛
一元醛
二元醛
多元醛
饱和醛、不饱和醛
(1)选主链:
选含醛基最长的碳链作为主链,根据主链的碳原子数称“某醛” 。
(2)编号位:
从醛基一端开始,醛基中的碳原子编号为1 。
(3)写名称:
把取代基名称写在母体名称前,用“二、三、四等”写出醛的个数。
醛的命名
(1)、
CH3—CH—CHO
CH3
(2)、
CH3—CH—CH2—CH3
CHO
2-甲基丙醛
2-甲基丁醛
(3)、
4-甲基-2-乙基戊醛
CH3—CH—CH2—CH-CHO
CH3
C2H5
5 4 3 2 1
1
2 3 4
3 2 1
(4)、
CH3—CH—CH2—CH2
CHO
CHO
2-甲基戊二醛
醛的命名
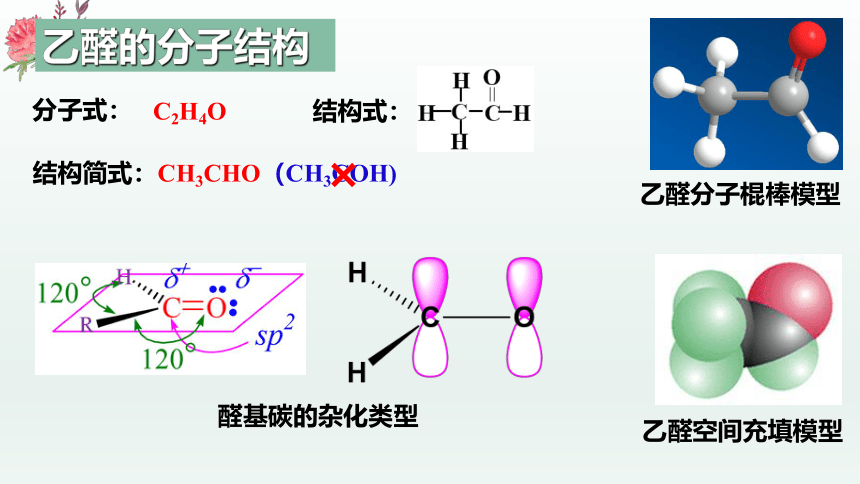
乙醛空间充填模型
乙醛分子棍棒模型
分子式:
结构简式:CH3CHO(CH3COH)
C2H4O
结构式:
醛基碳的杂化类型
乙醛的分子结构
×
乙醛是一种无色,有刺激性气味的液体,密度比水小,沸点20.8℃,易挥发易燃烧,易溶于水(氢键)及乙醇、乙醚、氯仿等有机溶剂。
乙醛的物理性质
【问题】
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
用水,不分层的是乙醛,分层且水在下层的是苯,剩下的是CCl4。
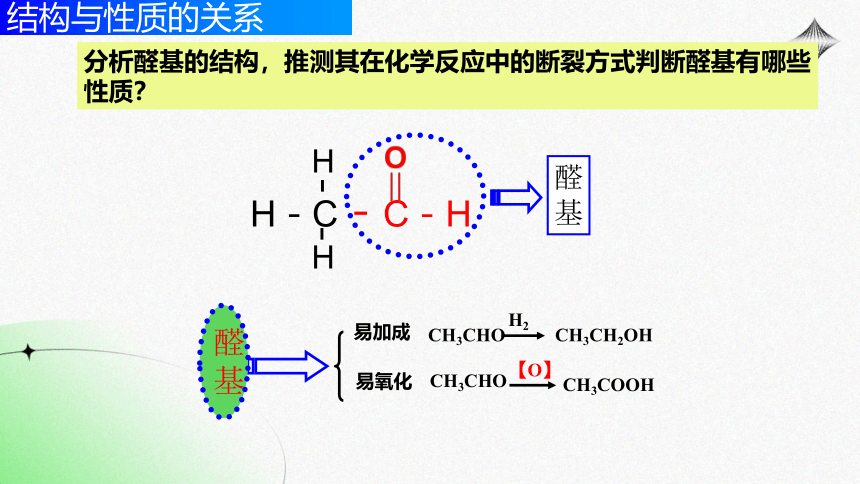
醛基
易加成
醛
基
易氧化
结构与性质的关系
CH3CH2OH
CH3CHO
H2
CH3CHO
CH3COOH
【O】
H-C-C-H
-
H
H
-
分析醛基的结构,推测其在化学反应中的断裂方式判断醛基有哪些性质?
醛的化学通性:
(1)和H2加成被还原成醇
(2)氧化反应
a. 燃烧
b. 催化氧化成羧酸
c. 被弱氧化剂氧化
Ⅰ、银镜反应
Ⅱ、与新制的氢氧化铜反应
d. 使溴水和酸性KMnO4溶液褪色
C
O
H
R
(1)加成反应:
CH3CHO+ H2 CH3CH2OH
Ni
△
有机物得氢或得氧, 发生还原反应
有机物得氧或得氢, 发生氧化反应
注意:与C=C双键不同的是,通常情况下,乙醛不能和HX、X2、H2O发生加成反应
乙醛的化学性质
反应类型:加成反应(还原反应)
反应类型:加成反应
加成反应 — 与HCN加成
乙醛能和一些极性试剂发生加成反应,例如与氢氰酸加成:
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
—C—H
O
2-羟基丙腈
练习1:苯甲醛与HCN加成产物是什么?
练习2:乙醛与HCN加成后所得产物,水解后的产物是什么?
与格式试剂的反应
Mg(OH)Br
完成下列反应
催化氧化
氧化反应
[O]
O
C H
醛基
O
C O H
羧基
问题与交流:
都有哪些氧化剂可以把乙醛氧化为乙酸呢?
乙醇 乙醛 乙酸
氧化
氧化
(醛基的C-H中加O成羧基)
2CH3CHO+O2 2CH3COOH
催化剂
乙酸
(2)氧化反应
(1)与 O2 的反应
(2)氧化反应
①燃烧
②催化氧化
③与强氧化剂反应:乙醛具有还原性
2CH3CHO + 5O2
4CO2 + 4H2O
点燃
2CH3CHO+O2
2CH3COOH
催化剂
△
苯甲醛久置于空气中,在容器内壁会析出晶体,该晶体就是苯甲酸。
(2)与KMnO4(H+)的反应
(3)与溴水的反应
CH3CHO+Br2+H2O=2HBr+CH3COOH
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
5CH3CHO + 2MnO4- + 6H+ = 5CH3COOH + 2Mn2+ + 3H2O
注意:乙醛不能使溴的四氯化碳溶液褪色
(2)氧化反应
实验3-7
在洁净的试管液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
乙醛的化学性质
氧化反应:银镜反应
实验现象 结论
实验
试管内壁生成光亮的银镜
乙醛具有较强的还原性
②与银氨溶液反应的化学方程式“1水、2银、3氨、乙酸铵”
乙醛的化学性质
氧化反应:银镜反应
CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
实验成功的关键环节
①试管内壁必须光滑、洁净;
②实验的银氨溶液应现配现用;氨水不能太浓
③必须用水浴加热,不可用酒精灯直接加热;
④加热时不能振荡和摇动试管。
氧化反应:银镜反应
⑤实验后,银镜用稀HNO3浸泡,再用水洗。
银镜反应有什么用途?
(1)检验醛基,并测定醛基的个数
(-CHO—2Ag)
(2)制镜或水瓶胆(用含醛基的葡萄糖)
在试管里加入2mL 10% NaOH溶液,加入5滴 5%CuSO4,溶液,得到新制的Cu(OH)2,振荡后加入0.5mL乙醛溶液,加热。观察实验现象。
实验3-8
乙醛的化学性质
氧化反应:新制Cu(OH)2悬浊液
CuSO4+ 2NaOH = Cu(OH)2 +Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
砖红色
氧化反应:新制Cu(OH)2悬浊液
1. Cu(OH)2应现用现配
2. NaOH要过量,保证溶液呈碱性
氧化反应:新制Cu(OH)2悬浊液
3. 该反应必须加热煮沸
4. 可用于检验醛基的存在,在医疗上可用于检验尿糖
CH3-C-O-H
CH3CH2OH
氧化反应
氧化反应
还原反应
CH3-C-H
O
O
加氢
去氢
加氧
反应类型 特征(H) 特征(O)
氧化反应
还原反应
去氢
加氧
加氢
去氧
思考:写出甲醛的银镜反应,以及与新制Cu(OH)2反应的化学方程式?
甲醛:俗称蚁醛,是一种无色、有强烈刺激性气味的气体,易溶于水。甲醛的水溶液(又称福尔马林)具有杀菌、防腐性能。
①被银氨溶液氧化
②被新制Cu(OH)2碱性悬浊液氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
水浴加热
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
加热
(1)组成和结构:
分子式:C6H7O
结构简式:
(2)物理性质:
苯甲醛是最简单的芳香醛,俗称苦杏仁油,是一种有苦杏仁气味的无色液体
(3)用途:
杏仁中含有苯甲醛,苯甲醛是制造染料、香料及药物的重要原料。
苯甲醛
结构与性质的关系
H-C-C-H
-
H
H
-
碳负离子
δ+
δ-
δ+
碱
思考:所得碳负离子,与乙醛进一步反应,预测产物?
乙醛的化学性质
羟醛缩合
H2O
常见的碱:
NaOH、KOH、Ba(OH)2、Na2CO3、NaNH2、CH3CH2ONa等
巩固练习
完成下列反应
乙醛的化学性质
羟醛缩合
H2O
常见的碱:
NaOH、KOH、Ba(OH)2、Na2CO3、NaNH2、CH3CH2ONa等
_______ 与 _________相连等化合物叫做酮
羰基
两个烃基
酮结构可表示为:
O
C
R
R
O
C
CH3
CH3
丙酮
最简单的酮
酮
物理性质
无色透明的液体
沸点56.2℃,易挥发
能与水、乙醇等互溶
重要的有机溶剂和化工原料,丙酮可作化学纤维、钢瓶贮存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
用途
丙酮
丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但可催化加氢生成醇
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
丙酮
练习3:乙醛与乙醛加成的产物可能是_________
练习2:丙酮与KC CH加成后水解的产物可能是_________
O
C CH3 +
H3C
KC CH
[H2O]
OH
C CH3
H3C
C CH
H
OH-
H—C
O
C CH3
H
+
α
_
O
C CH3 +
H3C
+
_
O
C CH3
OH
C CH2
H3C
CH3
脱水
O
C CH3
C CH
H3C
CH3
脱水
O
C CH3
C CH2
H2C
CH3
练习4:乙醛与苯甲醛加成的产物可能是_________
肉桂醛
催化氧化
氧化反应
[O]
O
C H
醛基
O
C O H
羧基
问题与交流:
都有哪些氧化剂可以把乙醛氧化为乙酸呢?
乙醇 乙醛 乙酸
氧化
氧化
(醛基的C-H中加O成羧基)
2CH3CHO+O2 2CH3COOH
催化剂
乙酸
①被空气中氧气氧化
(2)氧化反应:
3、乙醛的化学性质
催化氧化:
燃烧 :2C2H4O+5O2 4CO2+4H2O
2CH3CHO+O2 2CH3COOH
催化剂
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
①配制银氨溶液
AgNO3+NH3·H2O = AgOH +NH4NO3
AgOH+2 NH3·H2O = Ag(NH3)2OH+2H2O
氢氧化二氨合银-银氨溶液
现象:先生成白色沉淀,后沉淀恰好溶解。
银镜反应
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
② 水浴加热生成银镜
现象:试管内壁附着一层光亮如镜的金属银
注意条件:水浴加热
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O
银镜
思考:1mol乙醛最多可以与多少Ag(NH3)2OH反应?生成多少Ag?
注意事项
(1)试管内壁必须洁净;
(2)须用新配制的银氨溶液,氨水不能过量.(防止生成易爆物质);
(3)必须水浴加热,且不可振荡和摇动试管;
(4)必须在强碱性溶液中进行
(5)实验后,银镜用稀HNO3浸泡,再用水洗
与银氨溶液的反应
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O
△
巧记方程式:一水,二银,三氨,某酸铵
(2)氧化反应:
3、乙醛的化学性质
②被弱氧化剂氧化
——银镜反应
方程式:
CH3CHO+2Cu(OH)2 + NaOH CH3COONa+Cu2O↓+3H2O
【注意】试剂滴加顺序:
向NaOH溶液中加入几滴CuSO4。
与新制Cu(OH)2反应
现象:
红色沉淀(Cu2O)
条件:
碱过量且加热至沸腾
思考:1mol乙醛最多可以与多少Cu(OH)2反应?生成多少Cu2O?
(2)氧化反应:
3、乙醛的化学性质
②被弱氧化剂氧化
银镜反应和Cu(OH)2反应的共同点?
1、均可用于鉴定-CHO的存在。
2、均在碱性环境中进行。
3、-CHO与Ag(NH3)2OH或 Cu(OH)2均以物质的量比1:2反应。
问题与交流:
乙醛能否使酸性KMnO4溶液或者溴水褪色,是发生了什么反应?
(2)氧化反应:
3、乙醛的化学性质
③被强氧化剂氧化
使酸性高锰酸钾褪色 、
使溴水褪色
均为氧化反应
思考:如何检验CH2=CH-CHO中的醛基?
CH3-C-O-H
CH3CH2OH
氧化反应
氧化反应
还原反应
CH3-C-H
O
O
加氢
去氢
加氧
反应类型 特征(H) 特征(O)
氧化反应
还原反应
去氢
加氧
加氢
去氧
醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、环醇等互为同分异构体
如:C3H6O
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
-OH
【问题1】C4H9—CHO有几种同分异构体?
C4H9— 有4种同分异构体
【问题2】C5H10O含C=O的几种同分异构体有___种,能氧化成酸的有____种
特殊的醛
甲醛:
蚁醛
电子式
结构式
无色有刺激性气味的气体(唯一)
易溶于水 .
35%---40%的甲醛水溶液叫福尔马林
四个原子共面的对称分子,
相当于二元醛
氧化反应:
2HCHO+O2 2HCOOH
最后氧化为
甲酸
碳酸H2CO3
甲醛的银镜反应
HCHO + 4 Ag(NH3)2 OH → 4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O
水浴
1mol甲醛最多可以还原得到4molAg。
甲醛与新制氢氧化铜(菲林试剂)反应
HCHO + 4Cu(OH)2 + 2NaOH → 2Cu2O↓+ Na2CO3 + 6H2O
HCHO+2 Ag(NH3)2OH HCOONH4+2Ag↓+3NH3+H2O
苯甲醛:苦杏仁油
【问题1】苯甲醛在空气种久置出现无色晶体可能是什么?
4、酮
酮
_______与_________相连等化合物叫做酮
羰基
两个烃基
酮结构可表示为:
O
C
R
R
O
C
CH3
CH3
丙酮
最简单的酮
4、酮
丙酮
物理性质
无色透明的液体
沸点56.2℃,易挥发
能与水、乙醇等互溶
重要的有机溶剂和化工原料,丙酮可作化学纤维、钢瓶贮存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
用途
丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但可催化加氢生成醇
化学性质
4、酮
丙酮
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
丙酮是丙醛的同分异构体吗?可采用哪些方法鉴别它们?
可用新制氢氧化铜溶液或银氨溶液来鉴别它们。
思考与讨论
是,二者的分子式都是C3H6O
1、丙烯醛的结构简式为CH2══CHCHO,下列有关其性质的叙述不正确的是( )
A.能使溴水褪色
B.能与过量的氢气充分反应生成丙醛
C.能发生银镜反应
D.能被新制的氢氧化铜悬浊液氧化
B
2、有机物A是合成二氢荆芥内酯的重要原料,其结构简式为
下列检验A中官能团的试剂和顺序正确的是 ( )
A.先加酸性高锰酸钾溶液,后加银氨溶液,微热
B.先加溴水,后加酸性高锰酸钾溶液
C.先加银氨溶液,微热,再加入溴水
D.先加入新制氢氧化铜,微热,酸化后再加溴水
D
3、做乙醛被新制氢氧化铜悬浊液氧化的实验时,下列各步操作中:①加入0.5 mL 乙醛溶液;②加入10%的氢氧化钠溶液2 mL;③加入2%的CuSO4溶液4~6滴;④加热试管。正确的顺序是 。
4、实验室配制少量银氨溶液的方法是:先向试管中加入 ,然后 。其反应的离子方程式为 、
。
5、乙醛 (填“能”或“不能”)使高锰酸钾溶液或溴水褪色。洗涤做过银镜反应的试管,最好选用 试剂。
《烃的衍生物—醛、酮》
2022级高二·选择性必修3
生活中的醛
陈皮中含柠檬醛
醛基与烃基(或氢原子)直接相连的化合物称为醛, 简写为:R—CHO
羰基与2个烃基直接相连的化合物称为酮,简写为:R1COCR2
羰基( C )是一个碳原子和一个氧原子以双键相连形成的一种原子团,
如果羰基的碳原子连着一个氢原子便形成了醛基( )
O
O
C
H
饱和一元醛的通式为:
CnH2nO
醛的概念
醛 酮区别
醛 酮
官能团
代表
饱和链状一元通式 关系 —C—H
O
(—CHO 醛基)
C—C—C
O
(—CO— 羰基)
HCHO 甲醛
CH3CHO 乙醛
CH3—C—CH3
O
丙酮
醛/酮:CnH2nO
醛:CnH2n+1CHO
互为类别异构
★★ 注意:醛基只能在链端
2、醛的分类:
醛
脂肪醛
芳香醛
一元醛
二元醛
多元醛
饱和醛、不饱和醛
(1)选主链:
选含醛基最长的碳链作为主链,根据主链的碳原子数称“某醛” 。
(2)编号位:
从醛基一端开始,醛基中的碳原子编号为1 。
(3)写名称:
把取代基名称写在母体名称前,用“二、三、四等”写出醛的个数。
醛的命名
(1)、
CH3—CH—CHO
CH3
(2)、
CH3—CH—CH2—CH3
CHO
2-甲基丙醛
2-甲基丁醛
(3)、
4-甲基-2-乙基戊醛
CH3—CH—CH2—CH-CHO
CH3
C2H5
5 4 3 2 1
1
2 3 4
3 2 1
(4)、
CH3—CH—CH2—CH2
CHO
CHO
2-甲基戊二醛
醛的命名
乙醛空间充填模型
乙醛分子棍棒模型
分子式:
结构简式:CH3CHO(CH3COH)
C2H4O
结构式:
醛基碳的杂化类型
乙醛的分子结构
×
乙醛是一种无色,有刺激性气味的液体,密度比水小,沸点20.8℃,易挥发易燃烧,易溶于水(氢键)及乙醇、乙醚、氯仿等有机溶剂。
乙醛的物理性质
【问题】
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
用水,不分层的是乙醛,分层且水在下层的是苯,剩下的是CCl4。
醛基
易加成
醛
基
易氧化
结构与性质的关系
CH3CH2OH
CH3CHO
H2
CH3CHO
CH3COOH
【O】
H-C-C-H
-
H
H
-
分析醛基的结构,推测其在化学反应中的断裂方式判断醛基有哪些性质?
醛的化学通性:
(1)和H2加成被还原成醇
(2)氧化反应
a. 燃烧
b. 催化氧化成羧酸
c. 被弱氧化剂氧化
Ⅰ、银镜反应
Ⅱ、与新制的氢氧化铜反应
d. 使溴水和酸性KMnO4溶液褪色
C
O
H
R
(1)加成反应:
CH3CHO+ H2 CH3CH2OH
Ni
△
有机物得氢或得氧, 发生还原反应
有机物得氧或得氢, 发生氧化反应
注意:与C=C双键不同的是,通常情况下,乙醛不能和HX、X2、H2O发生加成反应
乙醛的化学性质
反应类型:加成反应(还原反应)
反应类型:加成反应
加成反应 — 与HCN加成
乙醛能和一些极性试剂发生加成反应,例如与氢氰酸加成:
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
—C—H
O
2-羟基丙腈
练习1:苯甲醛与HCN加成产物是什么?
练习2:乙醛与HCN加成后所得产物,水解后的产物是什么?
与格式试剂的反应
Mg(OH)Br
完成下列反应
催化氧化
氧化反应
[O]
O
C H
醛基
O
C O H
羧基
问题与交流:
都有哪些氧化剂可以把乙醛氧化为乙酸呢?
乙醇 乙醛 乙酸
氧化
氧化
(醛基的C-H中加O成羧基)
2CH3CHO+O2 2CH3COOH
催化剂
乙酸
(2)氧化反应
(1)与 O2 的反应
(2)氧化反应
①燃烧
②催化氧化
③与强氧化剂反应:乙醛具有还原性
2CH3CHO + 5O2
4CO2 + 4H2O
点燃
2CH3CHO+O2
2CH3COOH
催化剂
△
苯甲醛久置于空气中,在容器内壁会析出晶体,该晶体就是苯甲酸。
(2)与KMnO4(H+)的反应
(3)与溴水的反应
CH3CHO+Br2+H2O=2HBr+CH3COOH
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
5CH3CHO + 2MnO4- + 6H+ = 5CH3COOH + 2Mn2+ + 3H2O
注意:乙醛不能使溴的四氯化碳溶液褪色
(2)氧化反应
实验3-7
在洁净的试管液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
乙醛的化学性质
氧化反应:银镜反应
实验现象 结论
实验
试管内壁生成光亮的银镜
乙醛具有较强的还原性
②与银氨溶液反应的化学方程式“1水、2银、3氨、乙酸铵”
乙醛的化学性质
氧化反应:银镜反应
CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
实验成功的关键环节
①试管内壁必须光滑、洁净;
②实验的银氨溶液应现配现用;氨水不能太浓
③必须用水浴加热,不可用酒精灯直接加热;
④加热时不能振荡和摇动试管。
氧化反应:银镜反应
⑤实验后,银镜用稀HNO3浸泡,再用水洗。
银镜反应有什么用途?
(1)检验醛基,并测定醛基的个数
(-CHO—2Ag)
(2)制镜或水瓶胆(用含醛基的葡萄糖)
在试管里加入2mL 10% NaOH溶液,加入5滴 5%CuSO4,溶液,得到新制的Cu(OH)2,振荡后加入0.5mL乙醛溶液,加热。观察实验现象。
实验3-8
乙醛的化学性质
氧化反应:新制Cu(OH)2悬浊液
CuSO4+ 2NaOH = Cu(OH)2 +Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
砖红色
氧化反应:新制Cu(OH)2悬浊液
1. Cu(OH)2应现用现配
2. NaOH要过量,保证溶液呈碱性
氧化反应:新制Cu(OH)2悬浊液
3. 该反应必须加热煮沸
4. 可用于检验醛基的存在,在医疗上可用于检验尿糖
CH3-C-O-H
CH3CH2OH
氧化反应
氧化反应
还原反应
CH3-C-H
O
O
加氢
去氢
加氧
反应类型 特征(H) 特征(O)
氧化反应
还原反应
去氢
加氧
加氢
去氧
思考:写出甲醛的银镜反应,以及与新制Cu(OH)2反应的化学方程式?
甲醛:俗称蚁醛,是一种无色、有强烈刺激性气味的气体,易溶于水。甲醛的水溶液(又称福尔马林)具有杀菌、防腐性能。
①被银氨溶液氧化
②被新制Cu(OH)2碱性悬浊液氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
水浴加热
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
加热
(1)组成和结构:
分子式:C6H7O
结构简式:
(2)物理性质:
苯甲醛是最简单的芳香醛,俗称苦杏仁油,是一种有苦杏仁气味的无色液体
(3)用途:
杏仁中含有苯甲醛,苯甲醛是制造染料、香料及药物的重要原料。
苯甲醛
结构与性质的关系
H-C-C-H
-
H
H
-
碳负离子
δ+
δ-
δ+
碱
思考:所得碳负离子,与乙醛进一步反应,预测产物?
乙醛的化学性质
羟醛缩合
H2O
常见的碱:
NaOH、KOH、Ba(OH)2、Na2CO3、NaNH2、CH3CH2ONa等
巩固练习
完成下列反应
乙醛的化学性质
羟醛缩合
H2O
常见的碱:
NaOH、KOH、Ba(OH)2、Na2CO3、NaNH2、CH3CH2ONa等
_______ 与 _________相连等化合物叫做酮
羰基
两个烃基
酮结构可表示为:
O
C
R
R
O
C
CH3
CH3
丙酮
最简单的酮
酮
物理性质
无色透明的液体
沸点56.2℃,易挥发
能与水、乙醇等互溶
重要的有机溶剂和化工原料,丙酮可作化学纤维、钢瓶贮存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
用途
丙酮
丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但可催化加氢生成醇
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
丙酮
练习3:乙醛与乙醛加成的产物可能是_________
练习2:丙酮与KC CH加成后水解的产物可能是_________
O
C CH3 +
H3C
KC CH
[H2O]
OH
C CH3
H3C
C CH
H
OH-
H—C
O
C CH3
H
+
α
_
O
C CH3 +
H3C
+
_
O
C CH3
OH
C CH2
H3C
CH3
脱水
O
C CH3
C CH
H3C
CH3
脱水
O
C CH3
C CH2
H2C
CH3
练习4:乙醛与苯甲醛加成的产物可能是_________
肉桂醛
催化氧化
氧化反应
[O]
O
C H
醛基
O
C O H
羧基
问题与交流:
都有哪些氧化剂可以把乙醛氧化为乙酸呢?
乙醇 乙醛 乙酸
氧化
氧化
(醛基的C-H中加O成羧基)
2CH3CHO+O2 2CH3COOH
催化剂
乙酸
①被空气中氧气氧化
(2)氧化反应:
3、乙醛的化学性质
催化氧化:
燃烧 :2C2H4O+5O2 4CO2+4H2O
2CH3CHO+O2 2CH3COOH
催化剂
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
①配制银氨溶液
AgNO3+NH3·H2O = AgOH +NH4NO3
AgOH+2 NH3·H2O = Ag(NH3)2OH+2H2O
氢氧化二氨合银-银氨溶液
现象:先生成白色沉淀,后沉淀恰好溶解。
银镜反应
Ag++NH3·H2O=AgOH ↓+ NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
② 水浴加热生成银镜
现象:试管内壁附着一层光亮如镜的金属银
注意条件:水浴加热
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O
银镜
思考:1mol乙醛最多可以与多少Ag(NH3)2OH反应?生成多少Ag?
注意事项
(1)试管内壁必须洁净;
(2)须用新配制的银氨溶液,氨水不能过量.(防止生成易爆物质);
(3)必须水浴加热,且不可振荡和摇动试管;
(4)必须在强碱性溶液中进行
(5)实验后,银镜用稀HNO3浸泡,再用水洗
与银氨溶液的反应
CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O
△
巧记方程式:一水,二银,三氨,某酸铵
(2)氧化反应:
3、乙醛的化学性质
②被弱氧化剂氧化
——银镜反应
方程式:
CH3CHO+2Cu(OH)2 + NaOH CH3COONa+Cu2O↓+3H2O
【注意】试剂滴加顺序:
向NaOH溶液中加入几滴CuSO4。
与新制Cu(OH)2反应
现象:
红色沉淀(Cu2O)
条件:
碱过量且加热至沸腾
思考:1mol乙醛最多可以与多少Cu(OH)2反应?生成多少Cu2O?
(2)氧化反应:
3、乙醛的化学性质
②被弱氧化剂氧化
银镜反应和Cu(OH)2反应的共同点?
1、均可用于鉴定-CHO的存在。
2、均在碱性环境中进行。
3、-CHO与Ag(NH3)2OH或 Cu(OH)2均以物质的量比1:2反应。
问题与交流:
乙醛能否使酸性KMnO4溶液或者溴水褪色,是发生了什么反应?
(2)氧化反应:
3、乙醛的化学性质
③被强氧化剂氧化
使酸性高锰酸钾褪色 、
使溴水褪色
均为氧化反应
思考:如何检验CH2=CH-CHO中的醛基?
CH3-C-O-H
CH3CH2OH
氧化反应
氧化反应
还原反应
CH3-C-H
O
O
加氢
去氢
加氧
反应类型 特征(H) 特征(O)
氧化反应
还原反应
去氢
加氧
加氢
去氧
醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、环醇等互为同分异构体
如:C3H6O
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
-OH
【问题1】C4H9—CHO有几种同分异构体?
C4H9— 有4种同分异构体
【问题2】C5H10O含C=O的几种同分异构体有___种,能氧化成酸的有____种
特殊的醛
甲醛:
蚁醛
电子式
结构式
无色有刺激性气味的气体(唯一)
易溶于水 .
35%---40%的甲醛水溶液叫福尔马林
四个原子共面的对称分子,
相当于二元醛
氧化反应:
2HCHO+O2 2HCOOH
最后氧化为
甲酸
碳酸H2CO3
甲醛的银镜反应
HCHO + 4 Ag(NH3)2 OH → 4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O
水浴
1mol甲醛最多可以还原得到4molAg。
甲醛与新制氢氧化铜(菲林试剂)反应
HCHO + 4Cu(OH)2 + 2NaOH → 2Cu2O↓+ Na2CO3 + 6H2O
HCHO+2 Ag(NH3)2OH HCOONH4+2Ag↓+3NH3+H2O
苯甲醛:苦杏仁油
【问题1】苯甲醛在空气种久置出现无色晶体可能是什么?
4、酮
酮
_______与_________相连等化合物叫做酮
羰基
两个烃基
酮结构可表示为:
O
C
R
R
O
C
CH3
CH3
丙酮
最简单的酮
4、酮
丙酮
物理性质
无色透明的液体
沸点56.2℃,易挥发
能与水、乙醇等互溶
重要的有机溶剂和化工原料,丙酮可作化学纤维、钢瓶贮存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
用途
丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但可催化加氢生成醇
化学性质
4、酮
丙酮
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
丙酮是丙醛的同分异构体吗?可采用哪些方法鉴别它们?
可用新制氢氧化铜溶液或银氨溶液来鉴别它们。
思考与讨论
是,二者的分子式都是C3H6O
1、丙烯醛的结构简式为CH2══CHCHO,下列有关其性质的叙述不正确的是( )
A.能使溴水褪色
B.能与过量的氢气充分反应生成丙醛
C.能发生银镜反应
D.能被新制的氢氧化铜悬浊液氧化
B
2、有机物A是合成二氢荆芥内酯的重要原料,其结构简式为
下列检验A中官能团的试剂和顺序正确的是 ( )
A.先加酸性高锰酸钾溶液,后加银氨溶液,微热
B.先加溴水,后加酸性高锰酸钾溶液
C.先加银氨溶液,微热,再加入溴水
D.先加入新制氢氧化铜,微热,酸化后再加溴水
D
3、做乙醛被新制氢氧化铜悬浊液氧化的实验时,下列各步操作中:①加入0.5 mL 乙醛溶液;②加入10%的氢氧化钠溶液2 mL;③加入2%的CuSO4溶液4~6滴;④加热试管。正确的顺序是 。
4、实验室配制少量银氨溶液的方法是:先向试管中加入 ,然后 。其反应的离子方程式为 、
。
5、乙醛 (填“能”或“不能”)使高锰酸钾溶液或溴水褪色。洗涤做过银镜反应的试管,最好选用 试剂。
