3.3 第三节 醇 课件(共42张PPT) 人教版(2019)选择性必修3
文档属性
| 名称 | 3.3 第三节 醇 课件(共42张PPT) 人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 22:39:38 | ||
图片预览





文档简介
(共42张PPT)
第三章
第三节 醛 酮
0
第1课时
这鸭头怎么这么香呢!
一锅老汤,百味人生;千年卤肉,百年周到
新课引入
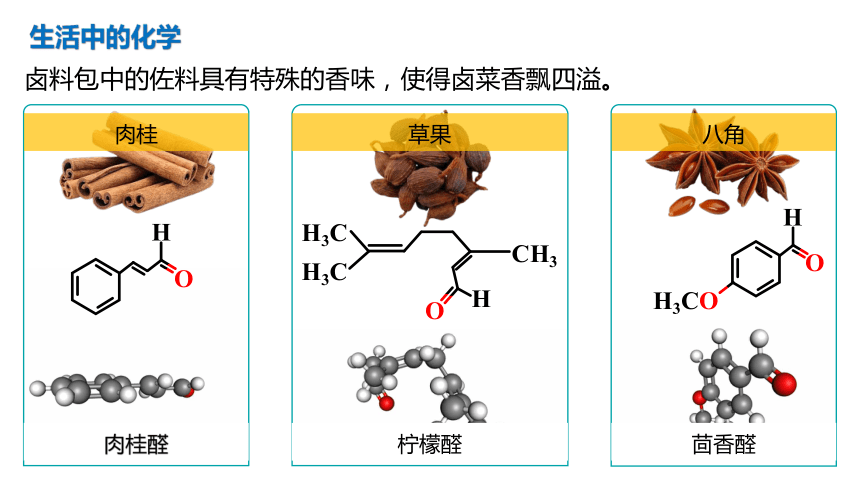
卤料包中的佐料具有特殊的香味,使得卤菜香飘四溢。
O
H
肉桂
肉桂醛
H3C
H3C
CH3
O
H
草果
柠檬醛
H3CO
H
O
八角
茴香醛
生活中的化学
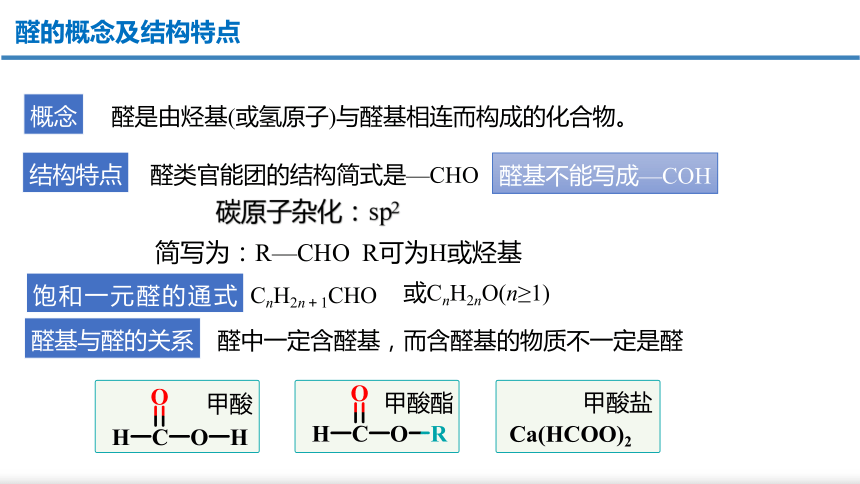
醛的概念及结构特点
饱和一元醛的通式为
结构特点
醛基与醛的关系
醛基不能写成—COH
醛类官能团的结构简式是—CHO
概念
醛是由烃基(或氢原子)与醛基相连而构成的化合物。
或CnH2nO(n≥1)
醛中一定含醛基,而含醛基的物质不一定是醛
H
C
O
O
H
甲酸
H
C
O
O
R
甲酸酯
甲酸盐
Ca(HCOO)2
CnH2n+1CHO
简写为:R—CHO
R可为H或烃基
碳原子杂化:
sp2
一种无色有刺激性气味的液体,密度比水的小,沸点是20.8℃,易挥发,易燃烧,能跟水、乙醇等互溶
乙醛为什么易挥发?为什么能与水,乙醇互溶?
乙醛中的氧原子可与水(乙醇)形成氢键
相似相溶
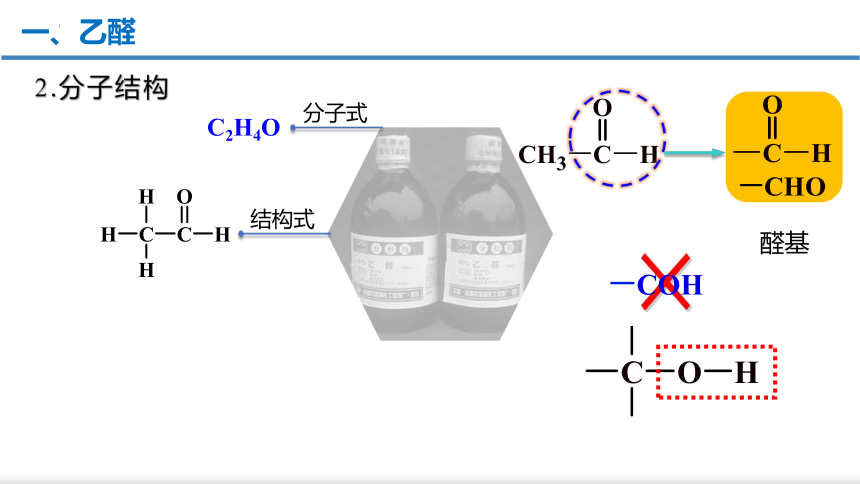
一、乙醛
1.物理性质
分子式
C2H4O
结构式
一、乙醛
2.分子结构
醛基
×
分子式
C2H4O
结构式
官能团
结构简式
CH3CHO
球棍模型
空间填充模型
一、乙醛
2.分子结构
乙醛的核磁共振氢谱
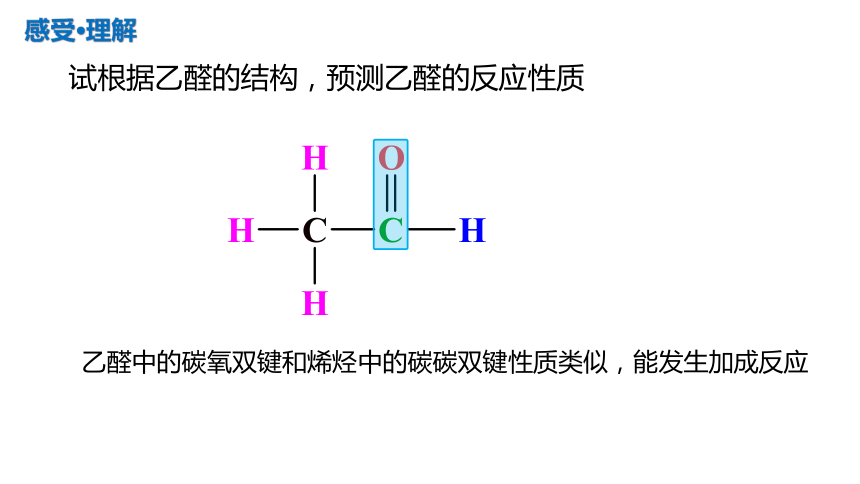
试根据乙醛的结构,预测乙醛的反应性质
感受·理解
乙醛中的碳氧双键和烯烃中的碳碳双键性质类似,能发生加成反应
① 催化加氢
+H2
【注意】
①乙醛不能与X2、HX、H2O进行加成反应
②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
醛的催化加氢反应也是它的还原反应
一、乙醛
3.化学性质
(1) 加成反应
乙醛蒸气和氢气的混合气体通过热的镍催化剂,与氢气发生加成反应
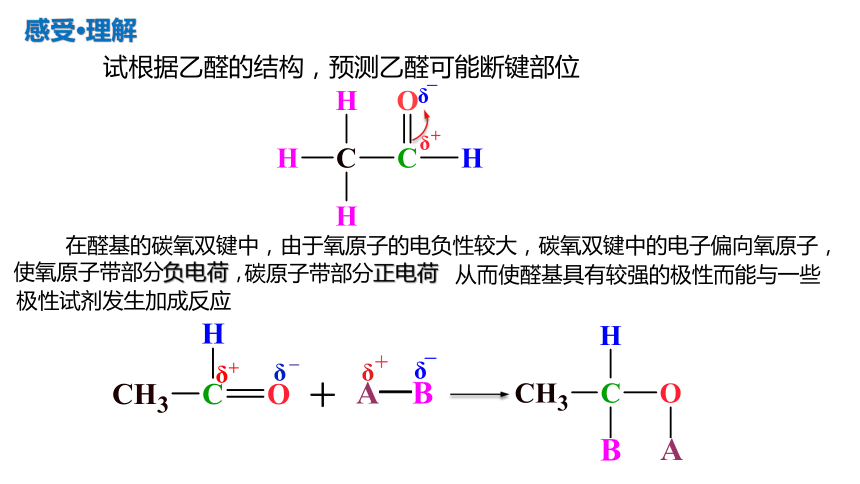
试根据乙醛的结构,预测乙醛可能断键部位
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,
碳原子带部分正电荷
A—B
A
B
从而使醛基具有较强的极性而能与一些极性试剂发生加成反应
感受·理解
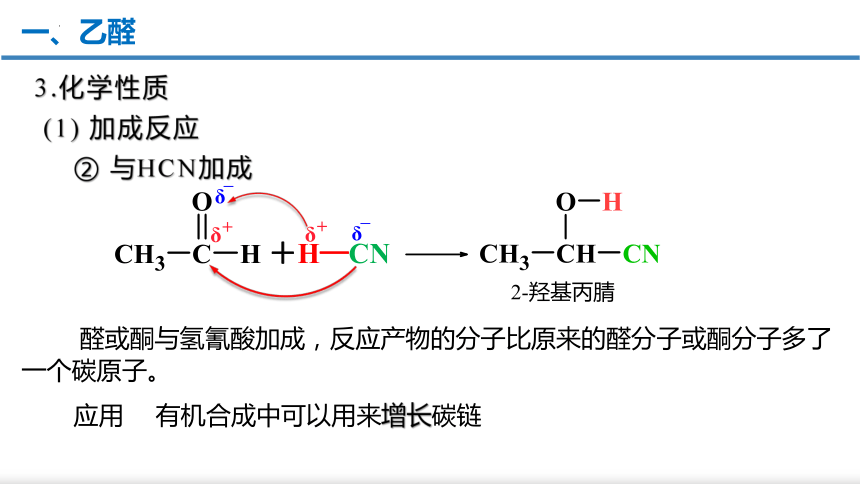
+H—CN
2-羟基丙腈
有机合成中可以用来增长碳链
醛或酮与氢氰酸加成,反应产物的分子比原来的醛分子或酮分子多了一个碳原子。
应用
② 与HCN加成
一、乙醛
3.化学性质
(1) 加成反应
试剂名称 化学式 电荷分布 与乙醛加成的产物
氢氰酸
氨及氨的衍生物 (以胺为例)
醇类 (以甲醇为例)
A(δ+) B(δ-)
H CN
δ+
δ-
HCN
RNH2
CH3OH
H NHR
δ+
δ-
H OCH3
δ+
δ-
CH3
C
O
H
H
CN
CH3
C
O
H
H
NHR
CH3
C
O
H
H
OCH3
拓展延伸
格利雅试剂—格氏试剂
以后又合成了各种格利雅试剂,广泛用于有机合成,现在仍是有机化学工业中的重要试剂
格利雅
1901年法国格利雅发现在无水乙醚中碘代甲烷很容易与金属镁起反应,生成可溶性有机金属卤化物,即格利雅试剂。
格利雅因发现格利雅试剂而与P.萨巴蒂埃分获1912年诺贝尔化学奖。
科学视野
RX+Mg→RMgX
乙醚
H2O/H+
H
③ 与格氏试剂加成
一、乙醛
3.化学性质
(1) 加成反应
信息反应
请根据以上信息及所学知识,以丙烯为主要原料合成:
挑战自我
已知:
方法:逆推思维
羟醛缩合反应
醛分子中在醛基邻位碳原子上的氢原子(α-H) 受羰基>C=O吸电子作用的影响,α-H的活性增强。
分子内含有α-H的醛在碱性条件下,一个醛分子的α-H与另一醛分子的羰基>C=O进行加成,生成β-羟基醛, 该产物易失水,得到α,β-不饱和醛,这类反应被称为羟醛缩合反应。
有机合成中用于增长碳链
知识拓展
桂皮含肉桂醛
具有抑菌防霉、扩张血管降血压等特性,广泛用于医药、牙膏、洗涤剂、糖果和调味品中。用于口香糖对口腔可起到杀菌和除臭双重功效。
工业上可通过苯甲醛与乙醛反应进行制备:
上述反应主要经历了加成和消去的过程,请尝试写出相应反应的化学方程式。
挑战自我(P72第九题)
乙醛分子中醛基中的C—H为何易断裂?
受碳氧双键影响,
C-H键极性增强
C-H易断裂被氧化成羧酸
氧化反应
感受·理解
实验现象
实验探究:乙醛与银氨溶液反应
向A中滴加氨水,现象为先产生白色沉淀后变澄清,加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜
实验分析:乙醛与银氨溶液反应
加氧
还原剂
实验分析:乙醛与银氨溶液反应
还原剂
被氧化
发生氧化反应
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
Δ
氧化剂
一水
二银
三氨
一、乙醛
3.化学性质
(2) 氧化反应
① 与弱氧化剂—新制银氨溶液反应
银镜反应
此反应可检验醛基的存在并测定醛基的个数
-CHO~2Ag
应用:工业上用来制瓶胆和镜子
乙醛与银氨溶液反应实验注意事项
1.试管内壁应洁净
5.碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵
6.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质
4.配制银氨溶液时,氨水不能过多或过少只能加到AgOH沉淀刚好消失
3.加热时不能振荡试管和摇动试管
2.必须用水浴加热,不能用酒精灯加热
(久置的银氨溶液会生成易爆炸的叠氮化银AgN3)
7.实验后,银镜用稀HNO3浸泡除去,最后再水洗
查阅资料可知:
新配制的氢氧化铜[Cu(OH)2]溶液
CH2OH(CHOH)4CHO
斐林试剂:
葡萄糖结构式:
思考:乙醛能否与新制Cu(OH)2溶液反应呢?
实验探究:乙醛与新制氢氧化铜的反应
A中溶液出现蓝色絮状沉淀,滴入乙醛,加热至沸腾后,C中溶液有砖红色沉淀产生
A
C
实验现象
一、乙醛
3.化学性质
(2) 氧化反应
① 与弱氧化剂—新制Cu(OH)2反应
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
CH3COOH+NaOH CH3COONa+H2O
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
Cu(OH)2现配现用且碱过量
(砖红色沉淀)
此反应可检验醛基并测定醛基的个数
-CHO ~ Cu2O
用途:
医学上检验病人是否患糖尿病
特别注意:
醛基与新制银氨溶液或新制Cu(OH)2的反应均必须在碱性条件下进行
一、乙醛
(2) 氧化反应
② 与强氧化剂反应
3.化学性质
能使溴水和酸性KMnO4溶液、酸性K2Cr2O7溶液溶液褪色,本身被氧化成羧酸
CH3CHO+Br2+H2O→CH3COOH +2HBr
请设计实验证明,乙醛与溴水的反应是氧化反应,而不是加成反应
思考:
测反应后溶液的pH
测反应前后溶液的导电性
一、乙醛
(2) 氧化反应
③ 催化氧化
3.化学性质
乙醛在一定温度和催化剂作用下,能被氧气氧化为乙酸
2CH3CHO + O2 2CH3COOH
催化剂
△
④可燃性
2CH3CHO+5O2 4CO2+4H2O
点燃
醛基的性质
醛基中碳氧双键发生加成反应,被H2还原为醇
醛基中碳氢键较活泼,能被氧化成相应羧酸或盐
碳氧键
氧化性
碳氢键
还原性
还原
氧化
醛类物质既有氧化性又有还原性
知识总结:
——坎尼扎罗反应(歧化反应)
Cannizzaro反应
无α-氢原子的醛与强碱共热时,则其一个分子作为氢的供体,另一个分子作为氢的受体,前者被氧化,后者被还原,发生了分子间的氧化还原反应生成等量的酸和醇的有机歧化反应。
O
H
H
HO-
O
H
O-
OH
H
O
H
O
OH
O
H
2
NaOH
COONa
CH2OH
知识拓展:
HCOONa
已知:Cl2+2NaOH=NaCl+NaClO+H2O。
醛既有氧化性又有还原性,请写出甲醛在NaOH溶液中发生歧化反应的方程式。
2HCHO+NaOH→
发生氧化反应
+
发生还原反应
CH3OH
挑战自我
乙醛
CH3CHO
加成反应
氧化反应
还原反应
课堂小结
(注:“√”代表能褪色,“×”代表不能褪色)
判断哪些官能团能使溴水、酸性KMnO4溶液褪色
官能团 试剂 碳碳双键 碳碳三键 苯的同系物 醇 酚 醛
溴水
酸性KMnO4溶液
课堂练习
1 . 丙醛与新制氢氧化铜反应
写出下列反应的化学方程式:
CH3CH2CHO+2Cu(OH)2+NaOH
Cu2O+CH3CH2COONa+3H2O
2 . 乙二醛与足量银氨溶液
OHCCHO+4Ag(NH3)2OH
H4NOOCCOONH4+4Ag+6NH3+2H2O
课堂练习
请设计实验,检验以下有机物中含有碳碳双键。
因为-CHO也能使溴水和高锰酸钾酸性溶液褪色,所以为防止-CHO的干扰应该先用弱氧化剂将-CHO氧化再检验碳碳双键。
先加足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化,然后再用酸性KMnO4溶液(或溴水)检验碳碳双键。
课堂练习
请写出两分子乙醛在碱性条件下发生羟醛缩合反应的化学方程式。
课堂练习
下列有机物A,是由B、C两种物质通过上述类型的反应生成的。试根据A的结构简式写出B、C的结构简式。
A:(CH3)2C(OH)CH2CHO
B_______________ C_____________
已知:
课堂练习
请运用已学过的知识和下述的信息,画出由乙烯制正丁醇的路线图。
已知两个醛分子在一定条件下可以自身加成。
课堂练习
课堂练习
第三章
第三节 醛 酮
0
第1课时
这鸭头怎么这么香呢!
一锅老汤,百味人生;千年卤肉,百年周到
新课引入
卤料包中的佐料具有特殊的香味,使得卤菜香飘四溢。
O
H
肉桂
肉桂醛
H3C
H3C
CH3
O
H
草果
柠檬醛
H3CO
H
O
八角
茴香醛
生活中的化学
醛的概念及结构特点
饱和一元醛的通式为
结构特点
醛基与醛的关系
醛基不能写成—COH
醛类官能团的结构简式是—CHO
概念
醛是由烃基(或氢原子)与醛基相连而构成的化合物。
或CnH2nO(n≥1)
醛中一定含醛基,而含醛基的物质不一定是醛
H
C
O
O
H
甲酸
H
C
O
O
R
甲酸酯
甲酸盐
Ca(HCOO)2
CnH2n+1CHO
简写为:R—CHO
R可为H或烃基
碳原子杂化:
sp2
一种无色有刺激性气味的液体,密度比水的小,沸点是20.8℃,易挥发,易燃烧,能跟水、乙醇等互溶
乙醛为什么易挥发?为什么能与水,乙醇互溶?
乙醛中的氧原子可与水(乙醇)形成氢键
相似相溶
一、乙醛
1.物理性质
分子式
C2H4O
结构式
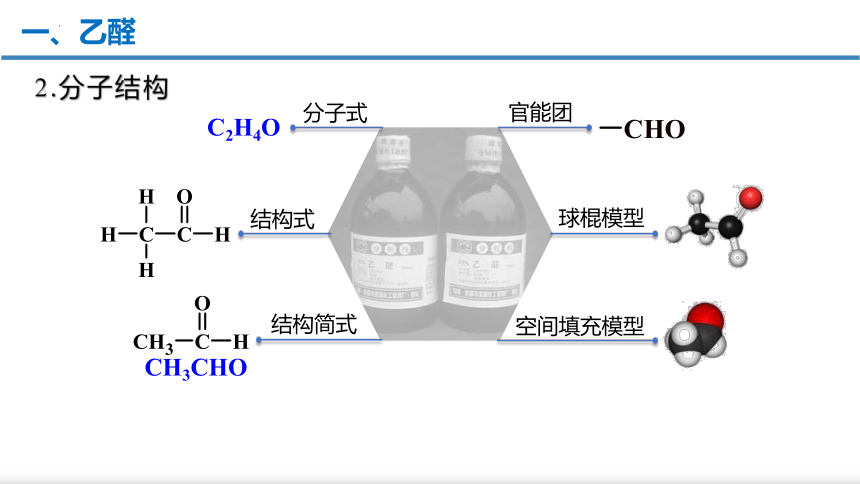
一、乙醛
2.分子结构
醛基
×
分子式
C2H4O
结构式
官能团
结构简式
CH3CHO
球棍模型
空间填充模型
一、乙醛
2.分子结构
乙醛的核磁共振氢谱
试根据乙醛的结构,预测乙醛的反应性质
感受·理解
乙醛中的碳氧双键和烯烃中的碳碳双键性质类似,能发生加成反应
① 催化加氢
+H2
【注意】
①乙醛不能与X2、HX、H2O进行加成反应
②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
醛的催化加氢反应也是它的还原反应
一、乙醛
3.化学性质
(1) 加成反应
乙醛蒸气和氢气的混合气体通过热的镍催化剂,与氢气发生加成反应
试根据乙醛的结构,预测乙醛可能断键部位
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,
碳原子带部分正电荷
A—B
A
B
从而使醛基具有较强的极性而能与一些极性试剂发生加成反应
感受·理解
+H—CN
2-羟基丙腈
有机合成中可以用来增长碳链
醛或酮与氢氰酸加成,反应产物的分子比原来的醛分子或酮分子多了一个碳原子。
应用
② 与HCN加成
一、乙醛
3.化学性质
(1) 加成反应
试剂名称 化学式 电荷分布 与乙醛加成的产物
氢氰酸
氨及氨的衍生物 (以胺为例)
醇类 (以甲醇为例)
A(δ+) B(δ-)
H CN
δ+
δ-
HCN
RNH2
CH3OH
H NHR
δ+
δ-
H OCH3
δ+
δ-
CH3
C
O
H
H
CN
CH3
C
O
H
H
NHR
CH3
C
O
H
H
OCH3
拓展延伸
格利雅试剂—格氏试剂
以后又合成了各种格利雅试剂,广泛用于有机合成,现在仍是有机化学工业中的重要试剂
格利雅
1901年法国格利雅发现在无水乙醚中碘代甲烷很容易与金属镁起反应,生成可溶性有机金属卤化物,即格利雅试剂。
格利雅因发现格利雅试剂而与P.萨巴蒂埃分获1912年诺贝尔化学奖。
科学视野
RX+Mg→RMgX
乙醚
H2O/H+
H
③ 与格氏试剂加成
一、乙醛
3.化学性质
(1) 加成反应
信息反应
请根据以上信息及所学知识,以丙烯为主要原料合成:
挑战自我
已知:
方法:逆推思维
羟醛缩合反应
醛分子中在醛基邻位碳原子上的氢原子(α-H) 受羰基>C=O吸电子作用的影响,α-H的活性增强。
分子内含有α-H的醛在碱性条件下,一个醛分子的α-H与另一醛分子的羰基>C=O进行加成,生成β-羟基醛, 该产物易失水,得到α,β-不饱和醛,这类反应被称为羟醛缩合反应。
有机合成中用于增长碳链
知识拓展
桂皮含肉桂醛
具有抑菌防霉、扩张血管降血压等特性,广泛用于医药、牙膏、洗涤剂、糖果和调味品中。用于口香糖对口腔可起到杀菌和除臭双重功效。
工业上可通过苯甲醛与乙醛反应进行制备:
上述反应主要经历了加成和消去的过程,请尝试写出相应反应的化学方程式。
挑战自我(P72第九题)
乙醛分子中醛基中的C—H为何易断裂?
受碳氧双键影响,
C-H键极性增强
C-H易断裂被氧化成羧酸
氧化反应
感受·理解
实验现象
实验探究:乙醛与银氨溶液反应
向A中滴加氨水,现象为先产生白色沉淀后变澄清,加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜
实验分析:乙醛与银氨溶液反应
加氧
还原剂
实验分析:乙醛与银氨溶液反应
还原剂
被氧化
发生氧化反应
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
Δ
氧化剂
一水
二银
三氨
一、乙醛
3.化学性质
(2) 氧化反应
① 与弱氧化剂—新制银氨溶液反应
银镜反应
此反应可检验醛基的存在并测定醛基的个数
-CHO~2Ag
应用:工业上用来制瓶胆和镜子
乙醛与银氨溶液反应实验注意事项
1.试管内壁应洁净
5.碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵
6.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质
4.配制银氨溶液时,氨水不能过多或过少只能加到AgOH沉淀刚好消失
3.加热时不能振荡试管和摇动试管
2.必须用水浴加热,不能用酒精灯加热
(久置的银氨溶液会生成易爆炸的叠氮化银AgN3)
7.实验后,银镜用稀HNO3浸泡除去,最后再水洗
查阅资料可知:
新配制的氢氧化铜[Cu(OH)2]溶液
CH2OH(CHOH)4CHO
斐林试剂:
葡萄糖结构式:
思考:乙醛能否与新制Cu(OH)2溶液反应呢?
实验探究:乙醛与新制氢氧化铜的反应
A中溶液出现蓝色絮状沉淀,滴入乙醛,加热至沸腾后,C中溶液有砖红色沉淀产生
A
C
实验现象
一、乙醛
3.化学性质
(2) 氧化反应
① 与弱氧化剂—新制Cu(OH)2反应
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
CH3COOH+NaOH CH3COONa+H2O
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
Cu(OH)2现配现用且碱过量
(砖红色沉淀)
此反应可检验醛基并测定醛基的个数
-CHO ~ Cu2O
用途:
医学上检验病人是否患糖尿病
特别注意:
醛基与新制银氨溶液或新制Cu(OH)2的反应均必须在碱性条件下进行
一、乙醛
(2) 氧化反应
② 与强氧化剂反应
3.化学性质
能使溴水和酸性KMnO4溶液、酸性K2Cr2O7溶液溶液褪色,本身被氧化成羧酸
CH3CHO+Br2+H2O→CH3COOH +2HBr
请设计实验证明,乙醛与溴水的反应是氧化反应,而不是加成反应
思考:
测反应后溶液的pH
测反应前后溶液的导电性
一、乙醛
(2) 氧化反应
③ 催化氧化
3.化学性质
乙醛在一定温度和催化剂作用下,能被氧气氧化为乙酸
2CH3CHO + O2 2CH3COOH
催化剂
△
④可燃性
2CH3CHO+5O2 4CO2+4H2O
点燃
醛基的性质
醛基中碳氧双键发生加成反应,被H2还原为醇
醛基中碳氢键较活泼,能被氧化成相应羧酸或盐
碳氧键
氧化性
碳氢键
还原性
还原
氧化
醛类物质既有氧化性又有还原性
知识总结:
——坎尼扎罗反应(歧化反应)
Cannizzaro反应
无α-氢原子的醛与强碱共热时,则其一个分子作为氢的供体,另一个分子作为氢的受体,前者被氧化,后者被还原,发生了分子间的氧化还原反应生成等量的酸和醇的有机歧化反应。
O
H
H
HO-
O
H
O-
OH
H
O
H
O
OH
O
H
2
NaOH
COONa
CH2OH
知识拓展:
HCOONa
已知:Cl2+2NaOH=NaCl+NaClO+H2O。
醛既有氧化性又有还原性,请写出甲醛在NaOH溶液中发生歧化反应的方程式。
2HCHO+NaOH→
发生氧化反应
+
发生还原反应
CH3OH
挑战自我
乙醛
CH3CHO
加成反应
氧化反应
还原反应
课堂小结
(注:“√”代表能褪色,“×”代表不能褪色)
判断哪些官能团能使溴水、酸性KMnO4溶液褪色
官能团 试剂 碳碳双键 碳碳三键 苯的同系物 醇 酚 醛
溴水
酸性KMnO4溶液
课堂练习
1 . 丙醛与新制氢氧化铜反应
写出下列反应的化学方程式:
CH3CH2CHO+2Cu(OH)2+NaOH
Cu2O+CH3CH2COONa+3H2O
2 . 乙二醛与足量银氨溶液
OHCCHO+4Ag(NH3)2OH
H4NOOCCOONH4+4Ag+6NH3+2H2O
课堂练习
请设计实验,检验以下有机物中含有碳碳双键。
因为-CHO也能使溴水和高锰酸钾酸性溶液褪色,所以为防止-CHO的干扰应该先用弱氧化剂将-CHO氧化再检验碳碳双键。
先加足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化,然后再用酸性KMnO4溶液(或溴水)检验碳碳双键。
课堂练习
请写出两分子乙醛在碱性条件下发生羟醛缩合反应的化学方程式。
课堂练习
下列有机物A,是由B、C两种物质通过上述类型的反应生成的。试根据A的结构简式写出B、C的结构简式。
A:(CH3)2C(OH)CH2CHO
B_______________ C_____________
已知:
课堂练习
请运用已学过的知识和下述的信息,画出由乙烯制正丁醇的路线图。
已知两个醛分子在一定条件下可以自身加成。
课堂练习
课堂练习
