3.2.2 酸碱中和滴定 课件(共39张ppt)高中化学人教版(2019)选择性必修一
文档属性
| 名称 | 3.2.2 酸碱中和滴定 课件(共39张ppt)高中化学人教版(2019)选择性必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 126.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-15 22:26:34 | ||
图片预览




文档简介
(共39张PPT)
时间,点点滴滴,滴定着我们的人生终点
第2课时 酸碱中和滴定
用什么方法可以比较精确地测得一瓶未知浓度NaOH溶液的浓度?
①中和反应的实质是什么?
思考
H++OH-=H2O
②当酸碱刚好完全反应时,酸和碱的物质的量的关系
是怎样的?
酸与碱的元数相同时:
C酸V酸=C碱V碱
nH+= nOH-
可以用已知浓度的酸(或碱)来测定出未知浓度的碱(或酸)的浓度
酸碱中和滴定
aC酸V酸=bC碱V碱
a元酸与b元碱反应时:
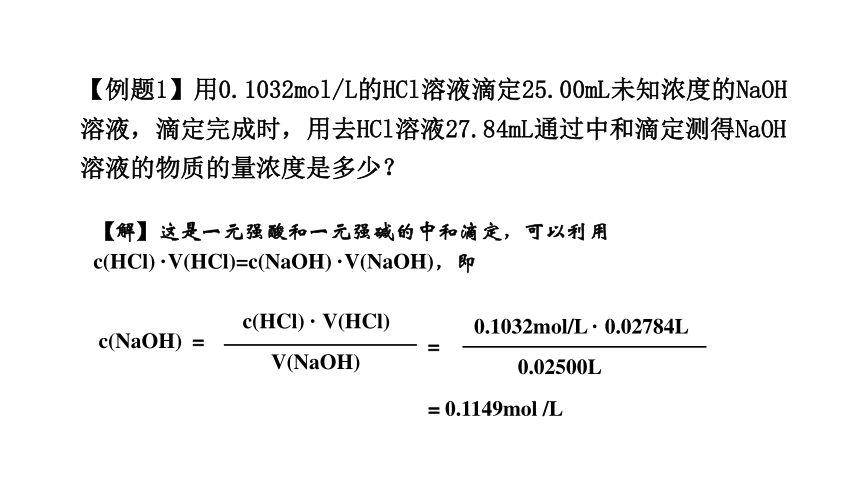
【例题1】用0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL通过中和滴定测得NaOH溶液的物质的量浓度是多少?
【解】这是一元强酸和一元强碱的中和滴定,可以利用
c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),即
c(HCl) · V(HCl)
V(NaOH)
c(NaOH) =
0.1032mol/L · 0.02784L
0.02500L
=
=0.1149mol /L
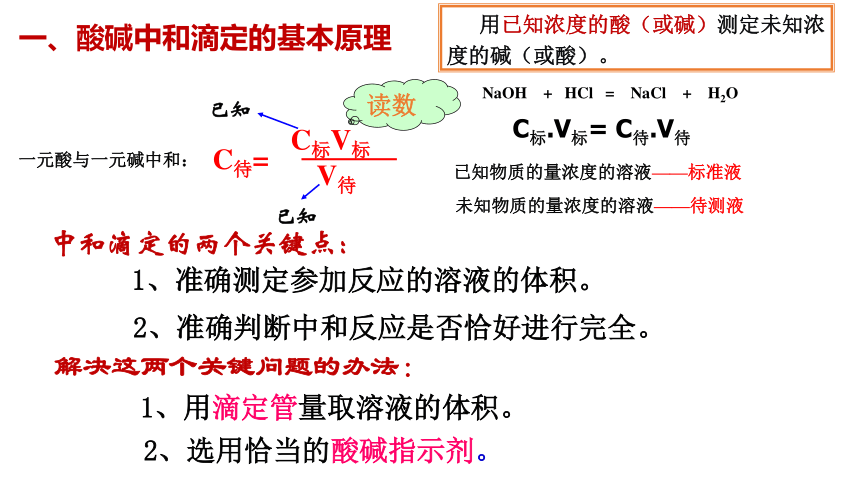
用已知浓度的酸(或碱)测定未知浓度的碱(或酸)。
中和滴定的两个关键点:
1、准确测定参加反应的溶液的体积。
2、准确判断中和反应是否恰好进行完全。
解决这两个关键问题的办法:
1、用滴定管量取溶液的体积。
2、选用恰当的酸碱指示剂。
C待=
C标V标
V待
已知
已知
读数
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待
一、酸碱中和滴定的基本原理
已知物质的量浓度的溶液——标准液
未知物质的量浓度的溶液——待测液
一元酸与一元碱中和:
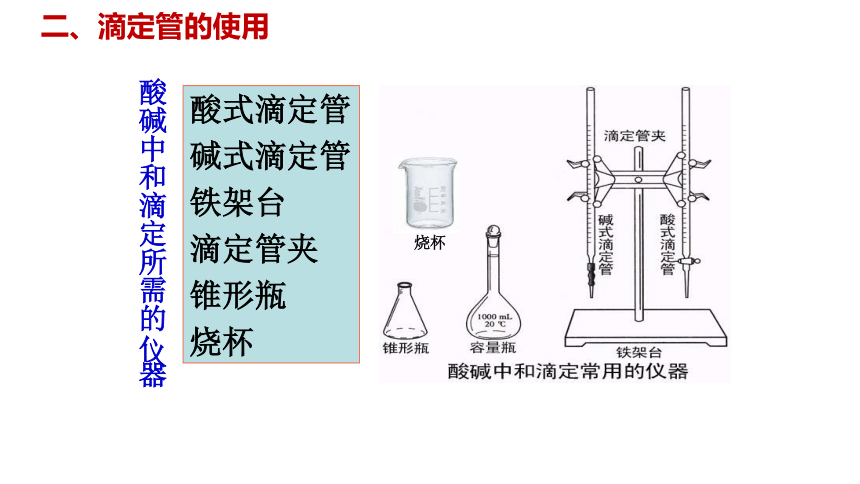
酸碱中和滴定所需的仪器
酸式滴定管
碱式滴定管
铁架台
滴定管夹
锥形瓶
烧杯
烧杯
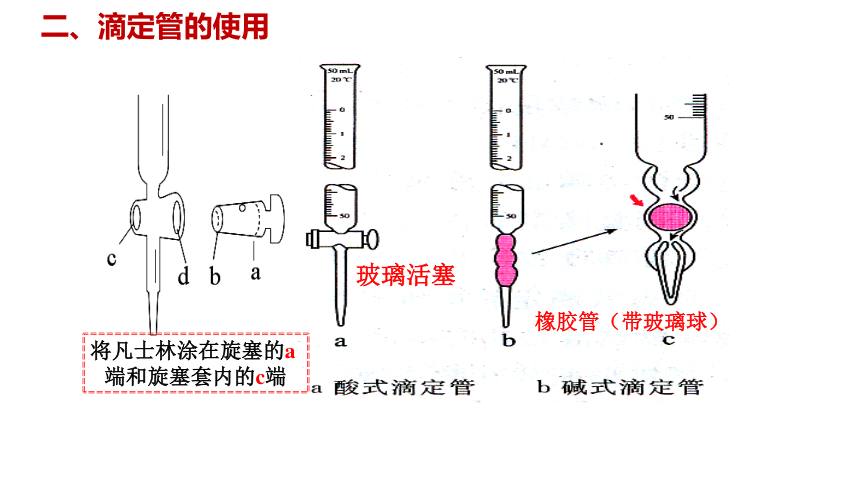
二、滴定管的使用
将凡士林涂在旋塞的a端和旋塞套内的c端
玻璃活塞
橡胶管(带玻璃球)
二、滴定管的使用
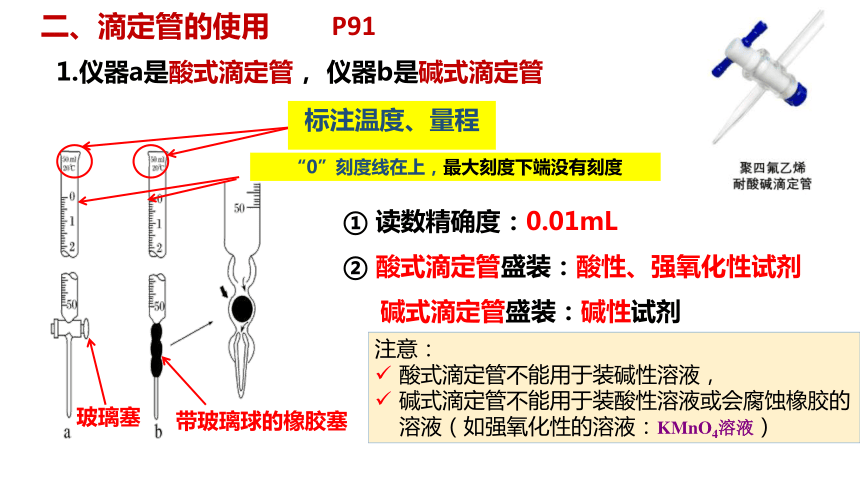
1.仪器a是酸式滴定管, 仪器b是碱式滴定管
① 读数精确度:0.01mL
② 酸式滴定管盛装:酸性、强氧化性试剂
碱式滴定管盛装:碱性试剂
标注温度、量程
“0”刻度线在上,最大刻度下端没有刻度
玻璃塞
带玻璃球的橡胶塞
注意:
酸式滴定管不能用于装碱性溶液,
碱式滴定管不能用于装酸性溶液或会腐蚀橡胶的溶液(如强氧化性的溶液:KMnO4溶液)
二、滴定管的使用
P91
2.滴定管与量筒区别
(1)量筒:粗量仪,无“0”刻度,最大刻度值在上方。
例如:10mL量筒最小分刻度为0.1mL
读数到小数点后一位(0.1mL)
读到小数点后两位(0.01mL)
(2)滴定管
标有温度、容积,“0”刻度在上方
常用规格:25.00mL、50.00mL
精量仪可估读一位,粗量仪不能估读
7
8
8
7
滴定管
量筒
7.43mL
7.6mL
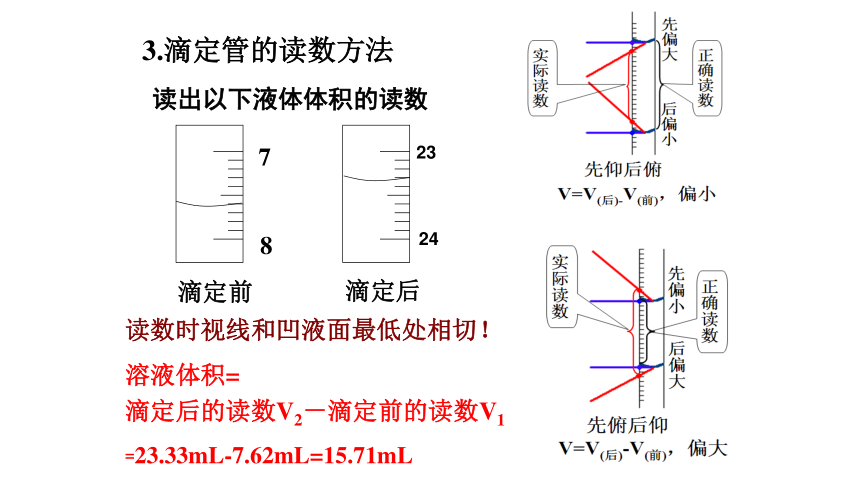
3.滴定管的读数方法
溶液体积=
滴定后的读数V2-滴定前的读数V1
=23.33mL-7.62mL=15.71mL
读出以下液体体积的读数
7
8
滴定前
23
24
滴定后
读数时视线和凹液面最低处相切!
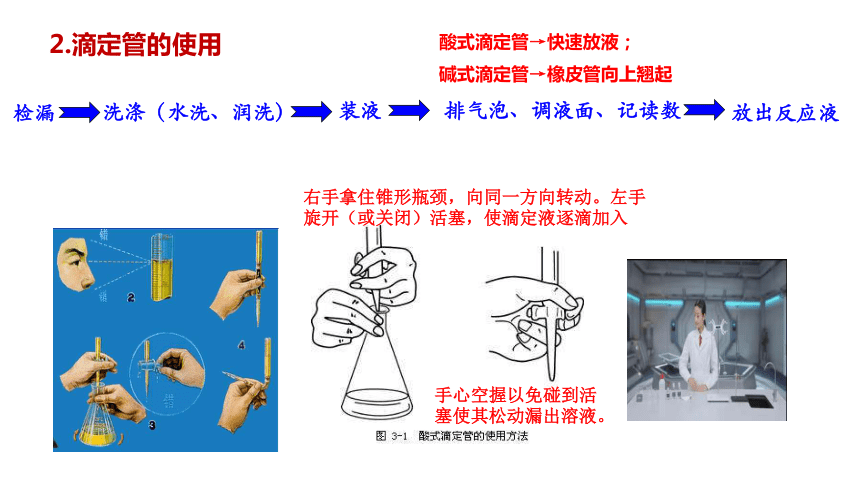
2.滴定管的使用
检漏
洗涤(水洗、润洗)
装液
排气泡、调液面、记读数
放出反应液
酸式滴定管→快速放液;
碱式滴定管→橡皮管向上翘起
右手拿住锥形瓶颈,向同一方向转动。左手旋开(或关闭)活塞,使滴定液逐滴加入
手心空握以免碰到活塞使其松动漏出溶液。
2.滴定管的使用
检漏
洗涤(水洗、润洗)
装液
排气泡、调液面、记读数
放出反应液
检漏:对于酸式滴定管,先关闭活塞,装水至“0”线以上,直立约2 min,仔细观察有无水滴滴下,然后将活塞转180°,再直立2 min,观察有无水滴滴下。
检漏:碱式滴定管:向其中加入一定量的水,用滴定管夹将其固定铁架台上,观察是否漏水。若2分钟内不漏水,轻轻挤压玻璃球,放出少量液体,再次观察滴定管是否漏水。
润洗滴定管:从滴定管上口加入3~5mL所要盛装的酸或碱溶液,倾斜着转动滴定管,使液体润湿滴定管内壁;然后,一手控制活塞(对酸式滴定管,轻轻转动活塞;对于碱式滴定管,轻轻挤压玻璃球),将液体从滴定管下部放入预置的烧杯。
排气泡:将酸式滴定管稍稍倾斜,迅速打开活塞,气泡随溶液的流出而被排出;碱式滴定管,可将橡皮管稍向上弯曲,挤压玻璃球,气泡可被流水挤出。
排气泡
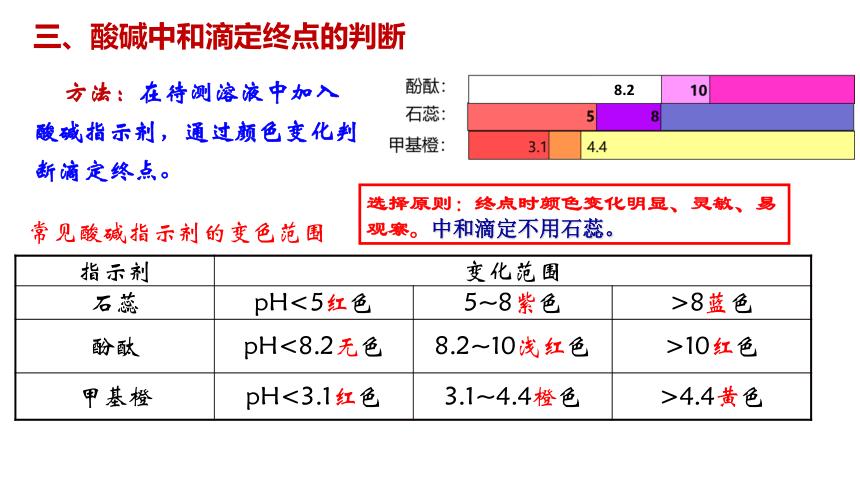
三、酸碱中和滴定终点的判断
方法:在待测溶液中加入酸碱指示剂,通过颜色变化判断滴定终点。
指示剂 变化范围 石蕊 pH<5红色 5~8紫色 >8蓝色
酚酞 pH<8.2无色 8.2~10浅红色 >10红色
甲基橙 pH<3.1红色 3.1~4.4橙色 >4.4黄色
常见酸碱指示剂的变色范围
8.2
选择原则:终点时颜色变化明显、灵敏、易观察。中和滴定不用石蕊。
判断下列情况下溶液的pH值。
(pH=1)
(B)滴加氢氧化钠溶液到完全反应相差
一滴(0.02mL)时,溶液的pH值
(pH=4.3)
(A)未滴氢氧化钠溶液时盐酸溶液的pH值
在0.1000mol·L-1的盐酸20.00mL中逐滴滴入0.1000mol·L-1氢氧化钠溶液到40.00mL。
滴加NaOH:19.98mL
C(H+)= = 5×10-5mol·L-1
20.00mL+19.98mL
0.1000mol·L-1×0.0200mL
pH=5-lg5=4.3
(C)完全反应后再多加1滴氢氧化钠溶液 时的pH值
(pH=9.7)
判断下列情况下溶液的pH值。
在0.1000mol·L-1的盐酸20.00mL中逐滴滴入0.1000mol·L-1氢氧化钠溶液到40.00mL。
滴加NaOH:20.02mL
C(OH-)= = 5×10-5mol·L-1
20.00mL+20.02mL
0.1000mol·L-1×0.0200mL
C(H+)=2×10-10mol·L-1
pH=10-lg2=9.7
用0.1000mol/LNaOH滴定0.1000mol/LHCl的滴定曲线
锥形瓶:20.00mLHCl,滴定管:逐滴加NaOH
(H+)=
20.00×0.100-5.00×0.100
20.00+5.00
=0.06mol/L
pH=-lg0.06=1.22
1.22
(H+)=
20.00×0.100-19.95×0.100
20.00+19.95
=0.000125mol/L
pH=3.9
3.9
4.3
7.0
1.48
1.85
2.3
2.6
9.7
10.3
10.4
0.02mL
约1滴
pH提高了5.4个单位
(突变)
突变范围内指示误差均很小
pH
NaOH
5.00
10.00
15.00
18.00
19.00
19.95
19.98
20.00
20.02
20.08
20.10
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
pH突变范围
中和滴定曲线
酚酞
甲基橙
反应终点:
pH = 7
突变范围:
pH 4.3~9.7
跟完全反应后所需氢氧化钠溶液相差一滴(或多加一滴),对计算盐酸的浓度有没有影响?
C酸 =
0.1000×0.01998
0.02
= 0.0999(mol·L-1)
跟实际浓度0.1000mol·L-1相比,误差很小。
C酸 =
0.1000×0.02002
0.02
= 0.1001(mol·L-1)
1.在滴定终点前后,溶液的pH值发生突跃。(突跃范围与酸碱的强弱、酸碱的浓度等有关;酸或碱越弱,范围越窄;浓度越小,范围越窄。)
2.酚酞或甲基橙的变色范围落在溶液pH值的突跃范围内。
结论:
3.按pH值突跃范围内体积计算,结果可以达到足够的准确度。
指示剂的选择
酚酞:酸滴定碱——颜色由红色变无色
碱滴定酸——颜色由无色变浅红色或粉红色
甲基橙:酸滴定碱——颜色由黄色刚好到橙色
碱滴定酸——颜色由红色刚好到黄色
酸碱指示剂
石蕊5.0 ~ 8.0 酚酞8.2 ~10.0 甲基橙3.1~ 4.4
红 .紫 .蓝 无. 粉红. 红 红. 橙. 黄
[请注意记住]: ①强酸滴定弱碱(生成强酸弱碱盐,显酸性),必选甲基橙(黄色→橙色);
②强碱滴定弱酸(生成强碱弱酸盐,显碱性),必选酚酞(无色→粉红色或浅红色);
③两强滴定,原则上甲基橙和酚酞皆可选用;
④ 2~3滴。因指示剂本身也是弱酸弱碱,若用量过多,会使中和滴定中需要的酸或碱的量会增多或减少
选择原则:终点时颜色变化明显、灵敏、易观察。中和滴定肯定不用石蕊。
四、酸碱中和滴定操作
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、赶气泡、调液面
④记录初读数V1
⑩计算待测液浓度
⑨记录末读数V2
⑧滴加标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
c(标)·V(标)
V(aq)
=
c(待 )
不用待装液润洗
滴定过程中,在锥形瓶底垫一张白纸的作用:便于准确观察锥形瓶中溶液颜色变化。
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
注意:①滴速:先快后慢,当接近终点时,应半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
②终点的判断:滴入最后半滴标准液,溶液xx变xx色,且在半分钟内不变变色,视为滴定终点。(答题模板)
③数据处理:为减少实验误差,重复实验2~3次,去掉 “离群”值,根据所用标准溶液体积计算出待测液的物质的量浓度,然后求出待测液的物质的量浓度的平均值。
“半滴操作”:在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,继续摇动锥形瓶,观察颜色变化。
数据处理
c(NaOH)· V ( NaOH)
V ( HCl )
c(HCl ) ==
第一次和第三次的平均值: c(HCl )
==
0.10055+0.10045
2
==
==
0.1000×20.11
20.00
==
0.10055mol/L
第一次
第三次
c(NaOH)· V ( NaOH)
V ( HCl )
c(HCl ) ==
==
0.1000×20.11
20.00
0.10045mol/L
==
0.1005mol/L
移液管
洗耳球
取液
移液管:量取一定体积的仪器
放液时操作:将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管。
管上标有温度,规格,刻度线。
注意事项:1.先水洗,后润洗2-3次;2.洗耳球吸取操作
移液管的正确操作:蒸馏水洗涤→待转移溶液润洗→洗耳球吸溶液至移液管标线以上,食指堵住管口→放液至凹液面最低处与移液管标线相切,按紧管口→移液管尖与锥形瓶内壁接触,松开食指放液→放液完毕,停留数秒,取出移液管→洗净,放回管架。
侧边自动定零位滴定管:操作简单、无视力误差、计量准确
关键: 紧扣公式,分析V(标)的变化。
↓
计算
已知
↑
↓
预先量取
→滴定测得
五、酸碱中和滴定误差分析
滴定管内是标准液,锥形瓶内是待测液
3. 锥形瓶用蒸馏水洗涤后再用待测液润洗。
一、仪器润洗不当
1. 盛放标准液的滴定管用蒸馏水洗涤后未用标准液润洗。
分析:这时标准液的实际浓度变小了,如果用标准液滴定待测液,会使标准液的用量V标增大,导致c待偏大。
2. 盛放待测液的滴定管用蒸馏水洗涤后未用待测液润洗。
分析:这时实际所取待测液的总物质的量变小了,会使标准液的用量V标减小,导致c待偏小。
分析:这时待测液实际的物质的量变大了,使标准液的用量V标增大,导致c待偏大。
5.临近终点时用蒸馏水将锥形瓶内壁标准液冲洗下去。
无影响
4.锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水。
无影响
二、读数方法有误
1. 滴定前仰视,滴定后俯视。
仰视时,观察液面低于实际液面;俯视时,观察液面高于实际液面。所以滴定前仰视V始偏大,滴定后俯视V末偏小。这样V标偏小,导致c待偏小。
。
2. 滴定前俯视,滴定后仰视。
同理推知V标偏大,则c待偏大。
3. 用滴定管量取待测液时,记录起始体积时,仰视读数;记录所需体积时,俯视读数。
分析:实际所取待测液的总物质的量变大了,会使标准液的用量V标增大,导致c待增大。
三、操作出现问题
1. 盛放标准液的滴定管漏液。
分析:这样会使标准液的实际用量增加,致使c待偏大。
2. 盛放标准液的滴定管滴定前尖嘴部分有气泡,终点时无气泡。
分析:这样会使V标偏大,致使c待偏大。
4. 振荡锥形瓶时,不小心将待测液溅出。
分析:这样会使待测液的总量变少,从而标准液的
用量V标也减小,致使c待偏小。
5. 滴定过程中,将标准液滴到锥形瓶外。
分析:这样会增大标准液的用量V标,致使c待偏大。
3. 盛放待测液的滴定管,记录起始体积时尖嘴部分有气泡,记录所需体积时尖嘴部分无气泡。
分析:这时实际所取待测液的总物质的量变小了,会使标准液的用量V标减小,导致c待偏小。
四、终点判断不准
3. 滴定至终点时滴定管尖嘴处有半滴溶液尚未滴下。
1. 强酸滴定弱碱时,甲基橙由黄色变为红色且半分钟内无明显变化时停止滴定。
分析:终点时甲基橙的颜色变化应是由黄色变为橙色,所以这属于过晚估计终点,V标偏大致使c待偏大。
4. 强酸滴定弱碱时,用酚酞做指示剂由红色变为无色且半分钟内无明显变化时停止滴定。
2. 强碱滴定弱酸时,酚酞由无色变为浅红色时立即停止滴定(半分钟内溶液又变为无色)。
分析: 这属于过早估计终点,V标偏小致使c待偏小
分析:此时假如把这半滴标准液滴入反应液中,肯定会超过终点,V标偏大致使c待偏大。
分析: 这属于指示剂选择不当,会过早估计终点,V标偏小致使c待偏小
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
检漏
洗涤、润洗
装液、调液和取液(记下读数)
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
课堂小结
氧化还原滴定
1.原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定
一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(3)间接滴定法:某些非氧化性物质,可以用间接滴定法进行测定。例如,测Ca2+含量时,先将Ca2+沉淀为CaC2O4,再用稀硫酸将所得沉淀溶解,用KMnO4标准液滴定溶液中的H2C2O4,间接求得Ca2+含量。
3.指示剂:氧化还原滴定的指示剂有三类:
(1)氧化还原指示剂。
(2)专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝。
(3)自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。
4.试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
氧化还原滴定
5.实例:
(1)酸性KMnO4溶液滴定H2C2O4溶液
原理 +6H++5H2C2O4===10CO2↑+2Mn2++8H2O
指示剂 酸性KMnO4溶液本身呈紫红色,不用另外选择指示剂
终点判断 当滴入最后半滴酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色,说明到达滴定终点
酸性KMnO4溶液:酸式滴定管
KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:
①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;
②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到的KMnO4溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,在70~80 ℃条件下用
基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
(2)Na2S2O3溶液滴定含碘(I2)溶液
原理 2Na2S2O3+I2===Na2S4O6+2NaI
指示剂 用淀粉作为指示剂
终点判断 当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点
(连四硫酸钠)
滴定时不能过度摇动锥形瓶:避免I-被空气氧化成I2,造成实验误差。
Na2S2O3溶液:碱式滴定管
装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是
防止碘挥发损失
双指示剂滴定法测定混合碱的组成
HCl+Na2CO3=NaCl+NaHCO3
HCl+NaHCO3=NaCl+H2O+CO2↑
NaOH、Na2CO3 、NaHCO3
V1 HCl
V2 HCl
H2O、NaHCO3 、NaHCO3
H2O、 H2O +CO2 、H2O +CO2
化学计量点(pH=8.3)
化学计量点(pH=3.9)
HCl+NaOH=NaCl+H2O
比较V1和V2的大小关系,可判断混合碱的组成
V1和V2的大小关系 混合碱的组成
V1=V2 Na2CO3
V1>V2>0 NaOH和Na2CO3
V2>V1>0 Na2CO3和NaHCO3
V1=0,V2>0 NaHCO3
V1>0,V2=0 NaOH
酚酞 pH=8.2
甲基橙 pH=4.4
4.(2022·山东潍坊一中高二检测)25 ℃时,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的一元强酸甲和一元弱酸乙,滴定曲线如图所示。下列有关判断正确的是
A.曲线Ⅰ代表的滴定最好选用甲基橙作指示剂
B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙
C.电离常数Ka(乙)≈1.01×10-5
D.图像中的x>20.00
C
5.室温时,将0.10 mol·L-1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示。当V(NaOH)=20.00 mL时,溶液恰好完全反应。则下列有关说法不正确的是
A.该一元酸溶液浓度为0.10 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka≈1×10-5
D.a点和c点所示溶液中H2O的电离程度相同
c
2.如图是用一定物质的量浓度的NaOH溶液滴定10.00 mL 一定物质的量浓度的盐酸的图像,依据图像推出盐酸和NaOH溶液中溶质的物质的量浓度是下表内的
选项 A B C D
c(HCl)/ (mol·L-1) 0.120 0 0.040 00 0.030 00 0.090 00
c(NaOH)/ (mol·L-1) 0.040 00 0.120 0 0.090 00 0.030 00
D
时间,点点滴滴,滴定着我们的人生终点
第2课时 酸碱中和滴定
用什么方法可以比较精确地测得一瓶未知浓度NaOH溶液的浓度?
①中和反应的实质是什么?
思考
H++OH-=H2O
②当酸碱刚好完全反应时,酸和碱的物质的量的关系
是怎样的?
酸与碱的元数相同时:
C酸V酸=C碱V碱
nH+= nOH-
可以用已知浓度的酸(或碱)来测定出未知浓度的碱(或酸)的浓度
酸碱中和滴定
aC酸V酸=bC碱V碱
a元酸与b元碱反应时:
【例题1】用0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL通过中和滴定测得NaOH溶液的物质的量浓度是多少?
【解】这是一元强酸和一元强碱的中和滴定,可以利用
c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),即
c(HCl) · V(HCl)
V(NaOH)
c(NaOH) =
0.1032mol/L · 0.02784L
0.02500L
=
=0.1149mol /L
用已知浓度的酸(或碱)测定未知浓度的碱(或酸)。
中和滴定的两个关键点:
1、准确测定参加反应的溶液的体积。
2、准确判断中和反应是否恰好进行完全。
解决这两个关键问题的办法:
1、用滴定管量取溶液的体积。
2、选用恰当的酸碱指示剂。
C待=
C标V标
V待
已知
已知
读数
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待
一、酸碱中和滴定的基本原理
已知物质的量浓度的溶液——标准液
未知物质的量浓度的溶液——待测液
一元酸与一元碱中和:
酸碱中和滴定所需的仪器
酸式滴定管
碱式滴定管
铁架台
滴定管夹
锥形瓶
烧杯
烧杯
二、滴定管的使用
将凡士林涂在旋塞的a端和旋塞套内的c端
玻璃活塞
橡胶管(带玻璃球)
二、滴定管的使用
1.仪器a是酸式滴定管, 仪器b是碱式滴定管
① 读数精确度:0.01mL
② 酸式滴定管盛装:酸性、强氧化性试剂
碱式滴定管盛装:碱性试剂
标注温度、量程
“0”刻度线在上,最大刻度下端没有刻度
玻璃塞
带玻璃球的橡胶塞
注意:
酸式滴定管不能用于装碱性溶液,
碱式滴定管不能用于装酸性溶液或会腐蚀橡胶的溶液(如强氧化性的溶液:KMnO4溶液)
二、滴定管的使用
P91
2.滴定管与量筒区别
(1)量筒:粗量仪,无“0”刻度,最大刻度值在上方。
例如:10mL量筒最小分刻度为0.1mL
读数到小数点后一位(0.1mL)
读到小数点后两位(0.01mL)
(2)滴定管
标有温度、容积,“0”刻度在上方
常用规格:25.00mL、50.00mL
精量仪可估读一位,粗量仪不能估读
7
8
8
7
滴定管
量筒
7.43mL
7.6mL
3.滴定管的读数方法
溶液体积=
滴定后的读数V2-滴定前的读数V1
=23.33mL-7.62mL=15.71mL
读出以下液体体积的读数
7
8
滴定前
23
24
滴定后
读数时视线和凹液面最低处相切!
2.滴定管的使用
检漏
洗涤(水洗、润洗)
装液
排气泡、调液面、记读数
放出反应液
酸式滴定管→快速放液;
碱式滴定管→橡皮管向上翘起
右手拿住锥形瓶颈,向同一方向转动。左手旋开(或关闭)活塞,使滴定液逐滴加入
手心空握以免碰到活塞使其松动漏出溶液。
2.滴定管的使用
检漏
洗涤(水洗、润洗)
装液
排气泡、调液面、记读数
放出反应液
检漏:对于酸式滴定管,先关闭活塞,装水至“0”线以上,直立约2 min,仔细观察有无水滴滴下,然后将活塞转180°,再直立2 min,观察有无水滴滴下。
检漏:碱式滴定管:向其中加入一定量的水,用滴定管夹将其固定铁架台上,观察是否漏水。若2分钟内不漏水,轻轻挤压玻璃球,放出少量液体,再次观察滴定管是否漏水。
润洗滴定管:从滴定管上口加入3~5mL所要盛装的酸或碱溶液,倾斜着转动滴定管,使液体润湿滴定管内壁;然后,一手控制活塞(对酸式滴定管,轻轻转动活塞;对于碱式滴定管,轻轻挤压玻璃球),将液体从滴定管下部放入预置的烧杯。
排气泡:将酸式滴定管稍稍倾斜,迅速打开活塞,气泡随溶液的流出而被排出;碱式滴定管,可将橡皮管稍向上弯曲,挤压玻璃球,气泡可被流水挤出。
排气泡
三、酸碱中和滴定终点的判断
方法:在待测溶液中加入酸碱指示剂,通过颜色变化判断滴定终点。
指示剂 变化范围 石蕊 pH<5红色 5~8紫色 >8蓝色
酚酞 pH<8.2无色 8.2~10浅红色 >10红色
甲基橙 pH<3.1红色 3.1~4.4橙色 >4.4黄色
常见酸碱指示剂的变色范围
8.2
选择原则:终点时颜色变化明显、灵敏、易观察。中和滴定不用石蕊。
判断下列情况下溶液的pH值。
(pH=1)
(B)滴加氢氧化钠溶液到完全反应相差
一滴(0.02mL)时,溶液的pH值
(pH=4.3)
(A)未滴氢氧化钠溶液时盐酸溶液的pH值
在0.1000mol·L-1的盐酸20.00mL中逐滴滴入0.1000mol·L-1氢氧化钠溶液到40.00mL。
滴加NaOH:19.98mL
C(H+)= = 5×10-5mol·L-1
20.00mL+19.98mL
0.1000mol·L-1×0.0200mL
pH=5-lg5=4.3
(C)完全反应后再多加1滴氢氧化钠溶液 时的pH值
(pH=9.7)
判断下列情况下溶液的pH值。
在0.1000mol·L-1的盐酸20.00mL中逐滴滴入0.1000mol·L-1氢氧化钠溶液到40.00mL。
滴加NaOH:20.02mL
C(OH-)= = 5×10-5mol·L-1
20.00mL+20.02mL
0.1000mol·L-1×0.0200mL
C(H+)=2×10-10mol·L-1
pH=10-lg2=9.7
用0.1000mol/LNaOH滴定0.1000mol/LHCl的滴定曲线
锥形瓶:20.00mLHCl,滴定管:逐滴加NaOH
(H+)=
20.00×0.100-5.00×0.100
20.00+5.00
=0.06mol/L
pH=-lg0.06=1.22
1.22
(H+)=
20.00×0.100-19.95×0.100
20.00+19.95
=0.000125mol/L
pH=3.9
3.9
4.3
7.0
1.48
1.85
2.3
2.6
9.7
10.3
10.4
0.02mL
约1滴
pH提高了5.4个单位
(突变)
突变范围内指示误差均很小
pH
NaOH
5.00
10.00
15.00
18.00
19.00
19.95
19.98
20.00
20.02
20.08
20.10
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
pH突变范围
中和滴定曲线
酚酞
甲基橙
反应终点:
pH = 7
突变范围:
pH 4.3~9.7
跟完全反应后所需氢氧化钠溶液相差一滴(或多加一滴),对计算盐酸的浓度有没有影响?
C酸 =
0.1000×0.01998
0.02
= 0.0999(mol·L-1)
跟实际浓度0.1000mol·L-1相比,误差很小。
C酸 =
0.1000×0.02002
0.02
= 0.1001(mol·L-1)
1.在滴定终点前后,溶液的pH值发生突跃。(突跃范围与酸碱的强弱、酸碱的浓度等有关;酸或碱越弱,范围越窄;浓度越小,范围越窄。)
2.酚酞或甲基橙的变色范围落在溶液pH值的突跃范围内。
结论:
3.按pH值突跃范围内体积计算,结果可以达到足够的准确度。
指示剂的选择
酚酞:酸滴定碱——颜色由红色变无色
碱滴定酸——颜色由无色变浅红色或粉红色
甲基橙:酸滴定碱——颜色由黄色刚好到橙色
碱滴定酸——颜色由红色刚好到黄色
酸碱指示剂
石蕊5.0 ~ 8.0 酚酞8.2 ~10.0 甲基橙3.1~ 4.4
红 .紫 .蓝 无. 粉红. 红 红. 橙. 黄
[请注意记住]: ①强酸滴定弱碱(生成强酸弱碱盐,显酸性),必选甲基橙(黄色→橙色);
②强碱滴定弱酸(生成强碱弱酸盐,显碱性),必选酚酞(无色→粉红色或浅红色);
③两强滴定,原则上甲基橙和酚酞皆可选用;
④ 2~3滴。因指示剂本身也是弱酸弱碱,若用量过多,会使中和滴定中需要的酸或碱的量会增多或减少
选择原则:终点时颜色变化明显、灵敏、易观察。中和滴定肯定不用石蕊。
四、酸碱中和滴定操作
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、赶气泡、调液面
④记录初读数V1
⑩计算待测液浓度
⑨记录末读数V2
⑧滴加标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
c(标)·V(标)
V(aq)
=
c(待 )
不用待装液润洗
滴定过程中,在锥形瓶底垫一张白纸的作用:便于准确观察锥形瓶中溶液颜色变化。
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
注意:①滴速:先快后慢,当接近终点时,应半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
②终点的判断:滴入最后半滴标准液,溶液xx变xx色,且在半分钟内不变变色,视为滴定终点。(答题模板)
③数据处理:为减少实验误差,重复实验2~3次,去掉 “离群”值,根据所用标准溶液体积计算出待测液的物质的量浓度,然后求出待测液的物质的量浓度的平均值。
“半滴操作”:在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,继续摇动锥形瓶,观察颜色变化。
数据处理
c(NaOH)· V ( NaOH)
V ( HCl )
c(HCl ) ==
第一次和第三次的平均值: c(HCl )
==
0.10055+0.10045
2
==
==
0.1000×20.11
20.00
==
0.10055mol/L
第一次
第三次
c(NaOH)· V ( NaOH)
V ( HCl )
c(HCl ) ==
==
0.1000×20.11
20.00
0.10045mol/L
==
0.1005mol/L
移液管
洗耳球
取液
移液管:量取一定体积的仪器
放液时操作:将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管。
管上标有温度,规格,刻度线。
注意事项:1.先水洗,后润洗2-3次;2.洗耳球吸取操作
移液管的正确操作:蒸馏水洗涤→待转移溶液润洗→洗耳球吸溶液至移液管标线以上,食指堵住管口→放液至凹液面最低处与移液管标线相切,按紧管口→移液管尖与锥形瓶内壁接触,松开食指放液→放液完毕,停留数秒,取出移液管→洗净,放回管架。
侧边自动定零位滴定管:操作简单、无视力误差、计量准确
关键: 紧扣公式,分析V(标)的变化。
↓
计算
已知
↑
↓
预先量取
→滴定测得
五、酸碱中和滴定误差分析
滴定管内是标准液,锥形瓶内是待测液
3. 锥形瓶用蒸馏水洗涤后再用待测液润洗。
一、仪器润洗不当
1. 盛放标准液的滴定管用蒸馏水洗涤后未用标准液润洗。
分析:这时标准液的实际浓度变小了,如果用标准液滴定待测液,会使标准液的用量V标增大,导致c待偏大。
2. 盛放待测液的滴定管用蒸馏水洗涤后未用待测液润洗。
分析:这时实际所取待测液的总物质的量变小了,会使标准液的用量V标减小,导致c待偏小。
分析:这时待测液实际的物质的量变大了,使标准液的用量V标增大,导致c待偏大。
5.临近终点时用蒸馏水将锥形瓶内壁标准液冲洗下去。
无影响
4.锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水。
无影响
二、读数方法有误
1. 滴定前仰视,滴定后俯视。
仰视时,观察液面低于实际液面;俯视时,观察液面高于实际液面。所以滴定前仰视V始偏大,滴定后俯视V末偏小。这样V标偏小,导致c待偏小。
。
2. 滴定前俯视,滴定后仰视。
同理推知V标偏大,则c待偏大。
3. 用滴定管量取待测液时,记录起始体积时,仰视读数;记录所需体积时,俯视读数。
分析:实际所取待测液的总物质的量变大了,会使标准液的用量V标增大,导致c待增大。
三、操作出现问题
1. 盛放标准液的滴定管漏液。
分析:这样会使标准液的实际用量增加,致使c待偏大。
2. 盛放标准液的滴定管滴定前尖嘴部分有气泡,终点时无气泡。
分析:这样会使V标偏大,致使c待偏大。
4. 振荡锥形瓶时,不小心将待测液溅出。
分析:这样会使待测液的总量变少,从而标准液的
用量V标也减小,致使c待偏小。
5. 滴定过程中,将标准液滴到锥形瓶外。
分析:这样会增大标准液的用量V标,致使c待偏大。
3. 盛放待测液的滴定管,记录起始体积时尖嘴部分有气泡,记录所需体积时尖嘴部分无气泡。
分析:这时实际所取待测液的总物质的量变小了,会使标准液的用量V标减小,导致c待偏小。
四、终点判断不准
3. 滴定至终点时滴定管尖嘴处有半滴溶液尚未滴下。
1. 强酸滴定弱碱时,甲基橙由黄色变为红色且半分钟内无明显变化时停止滴定。
分析:终点时甲基橙的颜色变化应是由黄色变为橙色,所以这属于过晚估计终点,V标偏大致使c待偏大。
4. 强酸滴定弱碱时,用酚酞做指示剂由红色变为无色且半分钟内无明显变化时停止滴定。
2. 强碱滴定弱酸时,酚酞由无色变为浅红色时立即停止滴定(半分钟内溶液又变为无色)。
分析: 这属于过早估计终点,V标偏小致使c待偏小
分析:此时假如把这半滴标准液滴入反应液中,肯定会超过终点,V标偏大致使c待偏大。
分析: 这属于指示剂选择不当,会过早估计终点,V标偏小致使c待偏小
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
检漏
洗涤、润洗
装液、调液和取液(记下读数)
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
课堂小结
氧化还原滴定
1.原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定
一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(3)间接滴定法:某些非氧化性物质,可以用间接滴定法进行测定。例如,测Ca2+含量时,先将Ca2+沉淀为CaC2O4,再用稀硫酸将所得沉淀溶解,用KMnO4标准液滴定溶液中的H2C2O4,间接求得Ca2+含量。
3.指示剂:氧化还原滴定的指示剂有三类:
(1)氧化还原指示剂。
(2)专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝。
(3)自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。
4.试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
氧化还原滴定
5.实例:
(1)酸性KMnO4溶液滴定H2C2O4溶液
原理 +6H++5H2C2O4===10CO2↑+2Mn2++8H2O
指示剂 酸性KMnO4溶液本身呈紫红色,不用另外选择指示剂
终点判断 当滴入最后半滴酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色,说明到达滴定终点
酸性KMnO4溶液:酸式滴定管
KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:
①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;
②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到的KMnO4溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,在70~80 ℃条件下用
基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
(2)Na2S2O3溶液滴定含碘(I2)溶液
原理 2Na2S2O3+I2===Na2S4O6+2NaI
指示剂 用淀粉作为指示剂
终点判断 当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点
(连四硫酸钠)
滴定时不能过度摇动锥形瓶:避免I-被空气氧化成I2,造成实验误差。
Na2S2O3溶液:碱式滴定管
装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是
防止碘挥发损失
双指示剂滴定法测定混合碱的组成
HCl+Na2CO3=NaCl+NaHCO3
HCl+NaHCO3=NaCl+H2O+CO2↑
NaOH、Na2CO3 、NaHCO3
V1 HCl
V2 HCl
H2O、NaHCO3 、NaHCO3
H2O、 H2O +CO2 、H2O +CO2
化学计量点(pH=8.3)
化学计量点(pH=3.9)
HCl+NaOH=NaCl+H2O
比较V1和V2的大小关系,可判断混合碱的组成
V1和V2的大小关系 混合碱的组成
V1=V2 Na2CO3
V1>V2>0 NaOH和Na2CO3
V2>V1>0 Na2CO3和NaHCO3
V1=0,V2>0 NaHCO3
V1>0,V2=0 NaOH
酚酞 pH=8.2
甲基橙 pH=4.4
4.(2022·山东潍坊一中高二检测)25 ℃时,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的一元强酸甲和一元弱酸乙,滴定曲线如图所示。下列有关判断正确的是
A.曲线Ⅰ代表的滴定最好选用甲基橙作指示剂
B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙
C.电离常数Ka(乙)≈1.01×10-5
D.图像中的x>20.00
C
5.室温时,将0.10 mol·L-1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示。当V(NaOH)=20.00 mL时,溶液恰好完全反应。则下列有关说法不正确的是
A.该一元酸溶液浓度为0.10 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka≈1×10-5
D.a点和c点所示溶液中H2O的电离程度相同
c
2.如图是用一定物质的量浓度的NaOH溶液滴定10.00 mL 一定物质的量浓度的盐酸的图像,依据图像推出盐酸和NaOH溶液中溶质的物质的量浓度是下表内的
选项 A B C D
c(HCl)/ (mol·L-1) 0.120 0 0.040 00 0.030 00 0.090 00
c(NaOH)/ (mol·L-1) 0.040 00 0.120 0 0.090 00 0.030 00
D
