2.3物质的量 课件 (共40张PPT) 人教版2019高中化学必修一
文档属性
| 名称 | 2.3物质的量 课件 (共40张PPT) 人教版2019高中化学必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-16 16:12:35 | ||
图片预览










文档简介
(共40张PPT)
2.3.3 物质的量浓度
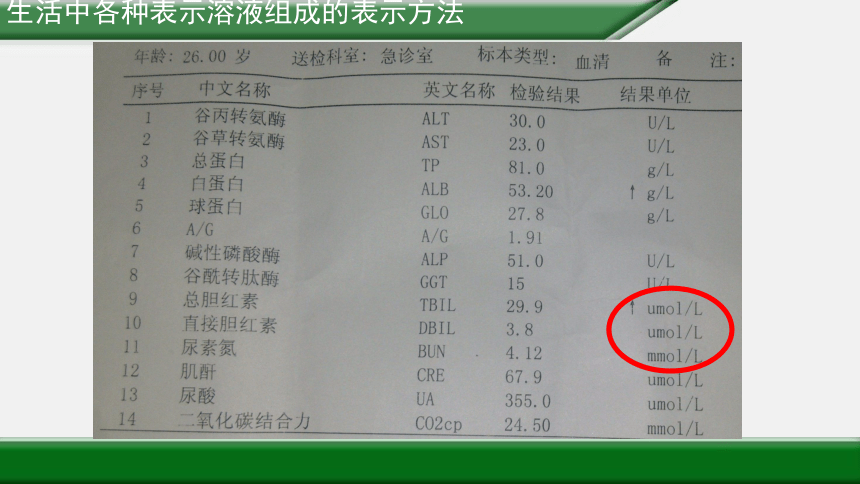
生活中各种表示溶液组成的表示方法
从0.9%的NaCl溶液中取出多少才包含有0.45g的NaCl呢?
m[NaCl(aq)]= m(NaCl) ÷ ω(NaCl)
=0.45g ÷ 0.9%
=50g
然后用托盘天平称取50g溶液
取一定量溶液时,是称质量方便还是量体积方便?
?
能不能通过量取一定体积的溶液就知道其中含有多少摩尔溶质呢?
生活中各种表示溶液组成的表示方法
生活中各种表示溶液组成的表示方法
1.定义:单位体积溶液中所含溶质B的物质的量。
4.单位:
一、物质的量浓度
cB=
nB
V
mol/L或 mol·L-1
2.符号:cB
3.表达式:
【学思结合】
nB:溶质B的物质的量
V : 溶液的体积
除特殊说明体积可相加,其它用
Vaq≠ V溶剂
Vaq≠ V溶剂 + V溶质
一、物质的量浓度
【随堂演练】
2.下列溶液中物质的量浓度为1mol·L-1的是( )
A.将 40 g NaOH溶解于 1 L 水中
B.10 g NaOH溶解在水中配成250mL溶液
C.从 100 mL 10mol·L-1的浓盐酸中取出10 mL
D.将22.4L氯化氢气体溶于水配成1L溶液
B
5.注意:
①溶质的量 是 物质的量 而不是 质量
②从一定物质的量浓度的溶液中取出任意体积的溶液,其物质的量浓度不变。
③B表示任意溶质,可以是分子、离子或其特定组合。
④某些物质溶于水后与水反应生成新物质,溶质一般指新物质。如CaO溶于水后生成了Ca(OH)2,则Ca(OH)2为该溶液的溶质。
⑤带结晶水的物质溶于水后,溶质是不带结晶水的物质,溶剂中包含结晶水。如250g CuSO4·5H2O溶于水,则溶质为CuSO4,溶质质量为160g。
⑥气体溶于水配成溶液,溶液体积不等于溶剂的体积,也不等于二者的体积之和.
5.注意:
1.对1 mol/L Na2SO4溶液的叙述正确的是
A.溶液中含有1 mol Na2SO4
B.1L溶液中含有 142g Na2SO4
C.1 mol Na2SO4溶于1 L 水
D.从 1 L 该溶液中取出 500 mL以后,
剩余溶液的浓度为 0.5 mol/L
【随堂演练】
B
二、物质的量浓度的简单计算
cB=
nB
V
1.基本计算公式
nB=cB ·V
V=
cB
nB
nB=
m
M
V(g)
=
Vm
=
N
NA
2.溶液的稀释与混合
(1)稀释规律:
①含义:将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
②公式: c(浓)·V(浓)=c(稀)·V(稀)。
二、物质的量浓度的简单计算
② c(浓)·V(浓)=c(稀)·V(稀)
3 mol·L-1 ·V(浓)=c(稀)·3V(浓)
2.溶液的稀释与混合
(2)混合规律:
①含义:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)
②公式:c1·V1+c2·V2=c(混)·V(混)
二、物质的量浓度的简单计算
1 L 1mol/L MgCl2溶液中,
MgCl2 = = = Mg2+ + 2Cl-
微粒数 1 NA 1 NA 2 NA
物质的量 1 mol 1 mol 2 mol
物质的量浓度 1 mol/L
1 mol/L
2 mol/L
3.溶液中微粒浓度的计量关系
你能得出什么结论?
3.溶液中微粒浓度的计量关系
①.定组成定律:
a.溶液中,阴离子与阳离子的物质的量浓度之比
等于化学组成中离子的个数之比
b.离子浓度=溶液浓度×溶质化学式中 该离子的个数
结论:
②电荷守恒:
在溶液中,阳离子所带的正电荷数
=阴离子所带的负电荷数。
3.溶液中微粒浓度的计量关系
n(Na+)×1=n(SO42-)×2+ n(Cl-)×1
c(Na+)= 2c(SO42-) + c(Cl-)
如Na2SO4和NaCl的混合溶液中:
1.已知在AlCl3溶液中Al3+的物质的量浓度为1mol·L-1,则Cl-的物质的量浓度是多少?
提示:
在溶液中,阴离子与阳离子的浓度之比等于
化学组成中的离子个数之比
所以 c(Cl-)=3c(Al3+)=3mol
4.物质的量浓度与溶质的质量分数的换算
M:溶质B的摩尔质量 ρ:溶液密度(g·mL-1)
换算公式:cB=
M
1000ρω
mol/L
5.溶质为气体的物质的量浓度的计算 《系》p50
①若已知溶液的体积
V(气体)
n
c
②若已知溶液密度
公式:cB=
MV+22400
1000ρV
mol/L
m
n
N
÷M
×M
× NA
÷ NA
V(g)
× Vm
÷Vm
V(aq)
×cB
÷cB
以物质的量为中心的化学计算
如何配制100g质量分数为20%的NaCl溶液的?
(1)计算
(2)称量:称NaCl的质量,量水的体积80mL(80g)
(3)溶解
(4)装瓶贴签
【新课导入】
【新课讲授】
换算成其他有关的溶质的物理量,通常固体算质量
控制溶液的总体积
怎样配制 100mL 1.0 mol/L 的NaCl溶液?
cB=
nB
V
精确计量溶液体积的仪器--容量瓶
①形状: 细颈,梨形,平底的玻璃瓶;带磨口玻璃塞。
②标志:容积,温度,刻度线。
③常见规格:100mL、250mL,
500mL、1000mL;
④唯一用途:配置一定物质的量浓度的溶液
1.用量筒量取5.8mL浓硫酸倒入100mL容量瓶中,然后加水定容,配制一定浓度的硫酸溶液,这样操作可以吗?
【提示】不可以,不能直接在容量瓶中稀释浓溶液,应在烧杯中进行。
⑤使用之前要检查是否漏水。
加水
倒立
观察
正立
瓶塞旋转180o
倒立
观察
1.容量瓶
【学思结合】
若实验时需480 mL NaCl溶液,需选用什么规格的容量瓶?
【答案】500mL容量瓶 。
容量瓶选用原则:“大而近”
所配溶液的体积等于或略小于容量瓶的容积。
1.容量瓶
⑥容量瓶读数要求:视线与凹液面最低处保持水平
俯视
液面低于刻度线
水加少了
仰视:
液面高于刻度线
水加多了
配制100 mL 1.00 mol/L NaCl溶液
0.1mol
5.85g
托盘天平
药匙
烧杯
玻璃棒
2.配制过程 教材P55 《系统集成》p52
100ml容量瓶
玻璃棒
2~3
100ml容量瓶
1~2cm
胶头滴管
凹液面最低点与刻度线相切
2.配制过程
配制过程八字口诀
计→量→溶→移→洗→定→摇→装
摇
俯视
液面低于刻度线
水加少了
仰视:
液面高于刻度线
水加多了
《系》p13
2.定容时俯视或仰视刻度线,会影响配制的结果吗?
【提示】俯视浓度偏高;仰视浓度偏低。
1.为什么要用蒸馏水洗涤烧杯,并将洗涤液也注入容量瓶?
【提示】烧杯上有少量溶质,不注入容量瓶会使浓度偏低。
2.如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
【提示】小了。有部分溶质损失。
【思考与讨论】 教材p56
4.若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?为什么?
【提示】必须重新配制,否则浓度偏低
3.你是用什么仪器称量NaCl固体的?如果是托盘天平,你称量的质量是多少?与计算结果一致吗?为什么?
【提示】托盘天平只能精确到0.1 g
【思考与讨论】 教材p56
5.摇匀后发现液面低于刻线,能否补充水?
【提示】不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
【学与问】
3、误差分析
=
mB
MBVaq
cB
=
nB
V
误差分析应归结为是对
溶质物质的量(或质量)和溶液体积的影响。
误差分析
详见《系统集成》p53
3、误差分析 托盘天平
可能引起误差的操作 过程分析 对c的影响
m V 天平的砝码沾有其他物质或生锈
调整天平零点时,游码放在刻度线右侧
药品和砝码的左右位置颠倒
称量易潮解物质的时间过长
用滤纸称量易潮解物质
溶质含有杂质
增大
不变
偏大
增大
不变
偏大
减小
不变
偏小
减小
不变
偏小
减小
不变
偏小
减小
不变
偏小
3、误差分析 烧杯和玻璃棒
可能引起误差的操作 过程分析 对c的影响
m V 溶解前烧杯内有水
搅拌时部分液体溅出
没有洗涤烧杯和玻璃棒
不变
不变
无影响
减小
不变
偏小
减小
不变
偏小
3、误差分析 容量瓶
可能引起误差的操作 过程分析 对c的影响
m V 没有冷却到室温就转移到容量瓶
向容量瓶转移溶液时有液体流出
定容时,水加多了,用滴管吸出
定容后振荡摇匀静置,液面下降没有加水
定容时,俯视刻度线
定容时,仰视刻度线
不变
减小
偏大
减小
不变
偏小
减小
不变
偏小
不变
不变
无影响
不变
减小
偏大
不变
增大
偏小
2.3.3 物质的量浓度
生活中各种表示溶液组成的表示方法
从0.9%的NaCl溶液中取出多少才包含有0.45g的NaCl呢?
m[NaCl(aq)]= m(NaCl) ÷ ω(NaCl)
=0.45g ÷ 0.9%
=50g
然后用托盘天平称取50g溶液
取一定量溶液时,是称质量方便还是量体积方便?
?
能不能通过量取一定体积的溶液就知道其中含有多少摩尔溶质呢?
生活中各种表示溶液组成的表示方法
生活中各种表示溶液组成的表示方法
1.定义:单位体积溶液中所含溶质B的物质的量。
4.单位:
一、物质的量浓度
cB=
nB
V
mol/L或 mol·L-1
2.符号:cB
3.表达式:
【学思结合】
nB:溶质B的物质的量
V : 溶液的体积
除特殊说明体积可相加,其它用
Vaq≠ V溶剂
Vaq≠ V溶剂 + V溶质
一、物质的量浓度
【随堂演练】
2.下列溶液中物质的量浓度为1mol·L-1的是( )
A.将 40 g NaOH溶解于 1 L 水中
B.10 g NaOH溶解在水中配成250mL溶液
C.从 100 mL 10mol·L-1的浓盐酸中取出10 mL
D.将22.4L氯化氢气体溶于水配成1L溶液
B
5.注意:
①溶质的量 是 物质的量 而不是 质量
②从一定物质的量浓度的溶液中取出任意体积的溶液,其物质的量浓度不变。
③B表示任意溶质,可以是分子、离子或其特定组合。
④某些物质溶于水后与水反应生成新物质,溶质一般指新物质。如CaO溶于水后生成了Ca(OH)2,则Ca(OH)2为该溶液的溶质。
⑤带结晶水的物质溶于水后,溶质是不带结晶水的物质,溶剂中包含结晶水。如250g CuSO4·5H2O溶于水,则溶质为CuSO4,溶质质量为160g。
⑥气体溶于水配成溶液,溶液体积不等于溶剂的体积,也不等于二者的体积之和.
5.注意:
1.对1 mol/L Na2SO4溶液的叙述正确的是
A.溶液中含有1 mol Na2SO4
B.1L溶液中含有 142g Na2SO4
C.1 mol Na2SO4溶于1 L 水
D.从 1 L 该溶液中取出 500 mL以后,
剩余溶液的浓度为 0.5 mol/L
【随堂演练】
B
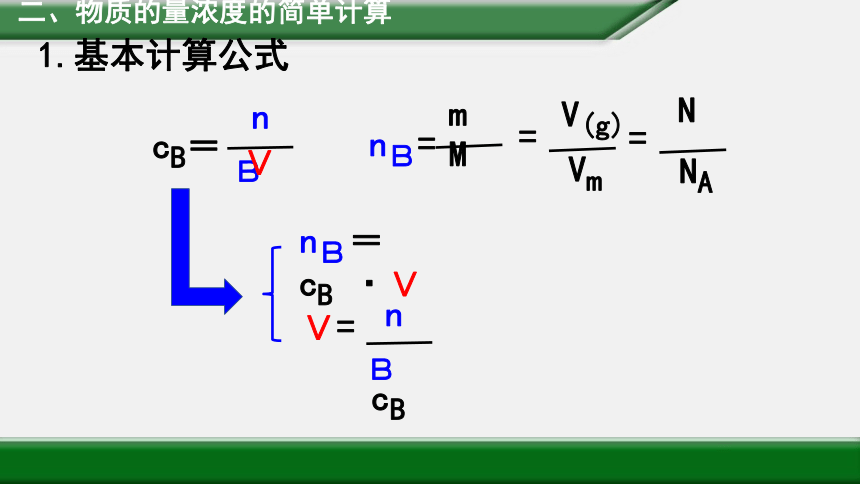
二、物质的量浓度的简单计算
cB=
nB
V
1.基本计算公式
nB=cB ·V
V=
cB
nB
nB=
m
M
V(g)
=
Vm
=
N
NA
2.溶液的稀释与混合
(1)稀释规律:
①含义:将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
②公式: c(浓)·V(浓)=c(稀)·V(稀)。
二、物质的量浓度的简单计算
② c(浓)·V(浓)=c(稀)·V(稀)
3 mol·L-1 ·V(浓)=c(稀)·3V(浓)
2.溶液的稀释与混合
(2)混合规律:
①含义:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)
②公式:c1·V1+c2·V2=c(混)·V(混)
二、物质的量浓度的简单计算
1 L 1mol/L MgCl2溶液中,
MgCl2 = = = Mg2+ + 2Cl-
微粒数 1 NA 1 NA 2 NA
物质的量 1 mol 1 mol 2 mol
物质的量浓度 1 mol/L
1 mol/L
2 mol/L
3.溶液中微粒浓度的计量关系
你能得出什么结论?
3.溶液中微粒浓度的计量关系
①.定组成定律:
a.溶液中,阴离子与阳离子的物质的量浓度之比
等于化学组成中离子的个数之比
b.离子浓度=溶液浓度×溶质化学式中 该离子的个数
结论:
②电荷守恒:
在溶液中,阳离子所带的正电荷数
=阴离子所带的负电荷数。
3.溶液中微粒浓度的计量关系
n(Na+)×1=n(SO42-)×2+ n(Cl-)×1
c(Na+)= 2c(SO42-) + c(Cl-)
如Na2SO4和NaCl的混合溶液中:
1.已知在AlCl3溶液中Al3+的物质的量浓度为1mol·L-1,则Cl-的物质的量浓度是多少?
提示:
在溶液中,阴离子与阳离子的浓度之比等于
化学组成中的离子个数之比
所以 c(Cl-)=3c(Al3+)=3mol
4.物质的量浓度与溶质的质量分数的换算
M:溶质B的摩尔质量 ρ:溶液密度(g·mL-1)
换算公式:cB=
M
1000ρω
mol/L
5.溶质为气体的物质的量浓度的计算 《系》p50
①若已知溶液的体积
V(气体)
n
c
②若已知溶液密度
公式:cB=
MV+22400
1000ρV
mol/L
m
n
N
÷M
×M
× NA
÷ NA
V(g)
× Vm
÷Vm
V(aq)
×cB
÷cB
以物质的量为中心的化学计算
如何配制100g质量分数为20%的NaCl溶液的?
(1)计算
(2)称量:称NaCl的质量,量水的体积80mL(80g)
(3)溶解
(4)装瓶贴签
【新课导入】
【新课讲授】
换算成其他有关的溶质的物理量,通常固体算质量
控制溶液的总体积
怎样配制 100mL 1.0 mol/L 的NaCl溶液?
cB=
nB
V
精确计量溶液体积的仪器--容量瓶
①形状: 细颈,梨形,平底的玻璃瓶;带磨口玻璃塞。
②标志:容积,温度,刻度线。
③常见规格:100mL、250mL,
500mL、1000mL;
④唯一用途:配置一定物质的量浓度的溶液
1.用量筒量取5.8mL浓硫酸倒入100mL容量瓶中,然后加水定容,配制一定浓度的硫酸溶液,这样操作可以吗?
【提示】不可以,不能直接在容量瓶中稀释浓溶液,应在烧杯中进行。
⑤使用之前要检查是否漏水。
加水
倒立
观察
正立
瓶塞旋转180o
倒立
观察
1.容量瓶
【学思结合】
若实验时需480 mL NaCl溶液,需选用什么规格的容量瓶?
【答案】500mL容量瓶 。
容量瓶选用原则:“大而近”
所配溶液的体积等于或略小于容量瓶的容积。
1.容量瓶
⑥容量瓶读数要求:视线与凹液面最低处保持水平
俯视
液面低于刻度线
水加少了
仰视:
液面高于刻度线
水加多了
配制100 mL 1.00 mol/L NaCl溶液
0.1mol
5.85g
托盘天平
药匙
烧杯
玻璃棒
2.配制过程 教材P55 《系统集成》p52
100ml容量瓶
玻璃棒
2~3
100ml容量瓶
1~2cm
胶头滴管
凹液面最低点与刻度线相切
2.配制过程
配制过程八字口诀
计→量→溶→移→洗→定→摇→装
摇
俯视
液面低于刻度线
水加少了
仰视:
液面高于刻度线
水加多了
《系》p13
2.定容时俯视或仰视刻度线,会影响配制的结果吗?
【提示】俯视浓度偏高;仰视浓度偏低。
1.为什么要用蒸馏水洗涤烧杯,并将洗涤液也注入容量瓶?
【提示】烧杯上有少量溶质,不注入容量瓶会使浓度偏低。
2.如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
【提示】小了。有部分溶质损失。
【思考与讨论】 教材p56
4.若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?为什么?
【提示】必须重新配制,否则浓度偏低
3.你是用什么仪器称量NaCl固体的?如果是托盘天平,你称量的质量是多少?与计算结果一致吗?为什么?
【提示】托盘天平只能精确到0.1 g
【思考与讨论】 教材p56
5.摇匀后发现液面低于刻线,能否补充水?
【提示】不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
【学与问】
3、误差分析
=
mB
MBVaq
cB
=
nB
V
误差分析应归结为是对
溶质物质的量(或质量)和溶液体积的影响。
误差分析
详见《系统集成》p53
3、误差分析 托盘天平
可能引起误差的操作 过程分析 对c的影响
m V 天平的砝码沾有其他物质或生锈
调整天平零点时,游码放在刻度线右侧
药品和砝码的左右位置颠倒
称量易潮解物质的时间过长
用滤纸称量易潮解物质
溶质含有杂质
增大
不变
偏大
增大
不变
偏大
减小
不变
偏小
减小
不变
偏小
减小
不变
偏小
减小
不变
偏小
3、误差分析 烧杯和玻璃棒
可能引起误差的操作 过程分析 对c的影响
m V 溶解前烧杯内有水
搅拌时部分液体溅出
没有洗涤烧杯和玻璃棒
不变
不变
无影响
减小
不变
偏小
减小
不变
偏小
3、误差分析 容量瓶
可能引起误差的操作 过程分析 对c的影响
m V 没有冷却到室温就转移到容量瓶
向容量瓶转移溶液时有液体流出
定容时,水加多了,用滴管吸出
定容后振荡摇匀静置,液面下降没有加水
定容时,俯视刻度线
定容时,仰视刻度线
不变
减小
偏大
减小
不变
偏小
减小
不变
偏小
不变
不变
无影响
不变
减小
偏大
不变
增大
偏小
