2024-2025学年浙教版科学九上 专题培优检测《酸碱盐》(100分制)
文档属性
| 名称 | 2024-2025学年浙教版科学九上 专题培优检测《酸碱盐》(100分制) |

|
|
| 格式 | doc | ||
| 文件大小 | 446.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-09-19 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024九上科学专题培优检测《酸碱盐》
相对原子质量:C-12 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64 Zn-65
一、选择题(本题有15小题,每小题2分,共30分。请选出一个符合题意的正确选项)
1.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )
A.食盐 B.味精 C.食醋 D.香油
2 ( http: / / www.m / chemistry / report / detail / 40623493-9d37-4fdc-9be7-9e93aa381eff" \t "_blank ).有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图,它们在甲溶液和乙溶液中显示的颜色如表,下列判断错误的是( )
溶液指示剂 甲 乙
A 黄色 蓝色
B 无色 粉红色
A.甲溶液呈酸性
B.乙溶液的pH可能为11
C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色
3.装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。其中肯定不正确的是( )
4.若用实验证明CuSO4溶液显蓝色不是由SO42-离子造成的,下列实验无意义的是( )
A.观察K2SO4 溶液的颜色
B.向CuSO4 溶液滴加适量的NaOH 溶液,振荡后静置,溶液颜色消失
C.向CuSO4 溶液滴加适量的Ba(OH)2 溶液,振荡后静置,溶液颜色未消失
D.加水稀释后CuSO4 溶液颜色变浅
5.关于化学反应A+B=C+D,下列说法中正确的是( )
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C.若B是酸,则C和D一定有一种是盐
D.若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
6.有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④FeCl3,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
A.④③②① B.④①②③ C.①③④② D.①④②③
7.小明向盛有盐酸和MgCl2溶液的烧杯中加入一定量的NaOH溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液a于试管中,用下表中的试剂进行实验,相应结果错误的是( )
选项 试剂 现象和结论
A Zn粉 有气泡产生,则溶液a一定MgCl2
B CuO粉末 无明显现象,则溶液a一定有两种溶质
C NaOH溶液 无明显现象,则溶液a可能有NaOH
D CuSO4溶液 有蓝色沉淀,则溶液a一定有两种溶质
8.下列叙述不符合实验事实的是( )
A.将CO2气体通入Ca(OH)2溶液中,产生白色沉淀
B.在Na2CO3、K2SO4、AgNO3溶液中分别滴加BaCl2溶液,都有白色沉淀
C.滴有酚酞试液的蒸馏水中加入Fe(OH)3,溶液显红色
D.久置于空气中的熟石灰,加入稀盐酸有气泡产生
9.生物检索表常用于鉴定生物的种类。小金同学参照二歧分类检索表制作了氢氧化钙、盐酸、氢氧化钠、硫酸4种溶液的物质检索表(如表所示)。下列说法正确的是( )
A.甲表示盐酸 B.乙表示硫酸
C.丙表示硫酸 D.“△”代表的溶液呈碱性
10.下列关于物质的鉴别、除杂所选用的试剂或方法错误的是( )
选项 实验目的 试剂或方法
A 鉴别FeCl3、NaCl、NaOH、MgCl2四种溶液 不另加试剂
B 鉴别CaCO3、NaOH、NaCl、NH4NO3四种固体 水
C 除去MgCl2溶液中少量的CuCl2 加入过量铁粉、充分反应、过滤
D 除去N2中的少量O2 将气体缓缓通过灼热的铜网
11.某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A.与足量稀盐酸充分反应,用排水法收集到 VmL气体
B.与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C.与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干操,得到m2g固体
D.与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加 m3g
12.已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑可进行。在常温下,测得相同浓度的下列六种溶液的pH:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN
pH 8.8 8.6 11.6 10.3 11.1
表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是( )
A. CO2+H2O+2NaClO=Na2CO3+2HClO B. CO2+H2O+NaClO=NaHCO3+HClO
C. CH3COOH+NaCN=CH3COONa+HCN D. NaClO+CH3COOH=HClO+CH3COONa
13.表面布满铁锈的铁钉放入盛有稀硫酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
A.ab段压强变化不明显,说明还没有开始化学反应
B.bc段的化学反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
C.影响cd段压强变化的主要因素是温度
D.d点时恰好完全反应,且d点温度高于a点
14.向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过
程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( )
A.图中oa段表示生成气体的过程
B.b点溶液中溶质有2种
C.c点溶液的pH>7
D.x值为106.0
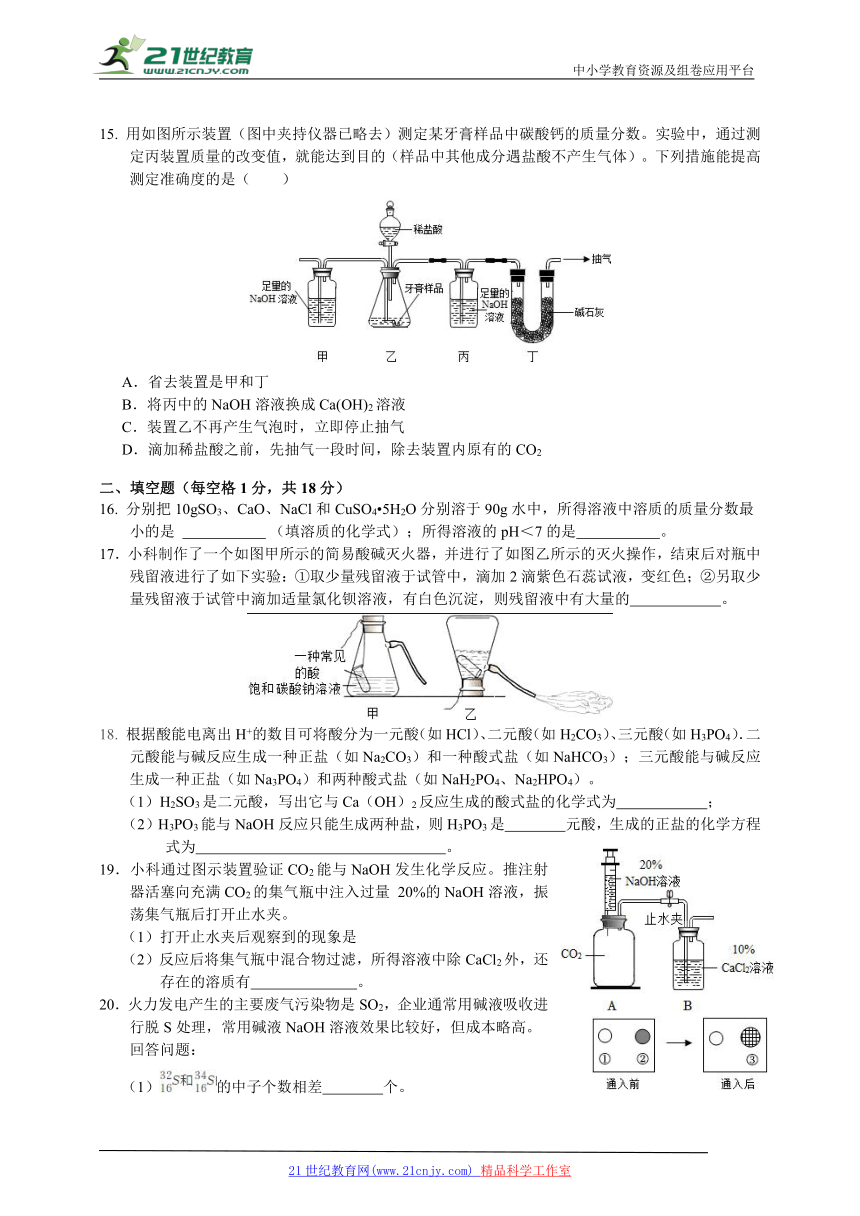
15. 用如图所示装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数。实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体)。下列措施能提高测定准确度的是( )
A.省去装置是甲和丁
B.将丙中的NaOH溶液换成Ca(OH)2溶液
C.装置乙不再产生气泡时,立即停止抽气
D.滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
二、填空题(每空格1分,共18分)
16. 分别把10gSO3、CaO、NaCl和CuSO4 5H2O分别溶于90g水中,所得溶液中溶质的质量分数最小的是 (填溶质的化学式);所得溶液的pH<7的是 。
+2
17.小科制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的 。
18. ( http: / / www.m / chemistry / report / detail / 54ae81a3-d7bf-404c-ae1b-8a1a0529c34e" \t "_blank ) 根据酸能电离出H+的数目可将酸分为一元酸(如HCl)、二元酸(如H2CO3)、三元酸(如H3PO4).二元酸能与碱反应生成一种正盐(如Na2CO3)和一种酸式盐(如NaHCO3);三元酸能与碱反应生成一种正盐(如Na3PO4)和两种酸式盐(如NaH2PO4、Na2HPO4)。
(1)H2SO3是二元酸,写出它与Ca(OH)2反应生成的酸式盐的化学式为 ;
(2)H3PO3能与NaOH反应只能生成两种盐,则H3PO3是 元酸,生成的正盐的化学方程式为 。
19.小科通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹。
(1)打开止水夹后观察到的现象是
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有 。
20.火力发电产生的主要废气污染物是SO2,企业通常用碱液吸收进行脱S处理,常用碱液NaOH溶液效果比较好,但成本略高。
回答问题:
(1)的中子个数相差 个。
(2)SO2气体通入碱池NaOH溶液前后,碱池中溶液的离子种类如图所示,其中能使无色酚酞试液变红的是 (填“①”、“②”或“③”)。
21.侯氏制碱法以氯化钠为原料制备纯碱,反应原理是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(NaHCO3在低温下溶解度较小)。
(1)流程图中操作A的名称是 ;
(2)NaHCO3固体在煅烧炉内分解,得到纯碱、可回收利用的物质X和水,请你写出该反应的化学方程式: 。
(3)将母液(NH4Cl与NaCl的混合溶液)浓缩、冷却后,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中,主要原因是 。
22.如图1所示,小瑾将反应后试管中的物质全部倒入烧杯时,发现烧杯内白色沉淀明显增多。为了探究烧杯内物质的成分,她立即向其中逐滴加入稀硝酸,并不断搅拌,烧杯内沉淀的质量随加入稀硝酸的质量变化如图2所示。
回答下列问题:
(1)图1所示,烧杯内的白色沉淀是 (写化学式)。
(2)BC段发生反应的化学方程式为 。
(3)A点,烧杯内的溶液中一定大量含有的离子为 (写离子符号)。B点,烧杯内的沉淀由 种物质组成。
(4)检验D点溶液中含有氯离子的方法 。
Ca(OH)2+CO2═CaCO3↓+H2O
三、实验探究题(每空2分,共26分)
23. 小科发现暖水瓶中有一层淡黄色的水垢。据悉,该地区的水垢中除碳酸钙外,无其它盐类。他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中的A装置高温加热充分反应(已知CaCO3高温CaO+CO2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式 。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 。
24. 白色固体碳酸氢铵(NH4HCO3)加热分解生成三种物质,请选用图中提供的实验装置,根据以下要求,填写空白。
(1)加热分解碳酸氢铵,白色固体应加入装置 中(填标号);
(2)产物之二是一种气体,通过装置E时,澄清石灰水变浑浊,则该产物是 CO2
(假设已除去另两种产物)
(3)碳酸氢铵加热分解的化学方程式为:
25.某学校项目小组同学进行了从海水中制取精盐的实践研究,具体过程如下:
(1)海水晒盐。用如图甲所示烧杯收集50毫升(mL)的海水,并置于阳光下曝晒。已知曝晒过程中,海水中食盐的溶质质量分数A%随时间t的变化曲线如图乙所示。
①当海水中食盐的溶质质量分数从a%升到b%(b%=2a%)时,请在图甲烧杯中画出此时刻大致的水位线位置。
②由图乙中可知,从 点开始析出粗盐。(填字母)
(2)溶解过滤。将粗盐溶解,并用漏斗和滤纸搭建的装置去除其中的泥沙。正确过滤后,展开滤纸,若灰色代表泥沙,则看到的情况最接近下图中的 。(填字母)
A. B. C. D.
(3)蒸发结晶。为防止蒸发过程中,液体局部温度过高出现爆沸,小组同学设计了一款温度显示计,电路如图丙。图中RA是阻值随温度升高而减小的热敏电阻,R0 是定值电阻。现要将电表改装为温度显示屏,要求温度越高,电表示数越大。小明认为可用电压表改装,小红认为可用电流表改装,小科认为两个电表都可以,你支持谁的观点,并说明理由 。
26.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
【实验一】科学小组用压强传感器装置(如图1),测定二氧化碳与氢氧化钠溶液产生喷泉的实验过程中,三颈烧瓶内压强的变化(如图2)。
实验过程:室温下,将装满二氧化碳的三颈烧瓶安装在铁架台上,用单孔塞(插有装水的注射器)
塞紧瓶口a,数据采集器采集起始气压。将注射器内水压入瓶内,打开止水夹b,烧杯内的NaOH溶液喷到三颈烧瓶内形成喷泉。
(1)试分析图1中形成喷泉的原因: 。
(2)图2中A、B、C、D、E哪点时喷泉现象最剧烈: 。
【实验二】科学小组利用喷泉原理设计连锁反应装置(如图3)。
实验过程:圆底烧瓶内有收集满的二氧化碳,如图3组装装置。用注射器缓缓注入3毫升NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生喷泉,与此同时,试管C、E中发生连锁反应。
(3)实验中,试管C中的现象是 。
(4)实验结束后,同学们将试管C、E中的物质全部倒入一个洁净的废液缸中充分搅拌、静置,观察到废液缸内蓝色絮状沉淀消失溶液呈蓝色。最终,废液缸中一定含的溶质为 。
四、解答题(第27题5分,28、29题各6分,30题9分,共26分)
27. 某科技活动小组为了制取SO2,查阅资料发现,产生SO2的途径很多。在老师指导下,他们根据实验室条件,选取足量锌与适量的浓硫酸反应,其化学方程式为:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。反应一段时间后,老师指出还可能生成另一种气体。同学们都很好奇,这是什么气体呢 请你根据锌的化学性质,推断此气体可能是 ,其理由是
。通过该实验,你对物质变化规律,会有什么新的认识 你的观点是 。SO2是一种有毒气体,容易造成空气污染,与雨水结合会形成酸雨,写出SO2与水反应的方程式 。下列建筑材料容易被酸雨腐蚀的是(填字母) 。
A. 铜栏杆 B. 铝合金 C. 大理石 D. 玻璃
28.用你所学的化学知识回答问题。
(1)打开汽水瓶盖时,汽水会自动喷出来;饮用刚刚打开的汽水时,常常会打嗝。请依顺序分别解释产生上述现象的原因。
(2)某同学在探究中和反应实验时设计如下方案:将适量稀盐酸倒入锥形瓶中,滴入酚酞溶液后,慢慢滴加氢氧化钠溶液并不断搅拌.通过溶液刚刚变红来判断中和反应恰好完成,请分析上述方案是否合理并说明理由。
29.治污水是“五水共治”内容之一。根据国家标准,废水排放时铅元素的含量不允许超过 1.0毫克/升。蓄电池生产企业往往采用化学沉淀法处理 Pb2+ ,其中以氢氧化物沉淀法应用较多。
(1)根据右表信息,沉淀剂除了NaOH 外,还可使用的两种钠盐是 __________。
20℃ 时,各种铅的化合物在水中的溶解度:
物质 溶解度/ g 物质 溶解度/ g
Pb(NO3 ) 2 54.3 PbCO3 7.3×10-5
Pb(OH) 2 1.6×10-4 PbS 6.8×10-13
(2)在弱碱性环境中,氢氧化铅的沉淀更完全。此时废水经沉淀过滤后,检测出铅元素含量仅为 0.0207 毫克/升。假设废水中的铅元素全部以 Pb ( OH )2 的形式存在,请你通过计算确定,此时 1 升废水中溶解的 Pb ( OH )2 是多少毫克
30.市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO3 Na2CO3+H2O+CO2↑(NaHCO3在50℃以上开始逐渐分解)
性质二:NaHCO3+HCl═NaCl+H2O+CO2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝入体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (填“—”或“二”),理由是 。
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否准确。
(2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑)
序号 反应前 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液质量/克 0 10 10 10 10 10
C装置中溶液总质量/克 100.0 101.1 102.2 103.3 104.4 105.0
(3)如果去掉装置B,测量结果将会 (填“偏大”或“偏小”)。
参考答案
一、选择题(30分)
1-5 CDBDC 6-10 BBCDC 11-15 BACBD
二、填空题(18分)
16、Ca(OH)2 H2SO4
17、硫酸钠、硫酸
18、(1)Ca(HSO3)2 二 (2)H3PO3+2NaOH=Na2HPO3+2H2O
19、(1)氯化钙溶液流入左边集气瓶中,并且溶液变浑浊 (2)NaOH和NaCl
20、2 ②
21、(1)过滤 (3)NaHCO3在低温下溶解度较小
22、(1)BaSO4、BaCO3
(2)BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑
(3)Na+、Cl-、SO42- 2
(4)静置,取上层清液少许于一只洁净的试管中,向其中滴加硝酸银溶液,有白色沉淀生成。
三、探究题(26分)
23、(1)2NaOH+CO2═Na2CO3+H2O 吸水 80%
(2)浓盐酸具有挥发性,与氢氧化钙反应(或浓盐酸有挥发性,产生的沉淀被盐酸溶解)
24、(1)B (2)CO2 (3)NH4HCO3=== NH3↑+CO2↑+H2O
25、(1)①见解答 ②c (2)D
(3)小科。当温度升高时,热敏电阻减小,电路的总电阻减小,根据欧姆定律可知,电路中的电流增大,根据U=IR知,定值电阻的电压增大。
26、(1)二氧化碳能溶于水且与水反应,气体体积减小,导致三颈烧瓶内压强减小,在大气压的作用下,将烧杯内的NaOH溶液沿导管压入三颈烧瓶内形成喷泉
(2)C (3)红色消失 (4)NaCl、CuCl2、Na2SO4
四、解答题(26分)
27、H2 随着水的生成,硫酸浓度降低,锌与稀硫酸反应生成氢气 生成物可能改变原有反应物的性质或状态 SO2+H2O=H2SO3 B、C
28、(1)CO2的溶解度随压强的减小而减小 CO2的溶解度随温度的升高而减小
(2)不合理,恰好完全中和时溶液不变色
29、(1)Na2CO3 、Na2S
(2)解法一: 0.0207 毫克 ÷ =0.0207 毫克 ×=0.0241 毫克
解法二:设 1 升废水中溶解的 Pb ( OH )2 的质量为 m
Pb ~ Pb ( OH ) 2
207 241
0.0207 毫克 m
=
m =0.0241毫克
30、(1)二 人体内不能达到50℃的温度或人体内有盐酸
(2)解:生成二氧化碳的质量为105.0g-100.0g=5.0g
所以包装袋上的标注不准确。
(3)偏大
△
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com) 精品科学工作室
2024九上科学专题培优检测《酸碱盐》
相对原子质量:C-12 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64 Zn-65
一、选择题(本题有15小题,每小题2分,共30分。请选出一个符合题意的正确选项)
1.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )
A.食盐 B.味精 C.食醋 D.香油
2 ( http: / / www.m / chemistry / report / detail / 40623493-9d37-4fdc-9be7-9e93aa381eff" \t "_blank ).有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图,它们在甲溶液和乙溶液中显示的颜色如表,下列判断错误的是( )
溶液指示剂 甲 乙
A 黄色 蓝色
B 无色 粉红色
A.甲溶液呈酸性
B.乙溶液的pH可能为11
C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色
3.装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。其中肯定不正确的是( )
4.若用实验证明CuSO4溶液显蓝色不是由SO42-离子造成的,下列实验无意义的是( )
A.观察K2SO4 溶液的颜色
B.向CuSO4 溶液滴加适量的NaOH 溶液,振荡后静置,溶液颜色消失
C.向CuSO4 溶液滴加适量的Ba(OH)2 溶液,振荡后静置,溶液颜色未消失
D.加水稀释后CuSO4 溶液颜色变浅
5.关于化学反应A+B=C+D,下列说法中正确的是( )
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C.若B是酸,则C和D一定有一种是盐
D.若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
6.有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④FeCl3,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
A.④③②① B.④①②③ C.①③④② D.①④②③
7.小明向盛有盐酸和MgCl2溶液的烧杯中加入一定量的NaOH溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液a于试管中,用下表中的试剂进行实验,相应结果错误的是( )
选项 试剂 现象和结论
A Zn粉 有气泡产生,则溶液a一定MgCl2
B CuO粉末 无明显现象,则溶液a一定有两种溶质
C NaOH溶液 无明显现象,则溶液a可能有NaOH
D CuSO4溶液 有蓝色沉淀,则溶液a一定有两种溶质
8.下列叙述不符合实验事实的是( )
A.将CO2气体通入Ca(OH)2溶液中,产生白色沉淀
B.在Na2CO3、K2SO4、AgNO3溶液中分别滴加BaCl2溶液,都有白色沉淀
C.滴有酚酞试液的蒸馏水中加入Fe(OH)3,溶液显红色
D.久置于空气中的熟石灰,加入稀盐酸有气泡产生
9.生物检索表常用于鉴定生物的种类。小金同学参照二歧分类检索表制作了氢氧化钙、盐酸、氢氧化钠、硫酸4种溶液的物质检索表(如表所示)。下列说法正确的是( )
A.甲表示盐酸 B.乙表示硫酸
C.丙表示硫酸 D.“△”代表的溶液呈碱性
10.下列关于物质的鉴别、除杂所选用的试剂或方法错误的是( )
选项 实验目的 试剂或方法
A 鉴别FeCl3、NaCl、NaOH、MgCl2四种溶液 不另加试剂
B 鉴别CaCO3、NaOH、NaCl、NH4NO3四种固体 水
C 除去MgCl2溶液中少量的CuCl2 加入过量铁粉、充分反应、过滤
D 除去N2中的少量O2 将气体缓缓通过灼热的铜网
11.某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A.与足量稀盐酸充分反应,用排水法收集到 VmL气体
B.与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C.与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干操,得到m2g固体
D.与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加 m3g
12.已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑可进行。在常温下,测得相同浓度的下列六种溶液的pH:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN
pH 8.8 8.6 11.6 10.3 11.1
表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是( )
A. CO2+H2O+2NaClO=Na2CO3+2HClO B. CO2+H2O+NaClO=NaHCO3+HClO
C. CH3COOH+NaCN=CH3COONa+HCN D. NaClO+CH3COOH=HClO+CH3COONa
13.表面布满铁锈的铁钉放入盛有稀硫酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
A.ab段压强变化不明显,说明还没有开始化学反应
B.bc段的化学反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
C.影响cd段压强变化的主要因素是温度
D.d点时恰好完全反应,且d点温度高于a点
14.向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过
程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( )
A.图中oa段表示生成气体的过程
B.b点溶液中溶质有2种
C.c点溶液的pH>7
D.x值为106.0
15. 用如图所示装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数。实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体)。下列措施能提高测定准确度的是( )
A.省去装置是甲和丁
B.将丙中的NaOH溶液换成Ca(OH)2溶液
C.装置乙不再产生气泡时,立即停止抽气
D.滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
二、填空题(每空格1分,共18分)
16. 分别把10gSO3、CaO、NaCl和CuSO4 5H2O分别溶于90g水中,所得溶液中溶质的质量分数最小的是 (填溶质的化学式);所得溶液的pH<7的是 。
+2
17.小科制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的 。
18. ( http: / / www.m / chemistry / report / detail / 54ae81a3-d7bf-404c-ae1b-8a1a0529c34e" \t "_blank ) 根据酸能电离出H+的数目可将酸分为一元酸(如HCl)、二元酸(如H2CO3)、三元酸(如H3PO4).二元酸能与碱反应生成一种正盐(如Na2CO3)和一种酸式盐(如NaHCO3);三元酸能与碱反应生成一种正盐(如Na3PO4)和两种酸式盐(如NaH2PO4、Na2HPO4)。
(1)H2SO3是二元酸,写出它与Ca(OH)2反应生成的酸式盐的化学式为 ;
(2)H3PO3能与NaOH反应只能生成两种盐,则H3PO3是 元酸,生成的正盐的化学方程式为 。
19.小科通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,振荡集气瓶后打开止水夹。
(1)打开止水夹后观察到的现象是
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有 。
20.火力发电产生的主要废气污染物是SO2,企业通常用碱液吸收进行脱S处理,常用碱液NaOH溶液效果比较好,但成本略高。
回答问题:
(1)的中子个数相差 个。
(2)SO2气体通入碱池NaOH溶液前后,碱池中溶液的离子种类如图所示,其中能使无色酚酞试液变红的是 (填“①”、“②”或“③”)。
21.侯氏制碱法以氯化钠为原料制备纯碱,反应原理是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(NaHCO3在低温下溶解度较小)。
(1)流程图中操作A的名称是 ;
(2)NaHCO3固体在煅烧炉内分解,得到纯碱、可回收利用的物质X和水,请你写出该反应的化学方程式: 。
(3)将母液(NH4Cl与NaCl的混合溶液)浓缩、冷却后,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中,主要原因是 。
22.如图1所示,小瑾将反应后试管中的物质全部倒入烧杯时,发现烧杯内白色沉淀明显增多。为了探究烧杯内物质的成分,她立即向其中逐滴加入稀硝酸,并不断搅拌,烧杯内沉淀的质量随加入稀硝酸的质量变化如图2所示。
回答下列问题:
(1)图1所示,烧杯内的白色沉淀是 (写化学式)。
(2)BC段发生反应的化学方程式为 。
(3)A点,烧杯内的溶液中一定大量含有的离子为 (写离子符号)。B点,烧杯内的沉淀由 种物质组成。
(4)检验D点溶液中含有氯离子的方法 。
Ca(OH)2+CO2═CaCO3↓+H2O
三、实验探究题(每空2分,共26分)
23. 小科发现暖水瓶中有一层淡黄色的水垢。据悉,该地区的水垢中除碳酸钙外,无其它盐类。他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中的A装置高温加热充分反应(已知CaCO3高温CaO+CO2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式 。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 。
24. 白色固体碳酸氢铵(NH4HCO3)加热分解生成三种物质,请选用图中提供的实验装置,根据以下要求,填写空白。
(1)加热分解碳酸氢铵,白色固体应加入装置 中(填标号);
(2)产物之二是一种气体,通过装置E时,澄清石灰水变浑浊,则该产物是 CO2
(假设已除去另两种产物)
(3)碳酸氢铵加热分解的化学方程式为:
25.某学校项目小组同学进行了从海水中制取精盐的实践研究,具体过程如下:
(1)海水晒盐。用如图甲所示烧杯收集50毫升(mL)的海水,并置于阳光下曝晒。已知曝晒过程中,海水中食盐的溶质质量分数A%随时间t的变化曲线如图乙所示。
①当海水中食盐的溶质质量分数从a%升到b%(b%=2a%)时,请在图甲烧杯中画出此时刻大致的水位线位置。
②由图乙中可知,从 点开始析出粗盐。(填字母)
(2)溶解过滤。将粗盐溶解,并用漏斗和滤纸搭建的装置去除其中的泥沙。正确过滤后,展开滤纸,若灰色代表泥沙,则看到的情况最接近下图中的 。(填字母)
A. B. C. D.
(3)蒸发结晶。为防止蒸发过程中,液体局部温度过高出现爆沸,小组同学设计了一款温度显示计,电路如图丙。图中RA是阻值随温度升高而减小的热敏电阻,R0 是定值电阻。现要将电表改装为温度显示屏,要求温度越高,电表示数越大。小明认为可用电压表改装,小红认为可用电流表改装,小科认为两个电表都可以,你支持谁的观点,并说明理由 。
26.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
【实验一】科学小组用压强传感器装置(如图1),测定二氧化碳与氢氧化钠溶液产生喷泉的实验过程中,三颈烧瓶内压强的变化(如图2)。
实验过程:室温下,将装满二氧化碳的三颈烧瓶安装在铁架台上,用单孔塞(插有装水的注射器)
塞紧瓶口a,数据采集器采集起始气压。将注射器内水压入瓶内,打开止水夹b,烧杯内的NaOH溶液喷到三颈烧瓶内形成喷泉。
(1)试分析图1中形成喷泉的原因: 。
(2)图2中A、B、C、D、E哪点时喷泉现象最剧烈: 。
【实验二】科学小组利用喷泉原理设计连锁反应装置(如图3)。
实验过程:圆底烧瓶内有收集满的二氧化碳,如图3组装装置。用注射器缓缓注入3毫升NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生喷泉,与此同时,试管C、E中发生连锁反应。
(3)实验中,试管C中的现象是 。
(4)实验结束后,同学们将试管C、E中的物质全部倒入一个洁净的废液缸中充分搅拌、静置,观察到废液缸内蓝色絮状沉淀消失溶液呈蓝色。最终,废液缸中一定含的溶质为 。
四、解答题(第27题5分,28、29题各6分,30题9分,共26分)
27. 某科技活动小组为了制取SO2,查阅资料发现,产生SO2的途径很多。在老师指导下,他们根据实验室条件,选取足量锌与适量的浓硫酸反应,其化学方程式为:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。反应一段时间后,老师指出还可能生成另一种气体。同学们都很好奇,这是什么气体呢 请你根据锌的化学性质,推断此气体可能是 ,其理由是
。通过该实验,你对物质变化规律,会有什么新的认识 你的观点是 。SO2是一种有毒气体,容易造成空气污染,与雨水结合会形成酸雨,写出SO2与水反应的方程式 。下列建筑材料容易被酸雨腐蚀的是(填字母) 。
A. 铜栏杆 B. 铝合金 C. 大理石 D. 玻璃
28.用你所学的化学知识回答问题。
(1)打开汽水瓶盖时,汽水会自动喷出来;饮用刚刚打开的汽水时,常常会打嗝。请依顺序分别解释产生上述现象的原因。
(2)某同学在探究中和反应实验时设计如下方案:将适量稀盐酸倒入锥形瓶中,滴入酚酞溶液后,慢慢滴加氢氧化钠溶液并不断搅拌.通过溶液刚刚变红来判断中和反应恰好完成,请分析上述方案是否合理并说明理由。
29.治污水是“五水共治”内容之一。根据国家标准,废水排放时铅元素的含量不允许超过 1.0毫克/升。蓄电池生产企业往往采用化学沉淀法处理 Pb2+ ,其中以氢氧化物沉淀法应用较多。
(1)根据右表信息,沉淀剂除了NaOH 外,还可使用的两种钠盐是 __________。
20℃ 时,各种铅的化合物在水中的溶解度:
物质 溶解度/ g 物质 溶解度/ g
Pb(NO3 ) 2 54.3 PbCO3 7.3×10-5
Pb(OH) 2 1.6×10-4 PbS 6.8×10-13
(2)在弱碱性环境中,氢氧化铅的沉淀更完全。此时废水经沉淀过滤后,检测出铅元素含量仅为 0.0207 毫克/升。假设废水中的铅元素全部以 Pb ( OH )2 的形式存在,请你通过计算确定,此时 1 升废水中溶解的 Pb ( OH )2 是多少毫克
30.市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO3 Na2CO3+H2O+CO2↑(NaHCO3在50℃以上开始逐渐分解)
性质二:NaHCO3+HCl═NaCl+H2O+CO2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝入体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (填“—”或“二”),理由是 。
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否准确。
(2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑)
序号 反应前 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液质量/克 0 10 10 10 10 10
C装置中溶液总质量/克 100.0 101.1 102.2 103.3 104.4 105.0
(3)如果去掉装置B,测量结果将会 (填“偏大”或“偏小”)。
参考答案
一、选择题(30分)
1-5 CDBDC 6-10 BBCDC 11-15 BACBD
二、填空题(18分)
16、Ca(OH)2 H2SO4
17、硫酸钠、硫酸
18、(1)Ca(HSO3)2 二 (2)H3PO3+2NaOH=Na2HPO3+2H2O
19、(1)氯化钙溶液流入左边集气瓶中,并且溶液变浑浊 (2)NaOH和NaCl
20、2 ②
21、(1)过滤 (3)NaHCO3在低温下溶解度较小
22、(1)BaSO4、BaCO3
(2)BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑
(3)Na+、Cl-、SO42- 2
(4)静置,取上层清液少许于一只洁净的试管中,向其中滴加硝酸银溶液,有白色沉淀生成。
三、探究题(26分)
23、(1)2NaOH+CO2═Na2CO3+H2O 吸水 80%
(2)浓盐酸具有挥发性,与氢氧化钙反应(或浓盐酸有挥发性,产生的沉淀被盐酸溶解)
24、(1)B (2)CO2 (3)NH4HCO3=== NH3↑+CO2↑+H2O
25、(1)①见解答 ②c (2)D
(3)小科。当温度升高时,热敏电阻减小,电路的总电阻减小,根据欧姆定律可知,电路中的电流增大,根据U=IR知,定值电阻的电压增大。
26、(1)二氧化碳能溶于水且与水反应,气体体积减小,导致三颈烧瓶内压强减小,在大气压的作用下,将烧杯内的NaOH溶液沿导管压入三颈烧瓶内形成喷泉
(2)C (3)红色消失 (4)NaCl、CuCl2、Na2SO4
四、解答题(26分)
27、H2 随着水的生成,硫酸浓度降低,锌与稀硫酸反应生成氢气 生成物可能改变原有反应物的性质或状态 SO2+H2O=H2SO3 B、C
28、(1)CO2的溶解度随压强的减小而减小 CO2的溶解度随温度的升高而减小
(2)不合理,恰好完全中和时溶液不变色
29、(1)Na2CO3 、Na2S
(2)解法一: 0.0207 毫克 ÷ =0.0207 毫克 ×=0.0241 毫克
解法二:设 1 升废水中溶解的 Pb ( OH )2 的质量为 m
Pb ~ Pb ( OH ) 2
207 241
0.0207 毫克 m
=
m =0.0241毫克
30、(1)二 人体内不能达到50℃的温度或人体内有盐酸
(2)解:生成二氧化碳的质量为105.0g-100.0g=5.0g
所以包装袋上的标注不准确。
(3)偏大
△
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com) 精品科学工作室
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
