1.2离子反应讲课 说课课件 (共22张PPT) 2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应讲课 说课课件 (共22张PPT) 2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-19 21:22:10 | ||
图片预览



文档简介
(共22张PPT)
离子反应
生活现象
烧水壶用一段时间之后,会有一层厚厚的水垢
水垢如果不去除会对烧水壶导热产生一定的影响,并且对我们的健康也会有一定的危害,通常可以用醋来去除水垢,这是什么原因呢?
接下来就让我们一起来探究这其中的原理和奥秘
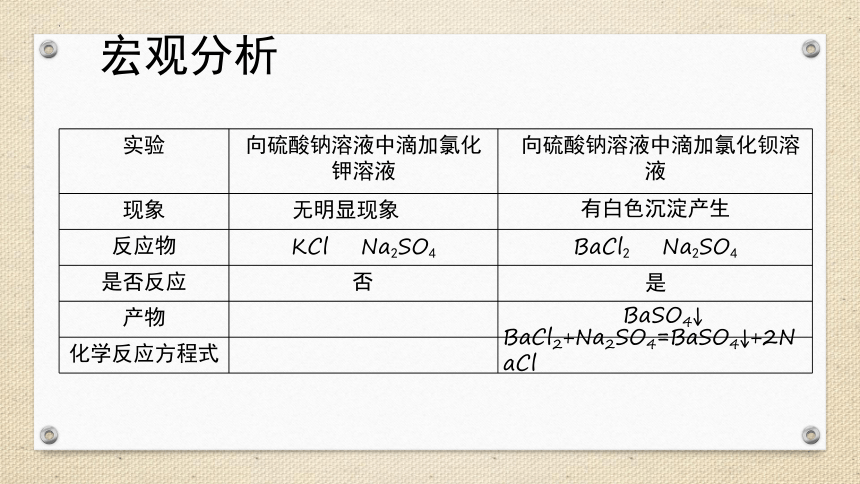
宏观分析
实验 向硫酸钠溶液中滴加氯化钾溶液 向硫酸钠溶液中滴加氯化钡溶液
现象
反应物 KCl Na2SO4 BaCl2 Na2SO4
是否反应
产物
化学反应方程式
无明显现象
有白色沉淀产生
否
是
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4↓
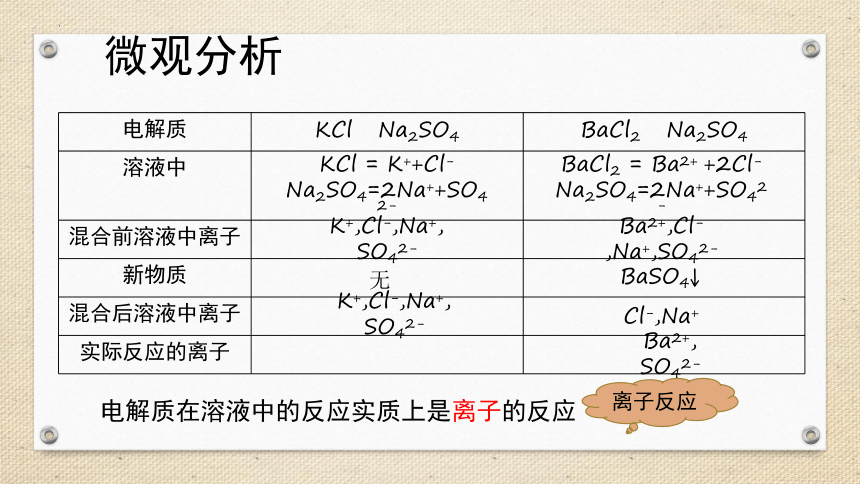
微观分析
电解质 KCl Na2SO4 BaCl2 Na2SO4
溶液中
混合前溶液中离子
新物质
混合后溶液中离子
实际反应的离子
电解质在溶液中的反应实质上是离子的反应
KCl = K++Cl-
Na2SO4=2Na++SO42-
BaCl2 = Ba2+ +2Cl-
Na2SO4=2Na++SO42-
K+,Cl-,Na+, SO42-
Ba2+,Cl-,Na+,SO42-
无
BaSO4↓
K+,Cl-,Na+, SO42-
Cl-,Na+
Ba2+, SO42-
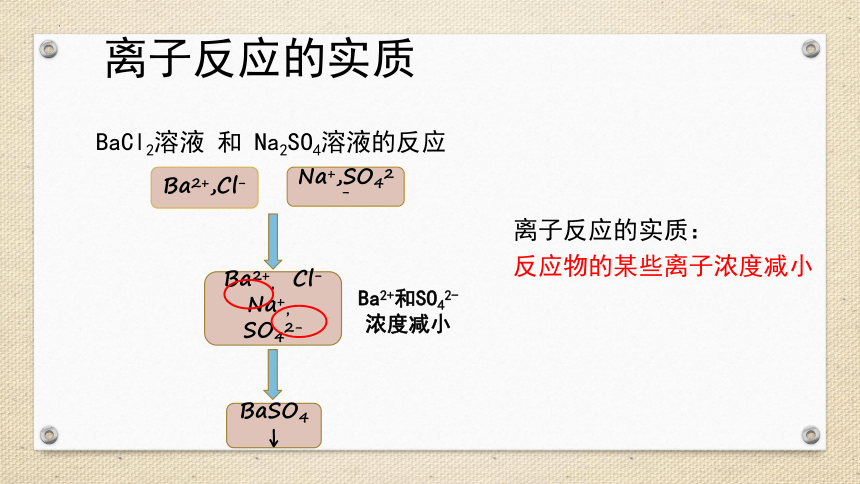
离子反应
离子反应的实质
BaCl2溶液 和 Na2SO4溶液的反应
离子反应的实质:
反应物的某些离子浓度减小
Ba2+,Cl-
Na+,SO42-
Ba2+, Cl-
Na+, SO42-
BaSO4↓
Ba2+和SO42-浓度减小
BaCl2 ,Na2SO4 NaOH,HCl Na2CO3,HCl
化学方程式
类型 离子反应的条件
沉淀
气体
水
BaCl2+Na2SO4=BaSO4↓+2NaCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
复分解反应
总结
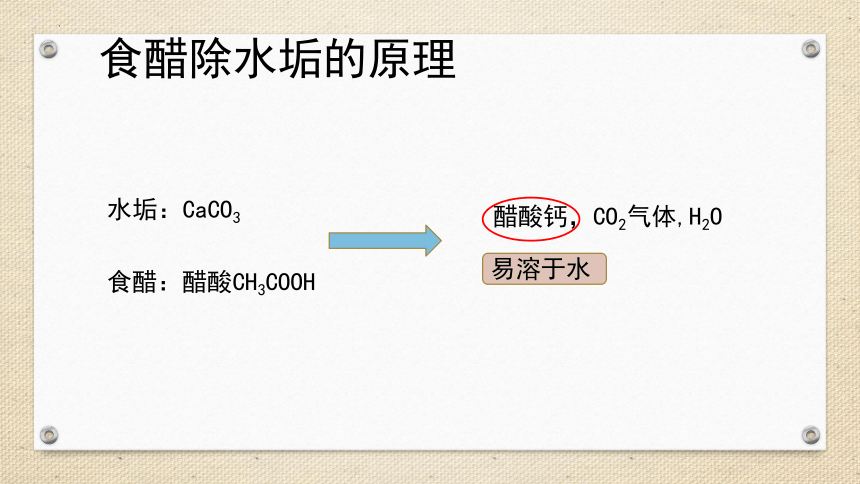
食醋除水垢的原理
水垢:CaCO3
食醋:醋酸CH3COOH
醋酸钙,CO2气体,H2O
易溶于水
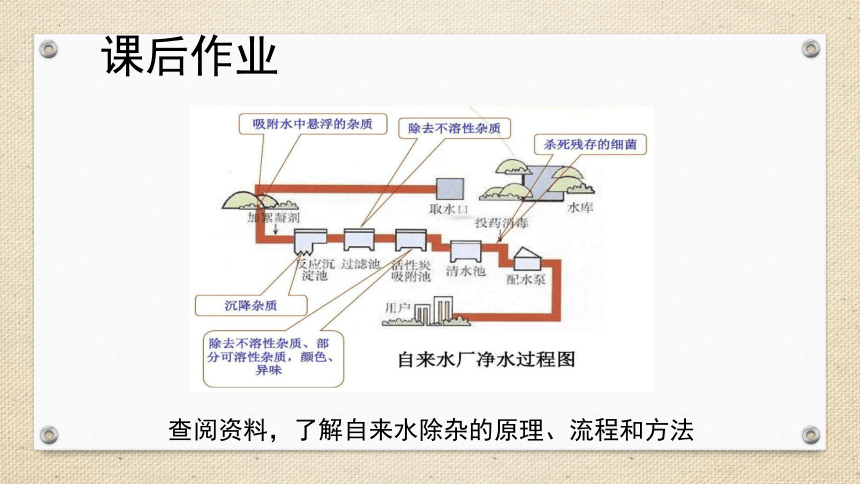
课后作业
查阅资料,了解自来水除杂的原理、流程和方法
离子反应说课
教材分析
01
学情分析
02
教学目标
03
教学过程
04
板书设计
05
目录
教学反思
06
教材分析
选自人教版高中化学必修一第一章第二节
揭示溶液中化学反应的本质,巩固前面学过的电离初步知识
承上
启下
为后面元素化合物知识电解质溶液的学习奠定了一定的基础
学情分析
知识储备
思维转变
学生已初步掌握电解质、电离等概念,复分解反应相关知识,在初中阶段具备一定的实验操作能力。
学生思维活跃,正处于由直观、形象向逻辑、抽象思维的转变过程
授课对象是高一年级的学生
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
科学态度与社会责任
变化观念与平衡思想
教学目标
通过对于溶液中离子移动和离子之间的反应,形成离子反应的化学概念
通过实验分析与总结,认识离子反应发生的本质,以及复分解型离子反应的条件。培养科学实验与探究意识
通过生活中的问题,认识化学在生活中的运用,并利用所学知识,解决生活中的实际问题,增强社会责任感,养成科学态度,培养责任担当。
重点
难点
教学过程
情景导入
实验分析
回归生活
探究总结
问题导入
食醋除水垢导入
原理
对比实验:KCl溶液和Na2SO4溶液 BaCl2溶液和Na2SO4溶液
实验分析
观察现象
宏观分析
微观探析
引出概念
培养学生的宏观辨识与微观探析的能力以及科学探究的精神
探讨本质
培养学生变化观念和平衡思想的意识
探究
NaOH和HCl
Na2CO3和HCl
溶液
总结
归纳所得产物
探究反应条件
离子反应定义本质和条件
探究总结
培养学生证据推理与模型认知能力
回归生活
培养学生的科学态度与社会责任
溶液中
反应物某种离子浓度减小
有沉淀、气体、水生成
BaCl2和Na2SO4反应
宏观:生成白色沉淀
微观:Ba2+, SO42-浓度减小
本质
条件
反应
离子反应
不足
亮点
教学设计具有逻辑性,教学思路承上启下,联系生活实际
时间限制,讲授内容不够完整,对学生了解不够确切
改进
适当的增设与学生互动的环节,注重引导学生,进一步了解学生知识掌握情况
教学反思
感谢聆听!
离子反应
生活现象
烧水壶用一段时间之后,会有一层厚厚的水垢
水垢如果不去除会对烧水壶导热产生一定的影响,并且对我们的健康也会有一定的危害,通常可以用醋来去除水垢,这是什么原因呢?
接下来就让我们一起来探究这其中的原理和奥秘
宏观分析
实验 向硫酸钠溶液中滴加氯化钾溶液 向硫酸钠溶液中滴加氯化钡溶液
现象
反应物 KCl Na2SO4 BaCl2 Na2SO4
是否反应
产物
化学反应方程式
无明显现象
有白色沉淀产生
否
是
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4↓
微观分析
电解质 KCl Na2SO4 BaCl2 Na2SO4
溶液中
混合前溶液中离子
新物质
混合后溶液中离子
实际反应的离子
电解质在溶液中的反应实质上是离子的反应
KCl = K++Cl-
Na2SO4=2Na++SO42-
BaCl2 = Ba2+ +2Cl-
Na2SO4=2Na++SO42-
K+,Cl-,Na+, SO42-
Ba2+,Cl-,Na+,SO42-
无
BaSO4↓
K+,Cl-,Na+, SO42-
Cl-,Na+
Ba2+, SO42-
离子反应
离子反应的实质
BaCl2溶液 和 Na2SO4溶液的反应
离子反应的实质:
反应物的某些离子浓度减小
Ba2+,Cl-
Na+,SO42-
Ba2+, Cl-
Na+, SO42-
BaSO4↓
Ba2+和SO42-浓度减小
BaCl2 ,Na2SO4 NaOH,HCl Na2CO3,HCl
化学方程式
类型 离子反应的条件
沉淀
气体
水
BaCl2+Na2SO4=BaSO4↓+2NaCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
复分解反应
总结
食醋除水垢的原理
水垢:CaCO3
食醋:醋酸CH3COOH
醋酸钙,CO2气体,H2O
易溶于水
课后作业
查阅资料,了解自来水除杂的原理、流程和方法
离子反应说课
教材分析
01
学情分析
02
教学目标
03
教学过程
04
板书设计
05
目录
教学反思
06
教材分析
选自人教版高中化学必修一第一章第二节
揭示溶液中化学反应的本质,巩固前面学过的电离初步知识
承上
启下
为后面元素化合物知识电解质溶液的学习奠定了一定的基础
学情分析
知识储备
思维转变
学生已初步掌握电解质、电离等概念,复分解反应相关知识,在初中阶段具备一定的实验操作能力。
学生思维活跃,正处于由直观、形象向逻辑、抽象思维的转变过程
授课对象是高一年级的学生
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
科学态度与社会责任
变化观念与平衡思想
教学目标
通过对于溶液中离子移动和离子之间的反应,形成离子反应的化学概念
通过实验分析与总结,认识离子反应发生的本质,以及复分解型离子反应的条件。培养科学实验与探究意识
通过生活中的问题,认识化学在生活中的运用,并利用所学知识,解决生活中的实际问题,增强社会责任感,养成科学态度,培养责任担当。
重点
难点
教学过程
情景导入
实验分析
回归生活
探究总结
问题导入
食醋除水垢导入
原理
对比实验:KCl溶液和Na2SO4溶液 BaCl2溶液和Na2SO4溶液
实验分析
观察现象
宏观分析
微观探析
引出概念
培养学生的宏观辨识与微观探析的能力以及科学探究的精神
探讨本质
培养学生变化观念和平衡思想的意识
探究
NaOH和HCl
Na2CO3和HCl
溶液
总结
归纳所得产物
探究反应条件
离子反应定义本质和条件
探究总结
培养学生证据推理与模型认知能力
回归生活
培养学生的科学态度与社会责任
溶液中
反应物某种离子浓度减小
有沉淀、气体、水生成
BaCl2和Na2SO4反应
宏观:生成白色沉淀
微观:Ba2+, SO42-浓度减小
本质
条件
反应
离子反应
不足
亮点
教学设计具有逻辑性,教学思路承上启下,联系生活实际
时间限制,讲授内容不够完整,对学生了解不够确切
改进
适当的增设与学生互动的环节,注重引导学生,进一步了解学生知识掌握情况
教学反思
感谢聆听!
